黑果枸杞花青素类型、含量及结构分析研究
杭园园,李悦,王朝警,束彤,陈虎,王茜,王树林,,*
(1.青海大学农牧学院,青海西宁810016;2.青海大学省部共建三江源生态与高原农牧业国家重点实验室,青海西宁810016)
花青素(anthocyanidin),是自然界中常见的水溶性色素,是一种强有力的抗氧化剂,其基本结构为3,5,7-三羟基-2-苯基苯并吡喃,通常以糖苷化和酰基化的形式存在[1-7]。目前已知的花青素有23种,最常见的是飞燕草素、矢车菊素、矮牵牛素、天竺葵素、芍药素和锦葵素6种[8]。
黑果枸杞(Lycium ruthenicum Murr.)系茄科枸杞属植物,因其耐干旱性强,有保持水土的作用,又易栽培,因此作为近年来的研究热点[9-11]。当前,国内外对花青素采用的便捷且有效的方法就是辅助(微波、超声波等)提取法[12-13]。花青素的纯化主要采用大孔树脂吸附法、柱层析法、高效液相色谱(high performance liquid chromatography,HPLC)法和膜分离法等方法[14-15]。
目前,各国学者对紫薯、紫甘蓝以及蓝莓等紫色蔬果中所含花青素的类型及结构的研究多采用紫外-可见光谱法、HPLC法、高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS)法等方法,其中HPLC法是检测花青素含量的最常用手段之一[16-20]。但关于黑果枸杞花青素类型及结构分析的研究并不多见,目前,国外学者及国内学者对黑枸杞花青素的结构类型仍未得出统一的结论[9,15]。谭亮[9]对黑枸杞花青素结构进行了分析,确定了8种花色苷成分,但发现其中并不含有矢车菊素,但是吕玉娇[15]对黑果枸杞花青素的研究中发现含有4种花色苷成分,且包含矢车菊素,同时由于检测结果有限因此未能进一步确定其他花青素。经过对比,谭亮和吕玉娇二人所得出的结构并不一致,因此对黑果枸杞花青素的研究还需进一步深入。
本试验采用HPLC以及HPLC-MS结合的方法对黑果枸杞花青素进行了定量以及定性分析,为鉴定黑枸杞花色苷的成分和含量提供了一种有效的检测方法,为黑枸杞花青素资源的开发与利用奠定了基础,提供了科学依据。
1 材料与方法
1.1 材料及仪器设备
黑果枸杞粉末:市售,鲜果冷冻干燥并粉碎;乙腈:色谱纯,山东禹王实业有限公司化工分公司;甲酸:色谱纯,天津市富宇精细化工有限公司;花青素标准品(氯化飞燕草素、氯化矢车菊素、氯化矮牵牛素、氯化天竺葵素、氯化芍药素、氯化锦葵素):ChromaDex公司。
RE-2000B旋转蒸发器:上海亚荣生化仪器厂;HH-8电热恒温水槽:上海比朗仪器有限公司;分UV-2600光光度计:上海精密仪器厂;H1650低温离心机:上海沪粤明科学仪器有限公司;ESJ110-4B电子天平:沈阳龙腾电子有限公司;SB-3200DTD超声波清洗机:宁波新芝生物科技股份有限公司;FD-IC-50冷冻干燥机:上海比朗仪器有限公司;Agilent1260高效液相色谱仪:安捷伦科技有限公司。
1.2 方法
1.2.1 高效液相色谱法黑果枸杞花青素样品预处理
将黑枸杞粉末用70%乙醇溶解,采用超声波提取法提取花青素,纯化后浓缩并冷冻干燥,即可得到黑枸杞花青素粉末[21-24]。称取样品花青素粉末10 mg,用体积比为乙醇 ∶水 ∶HCl溶液(3mol/L)=3∶2∶1的溶液溶解于10 mL容量瓶中,在沸水中水解后,立即冷却,用溶解液补充挥发的液体,定容至10 mL,过滤膜,用高效液相色谱法进行测定。
1.2.2 花青素标准曲线的建立
用体积比为乙醇 ∶水 ∶HCl溶液(3 mol/L)=3∶2∶1的溶液溶解花青素,并分别配制200 μg/mL的花青素标准品溶液,逐级稀释,建立以峰面积为纵坐标(y),以浓度为横坐标(x)的标准方程。
1.2.3 高效液相色谱进样条件
进样条件根据相关文献做出一定修改[26]。
色谱柱:Waters C18 柱,5 μm,4.6 mm×250 mm;检测波长:525 nm;流动相A:1%甲酸溶液;流动相B:1%甲酸乙腈溶液;流速:0.7 mL/min;恒温柱箱温度:30℃;进样量体积:20 μL。
梯度洗脱程序:0~10 min:93%~75%,A%;10 min~15 min,75%~63%,A%;15 min~23 min,63%~25%,A%;23 min~30 min,25%~93%,A%。
1.2.4 高效液相色谱测定条件的优化
1.2.4.1 样品水解时间
取预处理的样品液在沸水中分别水解34、47、60、73 min后,立即冷却,用溶解液补充挥发的液体,定容至10 mL,过滤膜,按1.2.3的方法进行测定[25]。
1.2.4.2 进样流速
取预处理的样品液,对进样流速分别为0.3、0.5、0.7、0.9 mL/min进行研究,并确定最佳流速。
1.2.4.3 水解液的酸度
改变溶解液乙醇 ∶水 ∶HCl溶液=3∶2∶1(体积比)中HCl的浓度,并分别配置为 1.4、3.0、4.6、6.2 mol/mL的盐酸溶液,分别溶解黑果枸杞花青素样品溶液,按1.2.3方法进行液相检测。
1.2.4.4 水解液的配比
将乙醇∶水∶HCl溶液(3 mol/L)按体积比分别配置为 3∶2∶1、5∶2∶1、2∶3∶1、2∶5∶1,按 1.2.3方法进行液相检测。
1.2.5 HPLC-MS条件
1.2.5.1 液相条件
色谱系统:Dionex Ultimate 3000 RSLC;色谱柱:Hypersil GOLD aQ,100 mm×2.1 mm,1.9 μm;流动相:A:0.9%乙酸水溶液;B:0.9%乙酸乙腈;进样量:3 μL;流速:0.3 μL/min。
洗脱梯度:0~15min,97%~85%,A%;15 min~25 min,85%~70%,A%;25 min~30 min,70%~65%,A%;30 min~35 min,65%~10%,A%;35 min~40 min,10%~97%,A%。
1.2.5.2 质谱条件
质谱系统:Thermo Q-Exactive。
质谱参数:喷雾电压:3.5 kV;护套气体流量:35;辅助气体流量:10;毛细管温度:300℃;加热温度:300℃;扫描模式:全扫描(分辨率70000);扫描范围:m/z 100~1500。
1.2.5.3 HPLC-MS样品前处理
精确称取黑果枸杞花青素样品1 mg,用pH值为2.0的水解液[乙醇 ∶水 ∶HCl溶液=3∶2∶1(体积比)]溶解至10 mL,过0.22 μm的水相滤膜,进行分析[27]。
2 试验结果与分析
2.1 HPLC优化条件的确定
通过对水解时间、进样流速、水解液中HCl浓度、水解液配比等因素的研究,经优化最终确定条件为用体积比为乙醇 ∶水 ∶HCl溶液(3 mol/L)=3∶2∶1的溶解液溶解黑果枸杞花青素粉末,水解1 h,流速为0.7 mL/min时,获得的峰型较好。
2.2 花青素标准曲线的建立
花青素标准方程见表1,在1 μg/mL~200 μg/mL浓度范围内,线性良好。
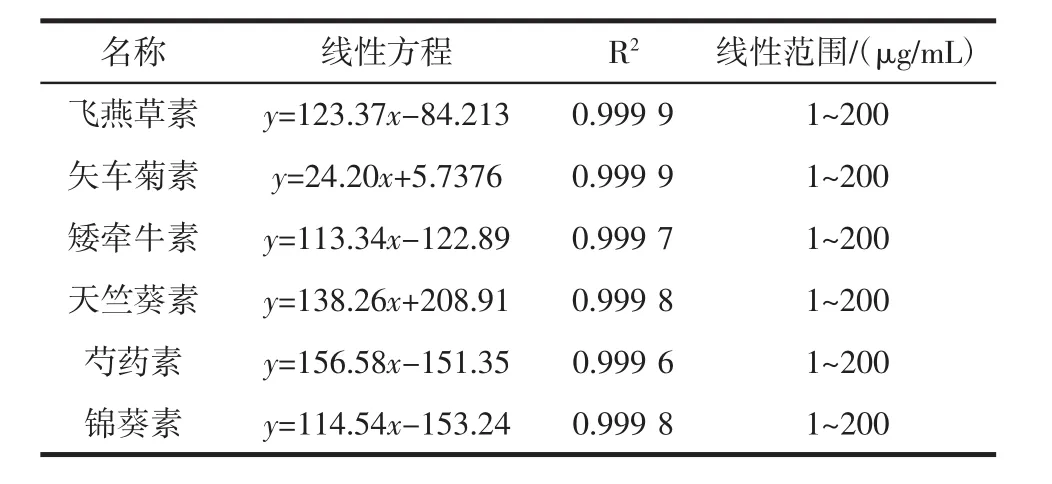
表1 6种主要花青素标准方程及线性范围Table 1 Standard equations and linear range of six main anthocyanins
2.3 黑果枸杞花青素的类型及含量
黑果枸杞花青素样品最佳条件色谱图见图1。通过计算确定黑果枸杞中含有飞燕草素2.32 μg/mL、矢车菊素15.44 μg/mL、矮牵牛素35.18 μg/mL、锦葵素2.63 μg/mL。
2.4 黑果枸杞花青素HPLC-MS检测结果
黑果枸杞中花色苷组分及推测结构见表2。
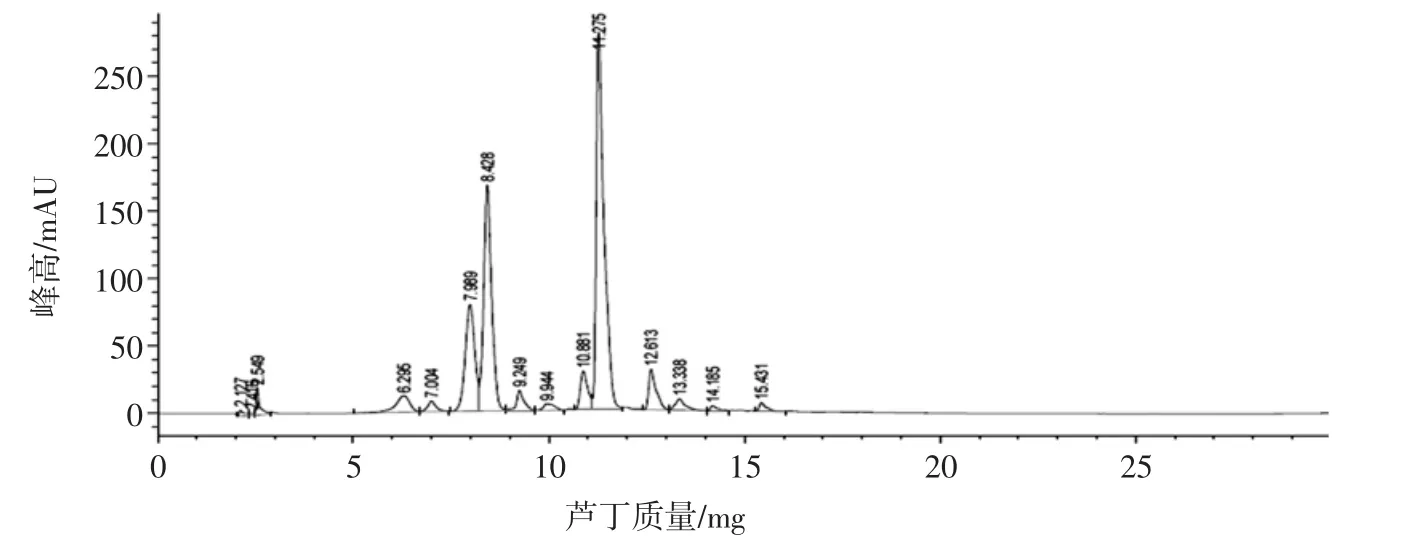
图1 黑果枸杞花青素样品最佳条件色谱图Fig.1 The liquid chromatographic diagram of anthocyanins sample of Lycium ruthenicum Murr.
通过HPLC-MS进行分析,其中分子离子质荷比为317是矮牵牛素,m/z 303是飞燕草素,m/z 287是矢车菊素,m/z 331是锦葵素,m/z 301是芍药素,由于糖基不稳定容易裂解,因此会形成离子碎片,所以只能根据丢失的碎片离子质量进行判断,一般半乳糖苷和葡萄糖苷失去一分子水的分子量为162,分子量为324则是槐糖失去一分子水,而对香豆酸失去一分子水的分子量为146,206是芥子酸失去一分子水的分子量,180是咖啡酸的分子量,由于花青素被葡萄糖糖基化的情况较多,因此对黑果枸杞花青素结构的推测如下:
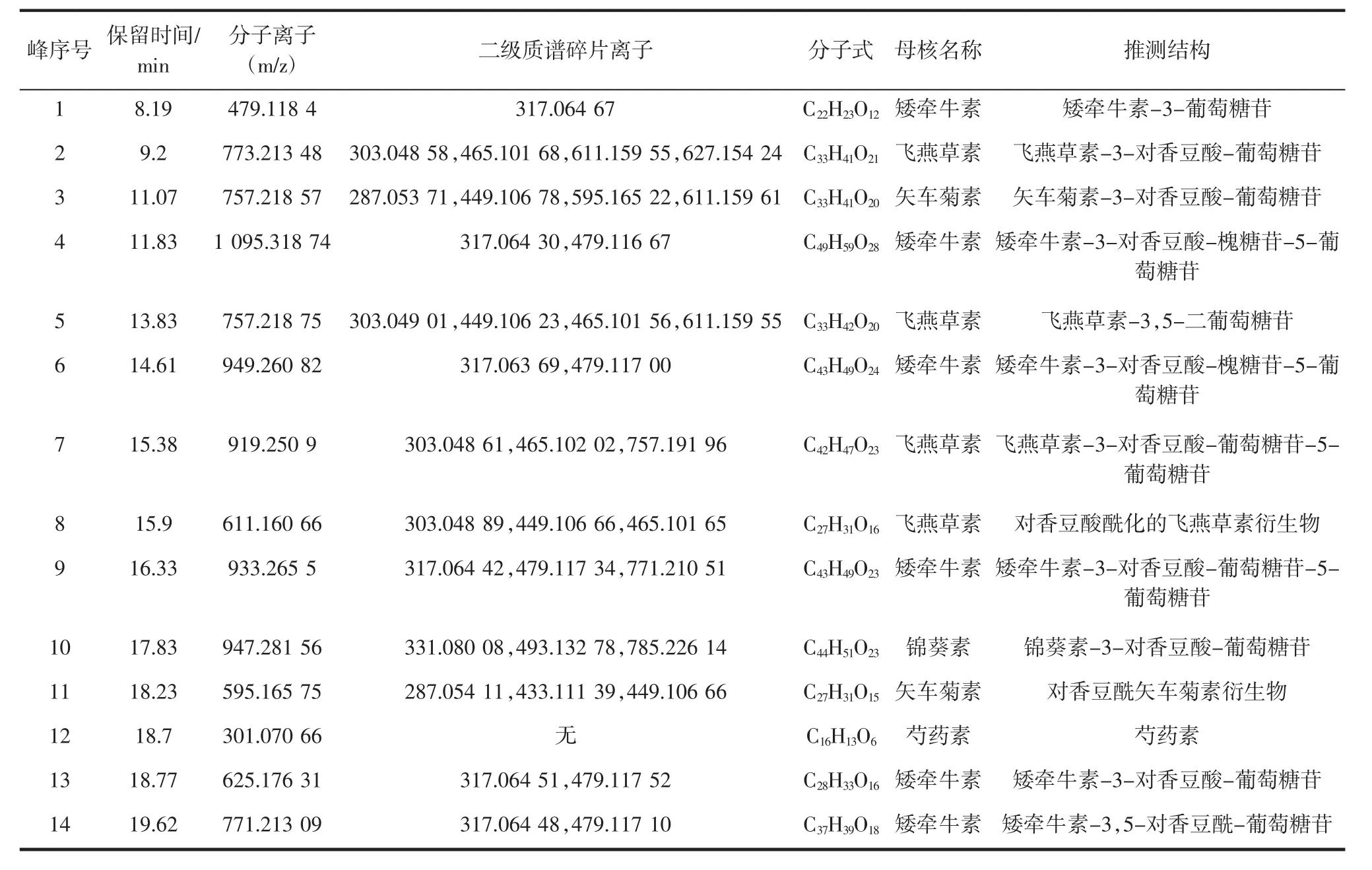
表2 黑果枸杞中花色苷组分及推测结构Table 2 The composition and speculated structure of anthocyanins in Lycium ruthenicum Murr.
峰1:分子离子峰m/z 479.12,碎片离子317.06[M-162]+,因此推测为矮牵牛素-3-葡萄糖苷或矮牵牛素-3-半乳糖苷,但从文献可知黑枸杞与葡萄糖苷连接情况较多,因此确定为矮牵牛素-3-葡萄糖苷。
峰2:分子离子峰m/z 773.21,碎片离子m/z 627[M-146]+,m/z 611[M-146-16]+,m/z 465[M-146-16-146]+,m/z 303[M-146-16-146-162]+,推测为是被对香豆酸酰化的含有半乳糖苷或葡萄糖苷的飞燕草素衍生物,结合文献初步判定为飞燕草素-3-对香豆酸-葡萄糖苷[9]。
峰3:分子离子峰m/z 757.22,碎片离子 611[M-146]+,m/z 595[M-146-16]+,16 为氧原子的分子量,m/z 449[M-146-16-146]+,m/z 287.05[M-146-16-146-162]+,因此推测是被对香豆酸酰化的含有半乳糖或葡萄糖的矢车菊素衍生物,结合文献初步判定为矢车菊素-3-对香豆酸-葡萄糖苷[9]。
峰4:分子离子峰m/z 1095.32,碎片离子479[M-324-146-146]+,m/z 317[M-324-146-146-162]+,推测是被对香豆酸酰化的含有槐糖苷和半乳糖或葡萄糖的矮牵牛素衍生物,结合文献可能是矮牵牛素-3-对香豆酸-槐糖苷-5-葡萄糖苷[6]。
峰5:分子离子峰m/z 757.22,m/z 611[M-162-16]+,16 为氧原子分子量,m/z 465[M-162-16-16]+,m/z 449[M-162-16-16-16]+,m/z 303[M-162-16-16-16-162+16]+,因此可推测为是含葡萄糖或半乳糖的飞燕草素衍生物,结合文献初步判断是飞燕草素-3,5-二葡萄糖苷。
峰6:分子离子峰m/z 949.26,碎片离子峰479[M-324-146]+,m/z 317[M-324-146-162]+,峰4与峰6共享某些碎片离子,但从分子量上来看峰4含有两个对香豆酸酰基,峰6是被对香豆酸酰化的含有槐糖苷和半乳糖或葡萄糖的矮牵牛素衍生物,结合相关文献初步判定为矮牵牛素-3-对香豆酸-槐糖苷-5-葡萄糖苷[6,9]。
峰7:分子离子峰m/z 919.25,碎片离子峰757[M-162],m/z 465[M-162-292],292 是两分子的对香豆酸脱去两分子水而成的分子量,m/z 303[M-162-292-162]+,推测是被对香豆酸酰化的含有半乳糖苷或葡萄糖苷的飞燕草素衍生物,结合文献判断为飞燕草素-3-对香豆酸-葡萄糖苷-5-葡萄糖苷[9,15]。
峰8:分子离子峰m/z 611.16,碎片离子峰465[M-146]+,其中146是对香豆酸脱去一份子水的分子量,m/z 449[M-146-16]+,16 为氧原子分子量,m/z 303[M-146-16-146]+,推测为被对香豆酸酰化的飞燕草素衍生物。
峰9:分子离子峰m/z 933.27,碎片离子峰771[M-162]+,m/z 479[M-162-146-146]+,m/z 317[M-162-146-146-162]+,推测为被对香豆酸酰化的含有半乳糖苷或葡萄糖苷的矮牵牛素衍生物,结合文献判断为矮牵牛素-3-对香豆酸-葡萄糖苷-5-葡萄糖苷[15]。
峰10:分子离子峰m/z 947.28,碎片离子峰785[M-162]+,m/z 433[M-162-16]+,m/z 287[M-162-16-146]+,推测为被对香豆酸酰化的含有半乳糖苷或葡萄糖苷的锦葵素衍生物,结合文献判断为锦葵素-3-对香豆酸-葡萄糖苷[9]。
峰11:分子离子峰m/z 595.17,碎片离子峰449[M-146]+,m/z 433[M-146-16]+,m/z 287[M-146-16-146]+,推测为被对香豆酸酰化的矢车菊素衍生物。
峰12:分子离子峰m/z 301.07,无其他碎片离子峰,属于芍药素。
峰13:分子离子峰m/z 625.18,碎片离子峰479[M-146]+,m/z 317[M-146-162]+,推测为被对香豆酸酰化的含有葡萄糖或半乳糖的矮牵牛素衍生物,结合文献判断为矮牵牛素-3-对香豆酸-葡萄糖苷[28-29]。
峰14:分子离子峰m/z 771.21,碎片离子峰479[M-146-146]+,m/z 317[M-146-146-162]+,峰14与峰13共享碎片离子,但峰14比峰13多一个对香豆酰基,推测为被对香豆酸酰化的含有葡萄糖或半乳糖的矮牵牛素衍生物,结合文献判断为矮牵牛素-3,5-对香豆酰-葡萄糖苷。
3 结论
通过试验确定了高效液相色谱法的最佳检测条件,确定了黑果枸杞花青素的含量;并检测出了14种花色苷成分,由于黑果枸杞生长地域不同所含花青素的种类以及含有的糖苷键也是不同的,因此要确定黑果枸杞中所含的花青素结构还需进一步研究。
[1] 葛翠莲,黄春辉,徐小彪.果实花青素生物合成研究进展[J].园艺学报,2012,39(9):1655-1664
[2] 李韬,张宏宇,吕玉璋.花色苷类色素的研究进展[J].农业科技与装备,2010(5):23-26
[3]Fleschhut J,Kratzer F,Rechkemmer G,et al.Stability and biotransformation of various dietary anthocyanins in vitro[J].Eur J Nutr,2006,45:7-18
[4]高爱红,童华荣.天然食用色素——花青素研究进展[J].保鲜与加工,2001,17(3):25-27
[5] 韩海华,梁名志,王丽,等.花青素的研究进展及其应用[J].茶叶,2011,37(4):217-220
[6]王海.紫甘蓝花青素的提取纯化、结构鉴定及其生物学作用的研究[D].泰安:山东农业大学,2012
[7] 王荣姣.半高丛越橘“北陆”花青素提取纯化、组分分析及抗氧化活性的研究[D].衡阳:南华大学,2011
[8]张宏宝.茶树红紫色芽叶中花青素组分的分离及鉴定[D].泰安:山东农业大学,2009
[9] 谭亮,董琦,曹静亚,等.黑果枸杞中花色苷的提取与结构鉴定[J].天然产物研究与开发,2014,26(11):1797-1802,1760
[10]陈海魁,蒲凌奎,曹君迈,等.黑果枸杞的研究现状及其开发利用[J].黑龙江农业科学,2008(5):155-157
[11]林丽,张裴斯,晋玲,等.黑果枸杞的研究进展 [J].中国药房,2013,24(47):4493-4497
[12]何如喜.超声波辅助提取野生黑果枸杞花青素工艺研究[J].青海师范大学学报(自然科学版),2015(1):49-55
[3]魏蕾,吕佳飞,李志洲.花青素的提取、分离与纯化方法的研究进展[J].化工科技市场,2010,33(2):14-17,27
[14]娄崇,刘永峰,白清清,等.大孔吸附树脂的吸附原理[J].化学进展,2012(8):1427-1436
[15]吕玉姣,尹雨芳,林强.黑果枸杞花青素提取分离纯化和组分分析[J].化学世界,2016(10):659-667
[16]林丽,李进,丁成丽.高效液相色谱法测定黑果枸杞果实中花色苷的含量[J].食品科学,2013,34(6):164-166
[17]Panagiotis A,Per J R Sjöberg,Charlotta T.Characterisation of anthocyanins in red cabbage using high resolution liquid chromatography coupled with photodiode array detection and electrospray ionization-linear ion trap mass spectrometry[J].Food Chemistry,2008(109):219-226
[18]张淑江,马越,徐学玲,等.芸薹属5种紫红色蔬菜花青素苷含量及组分分析[J].园艺学报,2014,41(7):1451-1460
[19]王婧,周有祥,严伟,等.黑米中矢车菊素-3-葡萄糖苷的鉴定与含量分析[J].湖北农业科学,2014,53(23):5836-5838,5842
[20]吕海鹏,费旭元,梁名志,等.茶树特异品种“紫娟”中的花青素组分分析[J].食品科学,2012,33(22):203-206
[21]陈健,孙爱东,高雪娟,等.蓝莓花青素的提取及抗氧化性的研究[J].北京林业大学学报,2011,33(2):126-129
[22]孔美兰,刘谋泉,陈德宾.超声波辅助提取三华李花青素及其抗氧化活性研究[J].广东农业科学,2014(21):92-96
[23]刘超.紫甘薯花青素的提取及其稳定性和抗氧化性的研究[D].长沙:湖南农业大学,2008
[24]王少波,杜永峰,姚秉华.pH示差法测定黑豆皮中的花青素[J].化学分析计量,2008,17(1):46-47,49
[25]胡莉,仲伶俐,毛建霏,等.高效液相色谱测定粮食、蔬菜和水果中的花青素[J].分析实验室,2012,31(12):43-47
[26]刘红,徐科.采取高效液相色谱法测定植物样品中花青素的研究[J].安徽农业科学,2013,41(14):6123-6124
[27]殷丽琴,彭云强,钟成,等.高效液相色谱法测定8个彩色马铃薯品种中花青素种类和含量[J].食品科学,2015,36(18):143-147
[28]Chen Chen,Shao Yun,Tao Yanduo,et al.Main anthocyanins compositions and corresponding H-ORAC assay for wild Lycium ruthenicum Murr.fruits from the Qaidam Basin[J].Journal of Pharmaceutical Technology and Drug Research,2013,2:1-5
[29]Jie Zheng,Chenxu Ding,Liangsheng Wang,et al.Anthocyanins composition and antioxidant activity of wild Lycium ruthenicum Murr.from Qinghai-Tibet Plateau[J].Food Chemistry,2011,126:859-865
——矮牵牛

