BST-2参与HCMV感染诱导的恶性胶质瘤细胞增殖和迁移
王淋淋, 李莹莹, 王 语, 张 丽, 胡 明, 王 斌, 李 玲*
(1.青岛大学医学部 人体解剖与组织胚胎学系,山东 青岛 266071;2.青岛大学医学部 免疫学系,山东 青岛 266071;3. 青岛大学医学部 特种医学系,山东 青岛 266071)
人巨细胞病毒(human cytomegalovirus,HCMV)是疱疹病毒β亚科的双链DNA病毒,在我国人群感染率为70%~90%。免疫功能健全的人感染HCMV后常无症状,但病毒可终生潜伏存在。这种病毒和宿主细胞的长期并存可能对肿瘤的分化、迁移、侵袭等生物学行为产生一系列影响。HCMV不是公认的致瘤病毒,但研究显示在多种肿瘤组织中可以检测到HCMV蛋白产物及基因组,如胶质瘤[1-3]、乳腺癌、结肠癌和前列腺癌等。胶质瘤是最常见的原发性颅内肿瘤,大多呈侵润性增长,侵袭性强,恶性程度高,手术治疗复发率高,预后较差,具有较高的致死率。近年来的研究提示HCMV感染与胶质瘤的恶性程度密切相关[1-3],本课题组的前期研究也表明,HCMV感染能够增强胶质瘤细胞的肿瘤干性[4],提示HCMV感染在胶质瘤的发生、发展甚至恶化的过程中发挥了一定的作用,但HCMV参与肿瘤发生以及调控细胞增殖和迁移的机制尚未阐明。骨髓基质细胞抗原2(Bone Marrow Stromal cell antigen 2,BST-2,又命名为Tetherin /CD317 /HN1.24)是分子量大小为30~60 kD的II型跨膜蛋白,由181个氨基酸组成。结构分为N端胞质区(CT)、跨膜区(TM)、胞外区(EC)和C端糖基磷脂酰肌醇(GPI)锚,其中TM区和GPI区均为膜锚定结构[5]。BST-2被认为是一种天然的抗病毒免疫蛋白,对很多种类病毒释放具有明显的抑制作用[6-8],但是BST-2并不能够抑制HCMV的释放,有研究证实BST-2能够促进HCMV进入宿主细胞,下调BST-2表达可有效降低HCMV复制[9]。近年来研究表明,BST-2表达还与肿瘤的恶性程度密切相关。BST-2高表达的胃肠道肿瘤患者预后较差[10],体外细胞实验和体内小鼠荷瘤实验均证实高表达BST-2可以促进乳腺癌细胞增殖、迁移和浸润,抑制BST-2可使肿瘤的迁移和侵袭能力降低[11]。但目前BST-2促进肿瘤发生的机制尚未阐明。我们在前期的研究中证实,HCMV感染可诱导人原代星形胶质细胞和胶质瘤细胞U251上调表达BST-2,其表达与对照组相比可上调达250倍。推测BST-2可能是HCMV感染胶质瘤后影响胶质瘤恶性进展的一个关键靶点,BST-2与HCMV感染以及胶质瘤的关系值得进一步深入探讨和研究。
1 材料与方法
1.1 材料
1.1.1 病毒、细胞 HCMVAD169株由法国巴斯德研究所赠送。通过人胚肺成纤维细胞扩增,待细胞病变达80%以上时刮取细胞和上清,反复冻融3次后,空斑定量病毒滴度,保存于-86 ℃。本研究所用感染复数(multiplicity of infection,MOI)值为1和0.1。神经胶质瘤细胞U251购自上海中科院细胞库。
1.1.2 主要试剂 MEM(Hyclone);胎牛血清(FBS,Gibco);鼠抗HCMV IE单克隆抗体、兔抗人BST-2单克隆抗体购自Abcam;兔抗β-actin、羊抗兔IgG购自北京博奥森;羊抗鼠IgG购自SANTA CRUZ;CCK-8细胞增殖检测试剂盒和LipoFiter转染试剂购自汉恒生物;BST-2 shRNA表达载体由上海吉玛设计和合成;24孔板用transwell小室(8.0 μm PET)购自MillIPORE;蛋白裂解液RIPA、PMSF(Solarbio);化学发光试剂盒(MIllipore);凝胶成像分析系统(富士);酶标仪(SUNRISE)。
1.2 方法
1.2.1 HCMV感染 对数生长期的U251细胞接种六孔板(5×105/孔),10% FBS的MEM,37 ℃、5% CO2孵箱内常规培养,待细胞达到80%汇合时,换为无血清MEM培养同时加入相应MOI值的HCMV,继续培养4 h后更换10% FBS培养基进行后续试验,其他未感染细胞除不加入HCMV外,操作相同。
1.2.2 RNA干扰 由上海吉玛设计和合成靶基因为人BST-2的4个短发夹RNA(short hairpin RNA,shRNA)质粒和1个阴性对照质粒,靶序列结构如下:shBST2-128, 5′-GGGATAAGCGCTGTAAGCTTC-3′; shBST2-171,5′-GCTCCTGATCATCG-TGATTCT-3′;shBST2-256,5′-GCAGTGATGGAGTGTCGCAAT-3′;shBST2-432,5′-GGGAGAGATCACTACATTAAA-3′。HCMV感染后4 h,将8 μL LipoFiter转染试剂和4 μg shRNA干扰质粒各加入250 μL MEM培养基后轻轻混合孵育20 min,加入6孔板内细胞,6 h后除去转染试剂更换新鲜培养基,48 h后提取蛋白,通过Western blot方法筛选有效沉默靶点后进行后续实验,具体操作步骤相同。
1.2.3 细胞划痕愈合实验 经HCMV感染和RNA干扰BST-2后24 h的U251细胞接种于6孔板(1×106/孔),灭菌牙签划线,2% FBS MEM培养,分别在0、24、48 h拍照。数据采用Photoshop软件测量划痕相对宽度,多次测量用Graphpad Prism5作柱状图,多组间均数的比较采用单因素方差分析,两两组间采用独立样本t检验。P≤0.05表示差别有显著性意义。
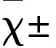
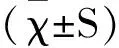
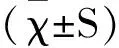
2 结果与分析
2.1 HCMV感染促进U251细胞迁移
划痕愈合实验结果显示,对照组、HCMV MOI=0.1组与HCMV MOI=1组在0 h时,划痕距离大致相同。24 h后可见感染HCMV细胞划痕距离缩短,与对照组相比,具有明显的细胞迁移增强特征(P<0.01),其中高MOI值(MOI=1)组相比低MOI值(MOI=0.1)组细胞迁移能力更强。48 h实验结果与24 h类似(图1)。
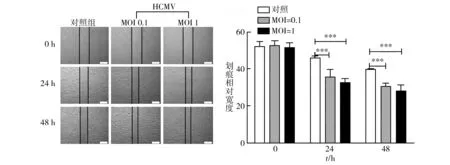
图1 U251细胞感染不同浓度HCMV后随时间变化的细胞迁移情况Fig.1 U251 cells infected with different concentrations of HCMV changes with time of cell migration***:相对于对照组,P<0.01***:compared with control group,P<0.01
2.2 HCMV感染促进U251细胞高表达BST-2
不同MOI值HCMV感染U251细胞后Western-blot结果显示,未感染HCMV的U251细胞(MOCK)不表达HCMV的标志蛋白IE,低表达BST-2。随感染时间延长,出现IE表达,证实建立病毒感染。BST-2蛋白表达量在HCMV感染后24~72 h内呈时间依赖关系,但不同MOI值HCMV感染后的同一时段内,BST-2表达差异没有显著性(图2)。
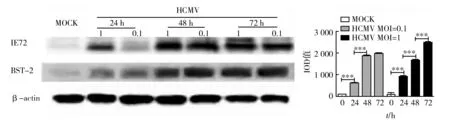
图2 U251细胞感染HCMV后BST-2蛋白表达Fig.2 BST-2 protein expression of U251 cells infected HCMV***:相对于shNC组,P<0.01,下图同***:compared with shNC group,P<0.01,same the follow
2.3 BST-2 shRNA靶序列筛选结果
HCMV(MOI=1)感染U251细胞后4 h,分别转染靶基因为BST-2的4种shRNA质粒(siBST-2-128、siBST-2-256、siBST-2-171、siBST-2-432)和阴性对照shRNA质粒(shNC),48 h后Western-blot结果显示siBST-2-171与siBST-2-256两种靶序列对BST-2的沉默具有显著效果(P<0.01)(图3)。随后即选择这两种质粒进行后续实验。

图3 BST-2 shRNA靶序列筛选Fig.3 ShRNA targets sequence screening
2.4 HCMV感染后下调BST-2表达抑制HCMV感染诱导的细胞增殖
将U251细胞感染或模拟感染HCMV(MOI=1)后,分别转染siBST-2-171、siBST-2-256、shNC或不做处理,48 h后Western-blot检测BST-2、HCMV IE和内参β-actin。结果显示,未感染HCMV的细胞不表达IE蛋白,感染HCMV的细胞表达IE,证实已经在U251内建立HCMV感染(图4A)。未感染HCMV的U251低表达BST-2,与转染shNC质粒组相比,差别没有统计学意义,转染siBST-2-171、siBST-2-256与shNC相比,BST-2蛋白表达量明显下降(图4A、4B)。HCMV感染明显上调BST-2表达,转染siBST-2-171、siBST-2-256后,BST-2表达下降明显(图4A、4B)。CCK-8细胞增殖实验结果表明,未感染的U251细胞下调BST-2表达后增殖活性下降,但相对于对照组和shNC组,差别没有统计学意义;HCMV感染U251细胞后增殖活性明显增加,下调BST-2后可使细胞增殖活力明显下降(P<0.01),差异具有统计学意义(图4C)。

图4 HCMV感染后下调BST-2对U251细胞增殖的影响Fig.4 The influence on cell proliferation after down-regulation of BST-2 in HCMV infected U251 cellsA:BST-2蛋白表达情况;B:BST-2蛋白表达量统计学分析;C:下调BST-2对U251细胞增殖的影响;**:相对于shNC组,P<0.05下图同A:The expression of BST-2 protein; B:Statistical analysis of the expression of BST-2 protein; C:Effect of down-regulation of BST-2 on cell proliferation;**:compared with shNC group,P<0.05
2.5 HCMV感染后下调BST-2表达对胶质瘤细胞迁移的影响
为检测BST-2是HCMV感染促进胶质瘤细胞迁移的关键蛋白,分别用细胞划痕和tanswell方法进行了验证。将U251细胞不感染或感染HCMV(MOI=1)后,分别转染siBST-2-171、siBST-2-256、shNC或不做处理,细胞划痕24 h后倒置显微镜观察,结果显示,相对于对照组,HCMV感染U251细胞后划痕距离明显缩短,说明HCMV感染可以促进U251细胞迁移,而下调BST-2的siBST-2-171组和siBST-2-256组细胞划痕距离明显宽于HCMV组和HCMV感染后转染shNC组(P<0.05),而与对照组相比差别没有统计学意义,说明下调BST-2表达可以抑制由HCMV感染诱导的细胞迁移(图5)。Tanswell迁移试验得出了相似的结果(图6),相对于未感染组,HCMV感染组细胞,穿膜数目增多,下调BST-2后,细胞穿膜迁移能力显著下降(P<0.01)。
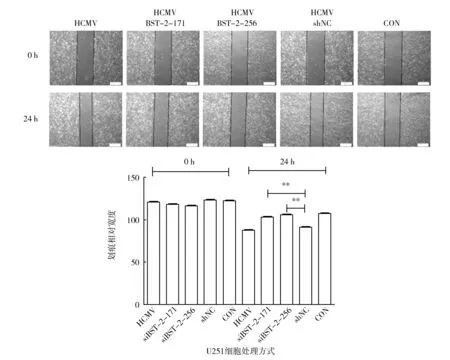
图5 HCMV感染后下调BST-2对U251细胞划痕愈合的影响Fig.5 The influence on cell scratch wound healing after down regulation BST-2 in HCMV infected U251 cells

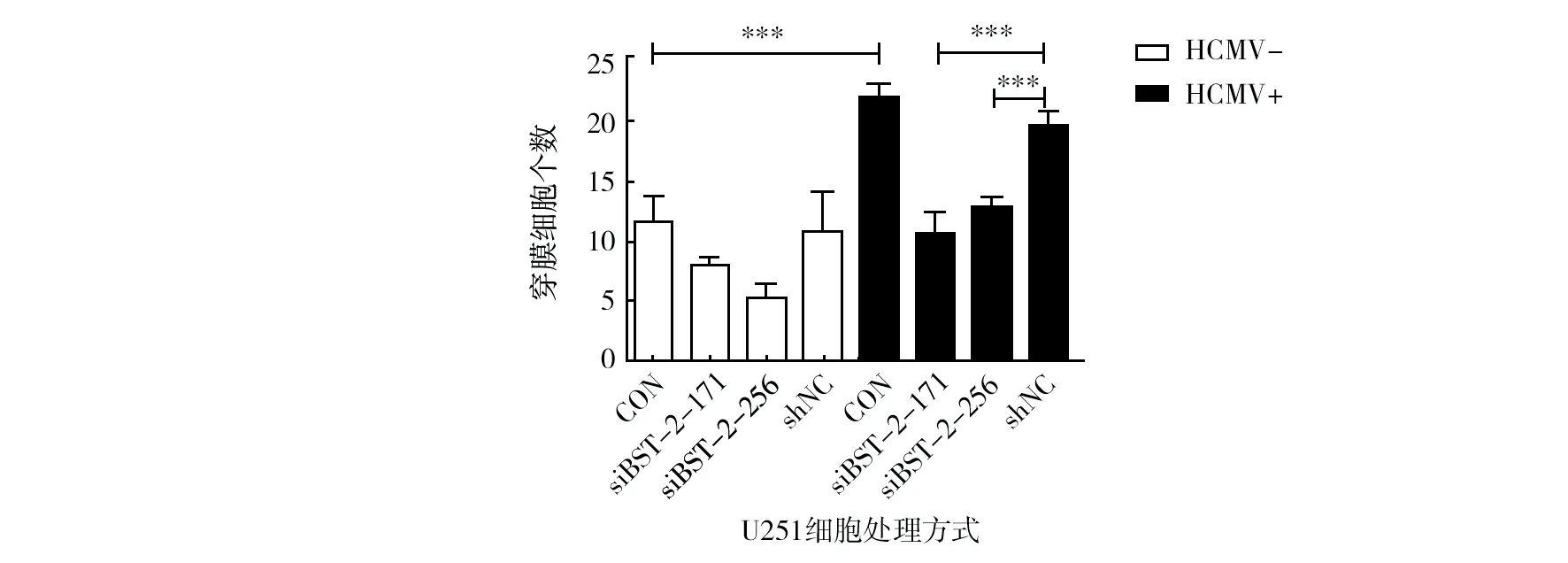
图6 下调BST-2后的U251细胞Transwell迁移情况Fig.6 The influence on cell migration after down regulation BST-2 in HCMV infected U251 cells
3 讨 论
HCMV感染与恶性胶质瘤细胞关系密切,其在胶质瘤发生中的作用机制成为近年研究的热点。2002年,Cobbs等[1]率先报道在Ⅱ~Ⅳ级脑胶质瘤组织中可以检测到HCMV基因和蛋白。随后陆续有研究显示90%以上胶质母细胞瘤(胶质瘤IV级)组织中可检测到HCMV基因组和蛋白质,80%的患者血清学样本中检出HCMV标志物[2],HCMV感染与胶质瘤的恶性程度密切相关[3]。但HCMV感染参与胶质瘤发生的机制至今尚不明确。本研究结果进一步证实HCMV可以在U251细胞内建立感染,并能够促进胶质瘤细胞增殖和迁移,表明其在胶质瘤的发展过程中起到重要作用。
尽管BST-2被认为是拮抗包膜病毒释放宿主细胞限制因子,但是最新研究表明在多种肿瘤内均高表达BST-2,如头颈部肿瘤[12]、肺癌[13]、乳腺癌[11,14]、宫颈癌[15]、骨髓瘤、子宫内膜癌[16]等,提示BST-2有致癌作用。本研究证实HCMV感染可促进BST-2表达,并在一定时间内呈时间依赖关系,鉴于BST-2与肿瘤发生关系密切,推测BST-2可能在HCMV促进胶质瘤恶性发展中具有重要作用,也许是肿瘤发生发展的一个促进因素。我们随后筛选了干扰靶点,有效阻断了HCMV感染引起的BST-2水平上调。通过CCK-8细胞增殖实验、细胞划痕愈合和transwell方法检测HCMV感染后下调BST-2对U251细胞增殖和迁移能力的影响,证实了HCMV感染胶质瘤U251细胞后可促使U251细胞恶性增殖和迁移,而对BST-2进行干扰抑制后可有效抑制其增殖和迁移能力。本研究结果在一定程度上诠释了HCMV感染促进胶质瘤发生发展的一个可能的机制,BST-2也许会成为胶质瘤癌症治疗的新靶点。
BST-2改变胶质瘤生物学行为的机制尚未明确。BST-2抗病毒机制是其通过GPI区与病毒包膜结合,通过TM区固定在细胞膜上,并促进病毒子通过细胞内吞作用进入细胞内的早胞内体继而被溶酶体酶降解,最终达到抑制病毒释放的作用[17]。BST-2可能是通过类似的机制,促进细胞粘附和浸润细胞外基质,也可能是通过激活NF-kB介导的信号通路[18],促进胶质瘤细胞分泌趋化因子、基质金属蛋白酶和细胞因子等从而促进肿瘤细胞的增殖迁移和浸润,有待进一步的研究去证实。
参考文献:
[1] Cobbs CS, Harkins L, Samanta M,et al.Human cytomegalovirus infection and expression in human malignant glioma[J]. Cancer Res,2002, 62(12):3347-3350.
[2] Mitchell DA, Xie W, Schmittling R,et al.Sensitive detection of human cytomegalovirus in tumors and peripheral blood of patients diagnosed with glioblastoma[J]. Neuro Oncol,2008, 10(1):10-18.
[3] Scheurer ME, Bondy ML, Aldape KD,et al.Detection of human cytomegalovirus in different histological types of gliomas[J]. Acta Neuropathol,2008, 116(1):79-86.
[4] Wang X, Hu M, Xing F,et al.Human cytomegalovirus infection promotes the stemness of U251 glioma cells[J]. J Med Virol,2016, 89:878-886.
[5] Kupzig S, Korolchuk V, Rollason R,et al.Bst-2/HM1.24 is a raft-associated apical membrane protein with an unusual topology[J]. Traffic,2003, 4(10):694-709.
[6] Van Damme N, Goff D, Katsura C,et al.The interferon-induced protein BST-2 restricts HIV-1 release and is downregulated from the cell surface by the viral Vpu protein[J]. Cell Host Microbe,2008, 3(4):245-252.
[7] Sarojini S, Theofanis T, Reiss CS.Interferon-induced tetherin restricts vesicular stomatitis virus release in neurons[J]. DNA Cell Biol,2011, 30(12):965-974.
[8] Lv M,Zhang B,Shi Y,et al.Identification of BST-2/tetherin-induced hepatitis B virus restriction and hepatocyte-specific BST-2 inactivation[J]. Sci Rep,2015, 5(714):11736.
[9] Viswanathan K, Smith MS, Malouli D, et al.BST2/Tetherin enhances entry of human cytomegalovirus[J]. PLoS Pathog,2011, 7(11):e1002332.
[10] Mukai S, Oue N, Oshima T,et al.Overexpression of Transmembrane Protein BST2 is Associated with Poor Survival of Patients with Esophageal, Gastric, or Colorectal Cancer[J]. Ann Surg Oncol,2017, 24(2):594-602.
[11] Mahauad-Fernandez WD, DeMali KA, Olivier AK,et al.Bone marrow stromal antigen 2 expressed in cancer cells promotes mammary tumor growth and metastasis[J]. Breast Cancer Res,2014, 16(6):493.
[12] Fang KH, Kao HK, Chi LM,et al. Overexpression of BST2 is associated with nodal metastasis and poorer prognosis in oral cavity cancer[J]. Laryngoscope,2014, 124(9):E354-360.
[13] Wang W, Nishioka Y, Ozaki S,et al. HM1.24 (CD317) is a novel target against lung cancer for immunotherapy using anti-HM1.24 antibody[J]. Cancer Immunol Immunother,2009, 58(6):967-976.
[14] Mahauad-Fernandez WD, Borcherding NC, Zhang W,et al.Bone marrow stromal antigen 2 (BST-2) DNA is demethylated in breast tumors and breast cancer cells[J]. PLoS One,2015, 10(4):e0123931.
[15] Milutin Gasperov N, Farkas SA, Nilsson TK,et al.Epigenetic activation of immune genes in cervical cancer[J]. Immunol Lett,2014, 162(2PtB):256-257.
[16] Yokoyama T, Enomoto T, Serada S,et al.Plasma membrane proteomics identifies bone marrow stromal antigen 2 as a potential therapeutic target in endometrial cancer[J]. Int J Cancer,2013, 132(2):472-484.
[17] Mahauad-Fernandez WD.The role of BST-2/Tetherin in host protection and disease manifestation[J]. Immun Inflamm Dis,2016, 4(1):4-23.
[18] Matsuda A, Suzuki Y, Honda G,et al.Large-scale identification and characterization of human genes that activate NF-kappaB and MAPK signaling pathways[J]. Oncogene,2003, 22(21):3307-3318.

