重金属污染农田微生物修复机理研究进展
常海伟, 刘代欢, 贺前锋
(湖南永清环保研究院有限责任公司,湖南 长沙 410330)
随着工业化进程的不断加快,矿产资源的不合理开采及其冶炼排放、长期对土壤进行污水灌溉和污泥施用、人为活动引起的大气沉降、化肥和农药的施用等原因,造成了土壤重金属污染严重。2014年4月17日,环境保护部和国土资源部联合发布了调查结果——《全国土壤污染状况调查公报》。结果显示,全国土壤环境状况总体不容乐观,耕地土壤环境质量堪忧,工矿业、农业等人为活动以及土壤环境背景值高是造成土壤污染或超标的主要原因。西南、中南地区土壤重金属超标范围较大;镉、汞、砷、铅4种无机污染物含量分布呈现从西北到东南、从东北到西南方向逐渐升高的态势。其中耕地的土壤点位超标率为19.4%,轻微、轻度、中度和重度污染点位比例分别为13.7%、2.8%、1.8%和1.1%,主要重金属污染物为镉、镍、铜、砷、汞、铅。这些重金属元素进入环境后无法进一步降解,会影响植物的呼吸、光合作用及其他有益元素的吸收,对植物的生长造成危害,还会被其他生物体吸收富集进入食物链,进而危及人类健康。当重金属元素在人体富集到一定程度时便会引起多种健康问题,轻微的重金属中毒会引起恶心、头痛,影响胎儿的智力发育等。而重度重金属中毒会对人体器官(如肝脏、肾脏等)造成严重的破坏,还可导致骨痛病、先天畸形,甚至引起死亡。当土壤受到外源重金属污染时,微生物的活性和生物量会受到一定程度的影响。为了维持自身的生存要求,土壤微生物的各种代谢活动会发生不同程度的改变。有研究表明,污染土壤的微生物代谢熵是未受重金属污染土壤的2倍左右,重金属的浓度高低影响了微生物的代谢活动,进而影响了土壤的呼吸作用[1-2]。也有大量研究表明,重金属的污染会对土壤微生物的生物量产生很大影响[3-5]。Kandeler等[5]研究了Pb污染矿区土壤中微生物生物量,结果表明靠近矿区土壤中微生物生物量显著低于远离矿区土壤的微生物生物量。某些重金属在浓度很低时也表现出高毒性,如Cd、Hg等。Cd离子能与含氨基、羧基,特别是巯基的蛋白质分子相互结合,而使得微生物体内很多功能酶的活性受到抑制甚至破坏,对细胞产生突变效应,导致DNA碱基改变。Hg离子同样也能导致细胞代谢紊乱、突变,抑制蛋白
质和核酸等大分子的合成,破坏蛋白的功能和结构,使细胞分裂中断。Pb可与细胞内各种氨基酸、蛋白质、功能酶的功能基团相互结合,造成细胞膜的损伤,影响营养物质的运输,干扰机体细胞的生理生化功能。鉴于重金属对环境及人类造成的潜在威胁,近些年对重金属污染土壤的修复已经成为人们广泛关注的热点问题。
1 重金属污染农田修复的方法
重金属污染土壤修复一般是通过物理、化学以及生物方法对重金属进行降解、吸收、转化和转移,使重金属浓度与毒性风险降低到可接受范围,最终达到相应土地类型的利用要求。土壤重金属污染修复方法在治理途径方面通常分为两种:一种是改变土壤中重金属的赋存形态,将其固定在土壤中,降低重金属的迁移性与生物可利用性;另一种则是根源性地去除土壤中重金属,保证重金属的存留浓度不超过土壤背景标准。基于这两种途径,人们提出多种重金属修复方法,如物理修复包括客土法、电动修复法、热处理法[6-8],化学修复包括固化/稳定化法、淋洗法等[9-10],常见的钝化材料如表1所示。

表1 主要钝化剂材料及钝化机理[4]Table 1 The major passivator materials and the passivation mechanisms[4]
物理化学修复技术在一定程度上能提高土壤pH,降低土壤中有效态镉含量,但是这些措施都存在局限性:传统的物理化学修复技术去除土壤中重金属污染物的成本相对较高,对于一些复合污染的土壤处理效果并不明显,容易引起土壤生态环境的破坏,导致土壤生物活性降低,土壤养分不平衡而使作物减产。生物修复是一项新型、高效的修复技术,可以克服物理化学技术的诸多弊端,从而得到广大专家学者的关注。利用微生物修复土壤重金属污染,不仅低能、经济、环保,而且能改善土壤环境,提高土壤生物活性,促进农作物生长,达到增产增收效果。因此,微生物修复技术在土壤修复领域具有广阔的应用前景。
2 重金属污染土壤微生物修复研究进展
微生物作为土壤中活跃的有机胶体,具有优越的物理化学特性,如:比表面积大,具有很强的吸附、络合能力,表面基团丰富等,因此土壤微生物对土壤污染的修复有较为深刻的影响。微生物与重金属的作用机理因其种属及形态的差异表现出不同的修复机制。总体来说,微生物的作用机理可以分为吸附、转化、溶解三种[11-12],如图1所示。

图1 微生物与重金属离子之间的作用机制Fig.1 Mechanism of interaction between micro-organism and heavy metal ions
2.1 生物吸附、富集
微生物对重金属的吸附、富集表现为对环境中重金属的吸附和富集作用,机理主要为胞外沉淀作用、胞外络合作用、细胞表面吸附、胞内积累[13]。然而微生物吸附和富集存在明显的区别,微生物表面复杂的结构对重金属离子的吸附起着至关重要的作用,其细胞壁及表面黏液层可以直接吸附重金属,是一种被动代谢过程[14]。大多数微生物表面带有阴离子基团(羧基、羟基、羰基、氨基、巯基、磺酸基、磷酸酯基等)而表现出电负性(表2),更有利于重金属的吸附。已有研究对微生物的吸附能力做了一些探索,如表3所示,像细菌(枯草芽胞杆菌)、真菌(根霉菌)、酵母菌(酿酒酵母)、藻类(海藻)等[15-18]。Kuroda等[19]采用细胞表面展示技术,将酵母菌金属硫蛋白表达在酵母菌细胞表面,大大提高酵母细胞吸附重金属的能力。Pulsawat等[20]研究发现,胞外聚合物EPS可快速固定Mg2+、Pb2+和Cu2+,对Pb2+具有最高的亲和力。细菌较其他种类微生物表现出优异的吸附性能,因为细菌具有巨大的比表面积且细胞表面具有丰富的表面基团。另外,现代基因组学技术(如次代测序技术[21]、转基因技术[22])的引入大大增加了微生物对重金属的吸附容量,使得重金属的靶向选择吸附成为可能。

表2 吸附重金属离子的主要功能基团[23]Table 2 Important functional groups involved in metal ion biosorption[23]
微生物富集是细胞内分泌的载体蛋白(金属硫蛋白)、络合物及多肽物质等与进入细胞内的重金属发生一系列反应形成沉淀或络合物而将重金属固定、积累。它是一种主动代谢的部分可逆过程,期间需要能量和呼吸作用才能够完成[14]。微生物富集过程发生在重金属浓度在微生物耐受范围内或是对某些重金属的解毒过程[24-25],其能耐受一定浓度的重金属,但如果重金属浓度过大就会对微生物造成毒害并产生一定的损伤。Anushree研究发现,在菌体细胞内操纵子的作用下,Cd2+与金属硫蛋白结合成复合物或多磷酸盐沉淀从而降低了Cd毒性。重组的大肠埃希菌能分泌表达一种Cd2+螯合多肽,大大增加了Cd在细菌胞内的富集[26]。另外,全基因组测序技术的应用能标记靶向基因进一步提高微生物对重金属的富集效率[27-28]。

表3 微生物对不同重金属的吸附容量(mmol/g)[29]Table 3 Metal ion biosorption capacity of micro-organism(mmol/g)[29]
2.2 生物转化
微生物对重金属离子的生物转化作用主要包括氧化还原、甲基化/去甲基化和配位络合等,通过这些作用能改变重金属离子的溶解性、迁移性,将其转化为低毒或无毒的物质,降低生态危害性,减少重金属的毒性[30]。如将Mn4+还原为Mn2+、Cr6+还原为Cr3+、Hg2+转化为具有挥发性的Hg等。
微生物参与的氧化还原反应可以分为同化和异化氧化还原反应两种形式。在同化反应中重金属离子以末端电子受体参与微生物代谢过程,而异化反应中重金属离子并未直接参与其中,间接的影响代谢反应过程。微生物在代谢过程中产生的汞还原酶可催化还原离子态汞为元素态汞,形成的汞通过挥发或以沉淀的方式从土壤环境中去除,消除汞对环境的生态威胁[31]。Cr(Ⅵ)还原微生物可通过酶促反应或以其他还原性化合物为电子供体存在下,可将有毒的Cr(Ⅵ)还原为Cr(Ⅲ),低毒性的Cr(Ⅲ)被微生物自身代谢产生的物质络合[32]。甲基化/去甲基化是很多重金属生物地球化学循环过程中的重要转化过程。对As来说,甲基化产物可以降低其生物毒性,许多微生物可以将无机砷转化为甲基化合物(甲基砷酸、二甲基砷酸、三甲基砷酸氧化物)等毒性较低的物质。有研究表明青霉菌对砷具有甲基化作用,培养一周后砷的挥发量高达43.94 μg[33]。而对于Hg而言,去甲基化才能降低其生物毒性。目前较为常见的一种研究是运用mer操纵子编码作用蛋白,通过去甲基化过程,将毒性大的有机汞转化为零价汞。某些微生物在汞还原酶和有机汞裂解酶的作用下可将甲基汞转化为元素态汞和甲烷,但硫酸盐还原菌(SRB)和产甲烷菌则是将甲基汞转化为汞离子和二氧化碳等物质,其反应方程如公式1所示[34]。微生物也可通过自身的活动引起周边环境条件的变化(如pH),从而改变环境介质对重金属的吸附特性。

2.3 生物溶解
由于微生物与重金属作用的复杂多样性,土壤微生物能够利用土壤中丰富的营养物质生长代谢出多种小分子有机酸如甲酸、乙酸、丙酸、草酸、柠檬酸、丁酸等,这些有机酸可与土壤重金属化合物及含重金属的矿物发生一系列反应,促进土壤中重金属的溶解,提高其生物有效性[35]。Choppala等研究了3种真菌(Aspergillusniger、Penicilliumbilaiae和Penicilliumsp.)对重金属污染土壤的修复能力。在不同浓度重金属胁迫下考察其分泌的主要有机酸种类,结果表明A.niger、P.bilaiae的主要分泌物为草酸和柠檬酸,在重金属污染土壤中重金属被显著活化,Pb2+、Cu2+、Zn2+的最大释放量分别达到12%、90%、35%,Penicilliumsp.对重金属未表现出显著作用。重金属活化的原因主要是微生物产生的小分子螯合酸及土壤pH的下降[36]。王桂萍等[37]从废旧的铜矿区分离筛选出对铜具有高抗性的菌株F16a(肠杆菌属)和F17a(假单胞菌属),研究两种菌株对CuCO3的溶解作用。在含有高浓度Cu2+的液体中培养48 h后,接种F16a培养基上清液中Cu2+浓度增加了近3倍,而接种F17a的培养基上清液中Cu2+浓度反而下降了近6倍,这是因为F17a菌对Cu2+具有胞内积累作用。通过盆栽实验验证F16a(肠杆菌属)对Cu的作用效果,结果表明重金属污染土壤接种F16a后,土壤中Cu2+活性显著提高,同时,三叶草中Cu2+的积累量显著增加[38]。所以,重金属的活化程度取决于微生物有机酸产生量的大小,而有机酸的产生又由多种机制以及多个过程决定,所以微生物溶解重金属的潜力还需要进一步的研究。
2.4 生物表面活性剂
生物表面活性剂是由微生物或微生物-植物共生在一定条件下产生的具有一定表面活性的两性(疏水性和亲水性)代谢产物。表面活性剂分子结构主要由疏油亲水的极性基团和疏水亲油的碳氢链非极性基团两部分组成。在土壤界面,微生物产生的表面活性剂与重金属形成各种配合物,把重金属从土壤中解析出来,增加重金属的植物可利用形态。微生物表面活性剂可能主要通过两种形式使重金属从土壤界面解析,一种是络合土壤液相中的游离态重金属离子;另一种是降低重金属与土壤之间的界面张力,使重金属与生物表面活性剂直接接触捕获[39]。如果土壤中重金属的浓度过高超过了微生物自身生存的耐受程度,也可以单独施用生物表面活性剂与重金属反应沉淀,再通过一系列的其他方式将其从土壤中分离除去。有研究表明微生物表面活性剂鼠李糖脂(铜绿假单胞菌产生)经过发泡后对Pb2+和Cd2+的去除率达到68%和73%[40]。Chen等[41]研究微生物表面活性剂认为其与重金属离子之间的作用主要分为三步:①微生物表面活性剂的吸附过程,即微生物表面活性剂从胶束中分离并吸附在土壤颗粒表面;②竞争吸附位点,土壤溶液中的表面活性剂分子与被吸附的分子竞争土壤颗粒表面的吸附位点;③重金属离子的去除,微生物表面活性剂形成的单分子层在土壤两相界面会发生重排,使活性剂分子的亲水基团朝外,络合重金属离子后形成稳定的可溶物以达到去除的目的。朱清清等[42]研究了皂角苷在不同浓度及pH值下对复合重金属(Cd、Pb、Zn、Cu)污染土壤的修复效果,结果表明当pH为5.2,皂角苷浓度为5%时土壤中Cd2+、Zn2+、Pb2+、Cu2+的去除率分别为45%、19%、17%、24%。另外,生物表面活性剂的种类、浓度及环境的pH值、土壤类型都会对修复效果产生一定的影响[43]。
3 微生物-植物联合修复
植物修复是土壤重金属污染修复的一种彻底有效的方法,但是其修复效率受很多因素的影响。若污染土壤重金属浓度过高,植物的物理化学特性及抗性机制都会受到抑制,大大降低重金属的修复效率。为克服这一弊端,采用微生物-植物联合修复的方法,利用微生物对重金属的解毒作用,减少重金属对植物的危害,促进植物生长,增强植物修复重金属的能力,原理如图2所示。
微生物在生长代谢过程中产生的一些代谢产物(如:有机酸、载体蛋白、植物激素等)会对土壤中重金属的活性产生一定的影响。重金属污染土壤中金属离子与土壤粒子之间紧密结合,不容易被富集植物提取吸收[44]。某些细菌能分泌一些小分子有机酸溶解被固定的重金属如Ni[45]、Cu[46]和Zn[47],促进植物对其的吸收。许多有机酸像乳酸、柠檬酸、苹果酸、草酸、酒石酸、甲酸、琥珀酸都具有螯合重金属的特性[48]。Gamalero等研究表明接种微生物活性剂(PSB)能增加重金属的生物活性,促进重金属从土壤中的释放[44,49]。而植物在生长过程中分泌到根外的某些物质如糖类、蛋白质等以及生长过程中死亡的根系或脱落物又能够为微生物提供养分,两者相互促进协调生长。
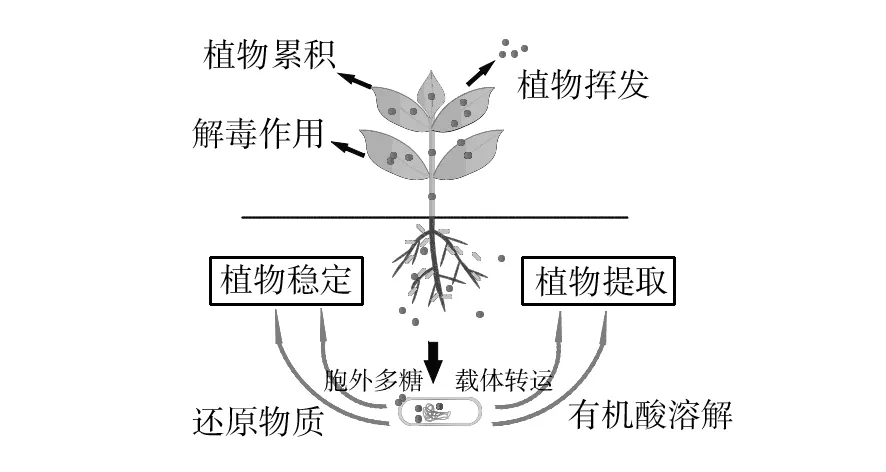
图2 微生物-植物联合修复重金属原理Fig.2 Mechanismof plant-microorganism remediation systems on heavy metal
另外,土壤中铁离子主要以Fe3+形式存在,并能形成不溶的氢氧化物和氢氧化合物,不能被微生物及植物利用。在此条件下,细菌能产生一种小分子铁载体蛋白,这种载体蛋白对Fe3+具有很强的亲和力[50]。同样,铁载体蛋白对某些重金属也具有螯合作用如Mn、Cr、Cd、Zn、Cu等[49,51]。Kumar等[52]研究表明溶磷菌属Enterobactersp. NBRI K28能产生大量铁载体蛋白,不仅能增加芥菜的生物量也能促进芥菜对Ni+、Zn2+、Cr6+的吸收。再者,吲哚乙酸是一种非常重要的植物激素,能调节植物的形态特征及生化功能[53]。虽然吲哚乙酸能刺激根的生长并能缓解各种植物症状,但最主要的作用在于它能促进植物侧根的形成,增加根的表面积,扩大植物根部与土壤粒子之间的接触面积[54]。很多研究表明土壤中溶磷菌属能够分泌吲哚乙酸,它能吸附到植物根部的表面诱导根生成内源吲哚乙酸,但吲哚乙酸的浓度过高也会抑制植物根部的生长发育[52]。在重金属污染的土壤中,微生物分泌的吲哚乙酸能触发寄主植物细胞代谢的生理变化,从而缓解高浓度重金属污染对植物的危害。
植物在重金属污染土壤的生长过程中往往伴生着种类繁多、功能复杂且数量庞大的耐高浓度重金属的微生物种群,对植物的生长和土壤性质的改变都有诸多益处。在研究植物修复相关的微生物种群中,根际微生物受到极大关注,因为它们可直接改变土壤本身的pH也能释放螯合剂以及发生一系列的氧化/还原反应改变重金属的生物活性进而强化植物修复的过程。表4为国内外微生物-植物联合修复重金属的部分研究实例。

表4 微生物溶解-植物提取/稳定联合修复Table 4 Micro-organismsolubilizing-phytoextraction and phytostabilization remediation
4 展 望
我国微生物资源丰富,菌种资源多样、微生物修复产品种类繁多、应用范围广泛。丰富的微生物资源为发展微生物修复产业提供了保证。总体上,微生物修复研究工作主要集中在筛选和驯化特异性高效降解菌株,提高功能菌在土壤中的活性、长期性和安全性,微生物环境参数的优化和养分、温度、湿度等关键因子的调控等方面。但土壤微生物修复技术在以下几个方面还需要加强:首先,在开发现有高效微生物资源的基础上,继续筛选和驯化新的优势菌株,开展典型污染物微生物降解的基因组研究,以揭示其微生物遗传多样性与功能基因,在全面掌握污染物修复菌株生理生化特性的基础上,重组构建污染物修复关键酶及功能优化的基因工程菌等;其次,由于土壤复合污染的普遍性、特殊性和复杂性,往往需要多途径、多方式相互组合的修复手段,发展微生物修复与其他现场修复工程的嫁接和移植技术(植物-微生物联合),以达到彻底修复的目的,联合修复手段在重金属污染土壤的修复中显示出很好的应用前景;最后,实验室修复研究阶段因研究条件较为理想化,干扰因素可控,其修复效果较为明显,而放大到现场条件下,环境因素复杂,修复效果将大打折扣。因此,微生物修复技术的工程化研究必须结合环境工程、环境化学及环境土壤学等多学科知识,构建出一套因地制宜的污染土壤田间修复工程集成技术,并设计开发出针对性强、高效简洁、成本低廉的微生物修复设备,以实现微生物修复技术在工程化应用上质的飞跃。
参考文献:
[1] Brookes PC. Effects of metal toxicity on the size of the soil microbial biomass[J].Journal of Soil Science,2009, 35:341-346.
[2] Mcgrath SP, Chaudhri AM, Giller KE. Long-term effects of metals in sewage on soils, microorganisms, and plants[J]. Journal of Industrial Microbiology,2010, 14: 94-101.
[3] Fliepbach A, Martens R, Peber H.Soil microbial biomass and activity in soils treated with heavy metal contaminated sewage sludge[J]. Soil Biol. Biochem., 2014,26:1201-1205.
[4] 曹心德, 魏晓欣, 代革联, 等. 土壤重金属复合污染及其化学钝化修复技术研究进展[J].环境工程学报,2011,7:1441-1453.
[5] Kandeler E, Kyftebegger G,Schwarz S. Influence of heavy metals o n the functional diversity of soil microbial communities[J]. Biology and Fertility of Soils, 1997, 23:299-306.
[6] 陈程, 陈明. 环境重金属污染的危害与修复[J]. 环境保护,2010,(3):55-57.
[7] 向捷,陈永华,向敏,等.土壤重金属污染修复技术比较研究[J].安徽农业科学,2014,(22):7367 -7369.
[8] Bolan N, Kunhikrishnan A, Thangarajanr, et al. Remediation of heavy metal(loid)s contaminated soils to mobilize or to immobilize?[J].Journal of Hazardous Materials,2014, 266:141-166.
[9] 廖健.土壤重金属污染及其化学修复技术的研究进展[J].中国石油和化工标准与质量, 2013,(24):30.
[10] 刘丽.土壤重金属污染化学修复方法研究进展[J].安徽农业科学,2014,(19):6226-6228.
[11] 陈楠. 微生物在重金属污染土壤修复中的作用研究[J]. 环境科学与管理,2016,02:86-90.
[12] 王新,周启星. 重金属与土壤微生物的相互作用及污染土壤修复[J]. 环境污染治理技术与设备,2004,11:1-5.
[13] Joutey NT, Sayel H, Bahaid W, et al, N. Mechanisms of hexavalent chromium resistance and removal by microorganisms[J]. Rev. Environ.Contam. Toxicol, 2015,233:45-69.
[14] Velásquez L, Dussan J. Biosorption and bioaccumulation of heavy metals on dead and living biomass of Bacillus sphaericus[J]. J. Hazard. Mater,2009,167:713-716.
[15] Almeida SM, Umeo SH,Marcante RC, et al. Iron bioaccumulation in mycelium ofPleurotusostreatus[J]. Braz. J. Microbiol, 2015,46:195-200.
[16] Zhou W, Zhang Y, Ding X, et al. Magnetotactic bacteria: promising biosorbents for heavy metals[J]. Appl.Microbiol. Biotechnol,2012,95:1097-1104.
[17] Jaiswar S, Kazi MA, Mehta S. Bioaccumulation of heavy metals by fresh water algal species of Bhavnagar, Gujarat, India[J]. J. Environ. Biol, 2015,36:1361-1366.
[18] Diepens NJ, Dimitrov MR, Koelmans AA, et al. Molecular assessment of bacterial community dynamics and functional end points during sediment bioaccumulation tests[J]. Environ. Sci. Technol, 2015,49:13586-13595.
[19] Kuroda K, Ueda M. Effective display of metallothionein tandemrepeats on the bioadsorption of Cadmiumion[J].ApplMicrobiolBiotechnol,2006,70:458-463.
[20] Pulsawat W, Leksawasdi N, Rogers PL, et al. Anions effects on biosorption of Mn (Ⅱ) by extracellular polymeric substance (EPS)from Rhizobiumetli[J].Biotechnology Letters,2003,25:1267-1270.
[21] El-Metwally S, Ouda OM, Helmy M. Next Generation SequencingTechnologies and Challenges in Sequence Assembly, 1st Edn[M].New York, NY:Springer, 2014.
[22] Bao Z,Cobb RE, Zhao H. Accelerated genome engineering through multiplexing[J]. Wiley Interdiscip. Rev. Syst. Biol. Med, 2016,8:5-21.
[23] Volesky B. Biosorption and me[J]. Water Res., 2007,41 (18):4017-4029.
[24] Ashauer R,Hintermeister A,O′Connor I, et al. Significance of xenobiotic metabolism for bioaccumulation kinetics of organic chemicals inGammaruspulex[J]. Environ. Sci. Technol, 2012,46:3498-3508.
[25] Mishra A, Malik A. Recent advances in microbial metalbioaccumulation[J]. Crit. Rev. Environ. Sci. Technol, 2013,43: 1162-1222.
[26] Bae W,Mehra RK,Mulchandani A, et al. Genetic engineeringofEscherichiacolifor enhanced uptake and bioaccumulation of mercury[J]. Appl.Environ. Microbiol, 2001,67:5335-5338.
[27] Leung PTY, Ip JCH, Mak SST, et al. De novo transcriptome analysis of Pernaviridis highlightstissue-specific patterns for environmental studies[J]. BMC Genomics,2014,15:804.
[28] Shi B, Huang Z, Xiang X, et al.Transcriptome analysis of the key role of GAT2 gene in the hyper-accumulation of copper in the oyster Crassostreaangulata[J]. Sci. Rep, 2015,5:17751.
[29] 薛高尚,胡丽娟,田云,等. 微生物修复技术在重金属污染治理中的研究进展[J]. 中国农学通报,2012,11:266-271.
[30] 滕应,骆永明,李振高.污染土壤的微生物修复原理与技术进展[J].土壤,2007,39(4):497-502.
[31] 李韵诗,冯冲凌,吴晓芙,等. 重金属污染土壤植物修复中的微生物功能研究进展[J]. 生态学报,2015,20:6881-6890.
[32] Kamaludeen SPB, Megharaj M, Juhasz AL,et al. Chromium-microorganism interactions in soils: remediation implications[J].Reviews of Environmental Contamination and Toxicology,2003,178:93-164.
[33] Visoottiviseth P,Panviroj N. Selection of fungi capable of removing toxic arsenic compounds from liquid medium[J]. Science Asia,2001,27(2):83-92.
[34] Pedrero Z,Bridou R, Mounicou S, et al.Transformation, localization and biomolecular binding of Hg species atsubcellular level in methylating and nonmethylating sulfate-reducing bacteria[J]. Environmental Science and Technology, 2012,46(21):11744-11751.
[35] 吴敏,关锐,关旸,等.土壤重金属污染的微生物修复机理研究进展[J].哈尔滨师范大学自然科学学报,2014,30(3):147-150.
[36] Choppala G, Bolan N, Kunhikrishnan A, et al. Concomitant reduction and immobilization of chromium in relation to its bioavailability insoils[J]. Environmental Science and Pollution Research, 2013, [Epab ahead of print].
[37] 王桂萍,郭明志,陈亚华,等.两株抗铜细菌的筛选、鉴定及对碳酸铜的溶解作用[J].土壤,2014,(3):498-503.
[38] 王桂萍,郭明志,陈亚华,等.抗铜细菌对难溶性铜的活化及其强化植物修复铜污染土壤[J].农业环境科学学报,2014,(2):332-338.
[39] Miller RM. Biosurfactant-facilitated remediation of metal-contaminated soils[J]. Environmental Health Perspectives,1995,103(S1): 59-62.
[40] Pedrero Z,Bridou R, Mounicou S, et al. Transformation, localization, and biomolecular binding of Hg species at subcellular level in methylating and nonmethylating sulfate-reducing bacteria[J]. Environmental Science & Technology, 2012, 46(21):11744-11751.
[41] Chen WJ, Hsiao LC, Chen KK, et al. Metal desorption from copper (II)/nickel (II) spiked kaolin as a soil component using plant-derived saponin biosurfactant [J]. Process Biochemistry,2008,(43): 488-498.
[42] 朱清清, 邵超英, 张琢, 等. 生物表面活性剂皂角苷增效去除土壤中重金属的研究[J]. 环境科学学报, 2010, 30(12): 2491-2498.
[43] 雷国建,陈志良,刘千钧,等. 生物表面活性剂及其在重金属污染土壤淋洗中的应用[J]. 土壤通报,2013,6:1508-1511.
[44] Gamalero E, Glick BR. Plant growth-promoting bacteria andmetals phytoremediation. In: Anjum NA, Pereira ME, Ahmad I,Duarte AC, Umar S, Khan NA (eds) Phytotechnologies: remediation of environmental contaminants[J]. CRC Press, BocaRaton, 2012, 361-376.
[45] Becerra-Castro C, Prieto-Ferna′ndez A, Alvarez-Lopez V, et al. Nickelsolubilizing capacity and characterization of rhizobacteria isolated from hyperaccumulating and non-hyperaccumulating subspecies ofAlyssumserpyllifolium[J]. Int J Phytoremediat, 2011,1:229-244.
[46] Li K, Ramakrishna W. Effect of multiple metal resistantbacteria from contaminated lake sediments on metal accumulation and plant growth[J]. J Hazard Mater, 2011,189:531-539.
[47] He H, Ye Z, Yang D, et al. Characterization ofendophyticRahnellasp.JN6 from Polygonumpubescens and its potential in promoting growth and Cd, Pb, Zn uptake by Brassica napus[J]. Chemosphere, 2013,90:1960-1965.
[48] Panhwar QA, Jusop S, Naher UA, et al. Application of potential phosphate-solubilizing bacteria andorganic acids on phosphate solubilization from phosphate rock in aerobic rice[J]. Sci World J,2013,(4):272409.
[49] Singh Y, Ramteke PW, Shukla PK. Isolation and characterization of heavy metal resistantPseudomonasspp. and their plant growth promoting activities[J]. AdvApplSci Res, 2013,4:269-272.
[50] Schalk IJ, Hannauer M, Braud A. New roles for bacterial siderophores in metal transport and tolerance[J]. Environ Microbiol, 2011,13:2844-2854.
[51] Rajkumar M, Ae N, Prasad MNV, et al. Potential of siderophore-producing bacteria for improving heavy metal phytoextraction[J]. Trends Biotechnol, 2010, 28:142-149.
[52] Kumar KV, Singh N, Behl HM, et al. Influence of plantgrowth promoting bacteria and its mutant on heavy metal toxicity in Brassica juncea grown in fiy ash amended soil[J].Chemosphere,2008,72:678-683.
[53] Glick BR. Plant growth-promoting bacteria: mechanisms andapplications[J]. Scientifica, 2012,(5):963401.
[54] Ahemad M, Kibret M. Mechanisms and applications of plantgrowth promoting rhizobacteria: current perspective[J]. J KingSaud Univ Sci., 2014,26(1):1-20.
[55] Rajkumar M, Ma Y, Freitas H. Characterization of metalresistant plant-growth promotingBacillusweihenstephanensisisolated from serpentine soil in Portugal[J]. J Basic Microbiol,2008,48:500-508.
[56] GanesanV. Rhizoremediation of cadmium soil using acadmium-resistant plant growth promoting rhizopseudomonad[J].CurrMicrobiol, 2008,56:403-407.
[57] Jiang CY, Sheng XF, Qian M, et al. Isolation andcharacterization of a heavy metal resistantBurkholderiasp. Fromheavy metal-contaminated paddyfield soil and its potential inpromoting plant growth and heavy metal accumulation in metalpolluted soil[J]. Chemosphere, 2008,72:157-164.
[58] Oves M, Khan MS, Zaidi A. Chromium reducing and plantgrowth promoting novel strainPseudomonasaeruginosaOSG41enhance chickpea growth in chromium amended soils[J]. Eur J Soil Biol, 2013, 56:72-83.
[59] Gupta A, Rai V, Bagdwal N, et al. In situ characterization ofmercury resistant growth promoting fluorescent pseudomonads[J].MicrobiolRes, 2005,160:385-388.
[60] Misra N, Gupta G, Jha PN. Assessment of mineral phosphate-solubilizing properties and molecular characterization of zinc-tolerant bacteria[J]. J Basic Microbiol, 2012,52:549-558.
[61] Wang Q, Xiong D, Zhao P, et al. Tu BWang G Effects of applying an arsenic resistant and plant growth promoting rhizobacterium to enhance soil arsenic phytoremediation byPopulusdeltoidesLH05-17[J]. J. Appl. Microbiol, 2011, 111:1065-1074.

