桃树根部内生真菌ZJ-4的分离鉴定及其对桃褐腐病的抑制效果
侯 旭, 关 伟, 胡 晓, 袁 雪, 张国庆, 刘悦萍*
(1.北京农学院 生物科学与工程学院,北京 102206;2.北京市平谷区人民政府 果品办公室,北京 101200;3.北京农学院 植物科学与技术学院,北京 102206)
桃(PrunuspersicaL.)属于蔷薇科(Rosaceae)李属(Prunus)植物,是我国最重要的果树资源之一。桃褐腐病是记载最早的桃果实采后病害,目前在我国北京、陕西和云南等地桃园发生严重,一般在采摘前期及采后贮藏期大面积发病,在北京平谷桃产区,美澳型核果链核盘菌(Moniliniafructicola)是引发桃褐腐病的优势菌株,病害的发生使桃果实失去商品价值,对桃产业造成巨大的经济损失[1-2]。目前防治桃褐腐病的主要手段是喷施苯醚甲环唑,其属于三唑类化学杀菌剂(DMI),但该方法不仅提高了种植成本,遇高温多雨天气防效减弱,而且喷施过程中化学杀菌剂易污染果实表面,使果实品质下降[3]。已有研究显示,该类杀菌剂还会危害人体皮肤和黏膜,产生食品安全问题,影响公众健康,现今欧洲已有禁止在采摘期的核果类果实上喷洒一切化学农药的规定[4]。此外化学杀菌剂的作用靶点单一,随着其大量使用,近20年内M.fructicola已对DMI类等常用杀菌剂产生了抗药性[5]。利用生物防治手段能够安全有效地控制植物病害,不会影响果实品质,对人体亦无危害,目前已有很多成功的研究报告[6]。因此找到能够抑制桃褐腐病的生防菌,研发相关生防菌剂是目前桃生产中亟待解决的问题。植物内生菌(Endophyte)是指生活史的一定阶段或全部阶段处于健康植物组织和器官内部的微生物[7]。植物组织内普遍存在着内生菌,其中有大量的能够长期稳定定殖于宿主组织中,并对宿主产生有益效应的菌株[8]。一方面植物体为该类内生菌提供其生长必需的能量和营养;另一方面,内生菌又可通过自身的代谢产物,促进植物生长发育、提高抗逆能力,两者互惠共生[9]。果树内生菌对果树和果实品质的影响是目前内生菌研究的热点问题,有研究表明,果树内生菌不仅可以很好地防治果树本身的病害,在果实中定殖,其代谢产物还有促进果树生长的作用[10-12]。随着传统化学防治法在使用上愈加受限,生物防治必将成为桃褐腐病害综合治理的重要手段和果树采后病害防控的研究热点[13]。目前生防菌的筛选源一般来自土壤,以内生菌作为生物防治菌种筛选源的研究较少,且其产生的51%的生物活性物质是未知的。而相较其他来源的生防菌,内生菌还具有防治效果受外界环境的变化影响小的优点[14]。因此果树内生菌的研究既具有良好的开发利用前景,又具有理论研究价值[15-16]。本研究分离了桃树根部的内生真菌,初步鉴定了其中对桃褐腐病害有抑制作用的菌株,对其生防机制进行了初步研究。
1 材料与方法
1.1 材料
1.1.1 样品采集 2016年8月,自北京平谷西鹿角村桃园中随机选取4棵健康的10年树龄 “大久保”桃树,于距离主干半径30 cm的圆形范围内随机选取5点,采集距地面15 cm深,直径约2~3 cm的侧根组织样品。4 ℃保存运回实验室,随后进行内生菌株分离。另随机选取2棵健康的10年树龄“大久保”桃树,在同一方向的结果枝,随机选取健康完好、成熟度相似的桃果实。
1.1.2 供试病原菌 分离自北京平谷桃园的美澳型核果链核盘菌(M.fructicola),鉴定保存于北京农学院生物科学与工程学院实验室。
1.1.3 培养基 PDA培养基。
1.1.4 仪器与设备 烘箱(WGLL-30BE),泰斯特公司;冷冻干燥仪(VFD-21S),日本维尔德公司;光学显微镜(LEICA-MD500)、扫描电镜(TS-5136SB)、透射电镜(H-7650),德国莱卡公司。
1.1.5 试剂 新型植物基因组DNA提取试剂盒(DP-320,北京天根生化科技有限公司);次氯酸钠、戊二醇、磷酸缓冲液、锇酸、无水乙醇、叔丁醇、丙酮,国药集团化学试剂有限公司;Spurr包埋树脂、醋酸铀、柠檬酸铅,北京新兴百瑞技术有限公司。
1.2 方法
1.2.1 内生拮抗真菌ZJ-4的分离及抑菌效果 桃树根部组织样品经75%无水乙醇浸泡30 s,4%次氯酸钠擦拭表面后,放入无菌水中浸泡2 min,并重复3次。用灭菌手术刀将样品切成1 mm2的薄片,半嵌入PDA(土豆葡萄糖琼脂)培养基中,每板放入3片。28 ℃暗环境下培养7 d后,将内生真菌分离纯化到斜面培养基上4 ℃保存,准备下一步实验。取最后一次浸泡过桃树组织的无菌水100 μL涂布在PDA培养基上,置于相同环境下培养,以检测样品表面是否灭菌彻底。以桃褐腐病原菌作为目标菌,采用两点对峙培养法进行内生拮抗真菌的筛选,以内径5 mm的打孔器打取菌种菌饼。只接种桃褐腐病原菌不接种内生真菌的PDA培养基作为对照组;提前3 d接种桃褐腐病原菌再接种ZJ-4的PDA培养基作为实验组1;同时接种内生真菌与桃褐腐病原菌的PDA培养基作为实验组2;提前3 d接种ZJ-4再接种桃褐腐病原菌的PDA培养基作为实验组3。各组两菌饼相距3 cm,每组对峙培养重复3次,置于28 ℃暗环境下培养7 d,观察记录结果并拍照。测量对照组桃褐腐病原菌菌落生长半径(RC),以及实验组桃褐腐病向内生真菌方向生长的距离(RP),带入以下公式计算抑菌率,选择其中抑菌率最高的内生真菌进行下一步实验[17]。抑菌率(%)= ( ( RC-RP) / RC)× 100%。
1.2.2 内生拮抗真菌的初步鉴定 将筛选得到的内生拮抗真菌ZJ-4接种于PDA培养基上,在28 ℃环境下暗培养。参考《真菌鉴定手册》观察其菌落生长形态并记录拍照[18]。提取内生真菌DNA,采用保守序列测定法对内生拮抗真菌进行分子鉴定。测序引物为ITS区通用引物:ITS1(5′-TCCGTAGGTGAACCTGCGG-3′),ITS4(5′-TCCTCCGCTTATTGATATGC-3′)。采用25 μL的PCR扩增体系:前后引物各1 μL,2×TaqPCR Master Mix(北京天根生化科技有限公司)12.5 μL,ddH2O 10 μL,模板DNA 0.5 μL。反应条件:95 ℃ 5 min,94 ℃ 30 s,58 ℃ 40 s,72 ℃ 90 s,35个循环,72 ℃ 10 min,产物送至生工生物工程(上海)股份有限公司完成测序。将序列提交到GenBank数据库获取登录号,通过Blast进行同源性比对并构建系统发育树(MEGA 7.0)。
1.2.3 桃果实离体实验 将“大久保”桃果实在75%酒精中浸泡30 s,用蘸有4%次氯酸钠溶液的棉签擦拭果实表面,无菌水冲洗后用5 mm打孔器在每个桃果实对侧剔除果肉,造成两个人工创口,创口处放入空白PDA培养基块和只接种桃褐腐病原菌的作为对照组1和对照组2,两对照组各取4个桃果实;创口处同时接种内生拮抗真菌及桃褐腐病原菌作为实验组,共接种8个桃果实。实验组与对照组桃果实均置于30 ℃,湿度为80%的环境下暗培养,测量记录发病创口数、病斑平均直径(d),按公式计算桃果实发病率以及发病果上桃褐腐病生长面积:发病率(%)=(发病位置个数/总接种位置个数)×100%,发病面积=1/4×π×d2。
1.2.4 电子显微镜观察 在两点对峙实验平板上,选择靠近内生拮抗真菌且生长受其抑制位置的桃褐腐病菌丝及孢子作为实验组,另取3个生长天数与实验组相同的正常生长的桃褐腐病原菌平板,选择其菌落边缘位置的菌体作为对照组,无菌环境下将目标位置桃褐腐病原菌样品切成2 mm3正方体样品。样品放入装有2.5%戊二醛的离心管中,常温固定6 h后,于4 ℃冰箱中保存过夜。隔夜取出样品,用0.1 mol/L PBS缓冲液冲洗5次,洗脱后立即放入锇酸溶液中,常温固定2 h,再次洗脱。样品在梯度乙醇中脱水后,经常规方法处理即可使用扫描电镜及透射电镜观察拍照,记录结果。
2 结果与分析
2.1 内生拮抗真菌ZJ-4的平板对峙抑菌效果
自桃树根组织样品中分离内生真菌,经筛选得到1株对桃褐腐病原菌生长有抑制效果的拮抗真菌ZJ-4。在平板对峙抑菌效果测定实验中,先接种桃褐腐病原菌,3 d后再接种ZJ-4,测得抑菌率为69.86%;同时接种桃褐腐病原菌与ZJ-4后,抑菌率为78.81%;先接种ZJ-4,3 d后再接种病原菌,抑菌率达85.33%(表1)。生长靠近ZJ-4的桃褐腐病原菌体上未发现深褐色的分生孢子簇,菌落边缘呈扩散状生长的基内菌丝在靠近ZJ-4的菌落后亦无法进一步生长(图1B、C、D)。

图1 内生真菌ZJ-4对桃褐腐病原菌生长的抑制效果Fig.1 Inhibitory effect of endophytic fungus ZJ-4 on growth of M. fructicolaA:PDA培养基上生长7 d的桃褐腐病原菌;B:先接种桃褐腐病原菌,3 d后再接种ZJ-4,共培养4 d后的菌落形态;C:桃褐腐病原菌与ZJ-4同时接种,共培养7 d后的菌落形态;D:先接种ZJ-4,3 d后再接种病原菌,共培养4 d后的菌落形态A: The M. fructicola growth for 7 days on PDA Medium; B: M. fructicola was inoculated firstly, ZJ-4 was inoculated 3 days later, the characteristic of colonial morphology after 4 days co-culture; C: The M. fructicola and ZJ-4 were inoculated simultaneously, the characteristic of colonial morphology after 4 days co-culture; D: ZJ-4 was inoculated firstly, M. fructicola was inoculated 3 days later, the characteristic of colonial morphology after 4 days co-culture

表1 桃内生拮抗菌ZJ-4对桃褐腐病原菌生长的抑制作用Table 1 Inhibitory effect of endophytic fungus ZJ-4 on growth of M. fructicola
注:表中“±”表示菌落平均半径的标准偏差;不同字母代表同列数据的显著性差异(P≤0. 05),下表同
2.2 内生拮抗真菌ZJ-4的初步鉴定
在PDA培养基28 ℃暗环境下生长7 d后,ZJ-4圆形菌落边缘呈等经辐射状平铺生长,菌落初期为白色,后期颜色加深呈现淡黄色,并出现大量子囊壳,生长过程中无渗出物,不产生色素(图2A);菌丝有隔膜,气生菌丝、基内菌丝均不发达,菌丝直径2.8~3.3 μm(图2B);子囊壳为球形,直径8~12 mm,子囊孢子呈椭圆形,长径3.4~4.4 μm(图2C、D)。经ITS测序分析,内生拮抗真菌ZJ-4与篮状菌属(Talaromyces)的真菌同源性为100%,结合菌落形态学特征,初步鉴定ZJ-4为篮状菌属(图3)[19]。

图2 内生真菌ZJ-4生长性状Fig.2 The growth traits of endophytic fungus ZJ-4A:在PDA培养基上生长7 d的ZJ-4;B:ZJ-4的菌丝;C:ZJ-4的子囊壳和子囊孢子;D:ZJ-4的子囊孢子A: The ZJ-4 growth for 7 days on PDA Medium; B: The mycelia of ZJ-4; C: The perithecium and ascospore of ZJ-4; D: The ascospore of ZJ-4

图3 根据内生真菌ZJ-4的ITS基因序列为基础构建的系统发育树Fig.3 The constructed phylogenetic tree based on the ITS gene sequence analysis of the endophytic fungus ZJ-4
2.3 桃果实离体抑菌实验
在30 ℃、湿度80%的环境下培养3 d后,接种桃褐腐病菌饼的对照组8个创口发病率为100%,病斑平均面积为12.6 cm2,且创口周围有呈环状生长的深褐色分生孢子簇(图4A);接种空白PDA培养基块的8个创口未出现染病现象(图4B);同时接种ZJ-4以及桃褐腐病菌饼的16个创口发病率为62.5%,病斑平均面积为0.5 cm2,抑菌率为80%且创口附近未发现深褐色的桃褐腐病原菌菌丝及分生孢子簇(图4C、D, 表2)。
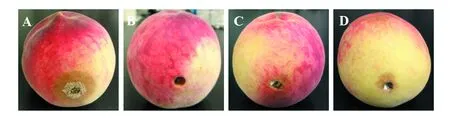
图4 离体桃果实接种内生真菌ZJ-4对桃褐腐病生长的抑制效果Fig.4 The inhibitory effects of the peach fruit in vitro inoculated with endophytic fungus ZJ-4 against M. fructicolaA:接种桃褐腐病原菌3 d的桃果实;B:接种PDA培养基块3 d的桃果实;C、D:同时接种ZJ-4和桃褐腐病原菌3 d的桃果实A: The peach fruits inoculated with M. fructicola for 3 days; B: The peach fruits inoculated with PDA medium for 3 days; C, D: The peach fruits inoculated with M. fructicola and ZJ-4 simultaneously for 3 days

表2 离体桃果实接种内生真菌ZJ-4对桃褐腐病生长的抑制效果Table 2 The inhibitory effects of the peach fruit in vitro inoculated with endophytic fungus ZJ-4 against M. fructicola
注:CK1 为接种桃褐腐病菌饼的桃果实;实验组为同时接种桃褐腐病菌饼以及ZJ-4的桃果实
2.4 内生拮抗真菌ZJ-4对桃褐腐病菌拮抗作用的电镜观察
正常生长的桃褐腐病原菌丝自然展开,表面光滑饱满,平均粗细3~5 μm(图5A)。与正常生长的菌丝相比,生长受到ZJ-4抑制的菌丝体粗细不均,相互缠绕且表面粗糙,部分位置菌丝干瘪(图5B)。桃褐腐病原菌正常生长的分生孢子一般呈柠檬状,表面光滑饱满且充盈,长7~9 μm,宽6~8 μm(图5C)。受到ZJ-4抑制的桃褐腐病分生孢子畸形现象严重,表面粗糙不平,且普遍存在干瘪凹陷的现象(图5D)。
正常生长的桃褐腐病原菌的细胞中,可明显观察到胞质溶胶充满整个细胞(图6A),而生长受到ZJ-4抑制的桃褐腐病细胞的胞质溶胶收缩凝聚,细胞壁内出现大量不规则空腔(图6B、C、D)。

图5 内生真菌ZJ-4对桃褐腐病原菌丝及分生孢子的影响Fig.5 The effect of endophyte fungus ZJ-4 on the mycelia and conidium of M. fructicolaA:正常生长的桃褐腐病原菌丝;B:受到ZJ-4抑制的桃褐腐病原菌丝;C:正常生长的桃褐腐病原菌分生孢子;D:受到ZJ-4抑制的桃褐腐病原菌分生孢子A: The normal mycelia of the M. fructicola; B: The mycelia of M. fructicola inhibited by ZJ-4; C: The normal conidium of the M. fructicola; D: The conidium of M. fructicola inhibited by ZJ-4

图6 内生真菌ZJ-4对桃褐腐病菌细胞超微结构的影响Fig.6 The effect of endophyte fungus ZJ-4 on the ultrastructure of the M. fructicola cellsA:正常生长的桃褐腐病原菌细胞;B、C、D:生长受到ZJ-4抑制的桃褐腐病原菌细胞A: The normal cell of the M. fructicola; B, C, D: The cell of M. fructicola inhibited by ZJ-4
3 讨 论
由美澳型核果类褐腐病菌(Moniliniafructicola)引发的桃褐腐病害严重影响了我国桃产业的发展,为消除化学防治带来的环境污染和对人体的危害,防治桃褐腐病害的生防菌及其菌剂的研发成为目前重要的研究课题[20]。现已报道的能够防治桃褐腐病害的生防菌,其筛选源主要为土壤和有广谱抑菌效果的植物组织,从桃树组织中分离内生菌以防治其自身病害的研究目前较少[21],而内生生防菌具有能够在植株中稳定定殖、上下传导,不影响植株生长的优点,因此其研究结果具有重要的科学和实用意义[22-23]。
本研究自桃树组织中分离到1株对桃褐腐病原菌生长有明显抑制作用的内生真菌ZJ-4,经形态学和ITS分子鉴定为篮状菌属真菌(Talaromyces)。平板对峙实验显示,先接种ZJ-4,3 d后再接种桃褐腐病原菌,抑菌率可达85%。篮状菌属真菌是目前极为重要的生防真菌之一,其能通过重寄生的方式广谱抑制多种植物病原真菌的生长,还能够向胞外分泌具有抗菌活性的几丁质酶等抑菌物质,这些抑菌活性物质能破坏病原菌的孢子、芽管和菌丝,对核盘属病原真菌有强烈的抑制作用[24-25]。目前有较多的研究证实了篮状菌属真菌的抑制效果,Naraghi等[26-27]自土壤中分离得到14株篮状菌属真菌,其中1株对番茄黄萎病和黄瓜枯萎病的病原菌生长有明显抑制作用,其还能有效防治茄子和棉花的真菌病害。魏彩燕等[28]自草莓炭疽病组织中发现1株具有广谱抗菌性的真菌MT-06,经鉴定为篮状菌属真菌中的黄篮状菌。Ghanbari等[29]筛选得到的3株篮状菌属真菌,其胞外代谢产物对小麦全蚀病原菌生长的抑制效果最高达73%。咸洪泉等[30-31]将篮状菌属真菌中黄篮状菌的几丁质酶基因转入毕赤酵母,其表达代谢并胞外分泌的大量活性物质能够很好地抑制板栗疫病、烟草赤星病和玉米弯孢病等6种植物病原真菌的生长。此外Yamagiwa[32]发现篮状菌属真菌FS2能够产生促进植物生长发育的代谢产物,现有的研究结果表明篮状菌属真菌是重要的生防菌资源。
研究显示内生真菌能够在植物组织中稳定定殖,部分代谢产物可以防治植物病害且不会引发农药残留等食品安全问题,对其抑菌机理等问题现已开展了较多研究[33-34]。本研究中,平板对峙实验和果实回接抑菌实验ZJ-4均表现出明显的抑制桃褐腐病原菌丝生长、孢子萌发的效果;经过扫描和透射电子显微镜观察发现,ZJ-4对桃褐腐病菌丝与分生孢子均有显著的致畸、破坏作用,对其细胞质有凝聚作用。观察过程中并未在生长受到抑制的桃褐腐病组织里发现ZJ-4的菌体,这表明ZJ-4向胞外分泌了有抑菌效果的代谢产物且发挥作用,这与Naraghi等[35]在使用篮状菌属真菌抑制土豆黄萎病原真菌时观察到的结果类似;刘爱新等[36]使用电子显微镜观察生长受到几丁质酶抑制的烟草赤星病原菌后,发现了病原菌体畸形、细胞溶胶凝聚、质壁分离形成空腔的现象。目前的研究显示篮状菌属真菌可能通过向胞外分泌抑菌物质,致使离体桃果实上的桃褐腐病原菌菌丝和孢子严重畸形、胞质分离,从而有效地抑制其生长。
基于上述结果,本课题组将对内生真菌ZJ-4胞外分泌的代谢产物及其抑菌作用机理做进一步研究,并探索其在果实上定殖情况、存活期和持效期等,为研发防治桃褐腐病的生物制剂提供参考。
参考文献:
[1] 李绍华. 桃树学[M]. 北京:中国农业出版社,2013: 385-387.
[2] 刘慧芹,韩巨才,赵廷昌,等. 果树内生拮抗细菌的筛选鉴定及其生防作用研究[J]. 园艺学报, 2014, 41(2):335-342.
[3] Casals C, Teixidó N, Vias I, et al. Control ofMoniliniaspp. on stone fruit by curing treatments. Part II: The effect of host andMoniliniaspp. variables on curing efficacy[J]. Postharvest Biology & Technology, 2010, 56(1): 26-30.
[5] Yin LF, Wang F, Zhang Y, et al. Evolutionary analysis revealed the horizontal transfer of the Cyt b gene from Fungi to Chromista[J]. Molecular Phylogenetics & Evolution, 2014, 76(1): 155-161.
[6] 李冬霞,武海燕,张猛,等. 枣树内生真菌的分离、鉴定及其多样性分析[J]. 果树学报, 2010, 27(6):975-979.
[7] Hallmann J, Quadt-Hallmann A, Mahaffee WF, et al. Bacterial endophytes in agricultural crops[J]. Canadian Journal of Mierobiology, 1997, 43:895-914.
[8] 陈龙,梁子宁,朱华. 植物内生菌研究进展[J]. 生物技术通报, 2015, 5(8): 30-34.
[9] Mandyam KG, Jumpponen A. Mutualism-parasitism paradigm synthesized from results of root-endophyte models[J]. Frontiers in Microbiology, 2015, 5: 1-13.
[10] 黄贵修. 植物内生菌[M]. 北京:中国农业科学技术出版社, 2013: 2-5.
[11] 袁红旭,陈勇明,何财能, 等. 拮抗炭疽病的柑橘内生细菌的分离与筛选[J]. 果树学报, 2005, 22(5):510-513.
[12] 罗明,芦云,张祥林,等. 内生拮抗细菌在哈密瓜植株体内的传导定殖和促生作用研究[J]. 西北植物学报, 2007, 27(4):719-725.
[13] Spadaro D, Gullino ML. State of the art and future prospects of the biological control of postharvest fruit diseases[J]. International Journal of Food Microbiology, 2004, 91(2): 185-194.
[14] 杨镇,曹君. 植物内生菌及其次级代谢产物的研究进展[J]. 微生物学杂志, 2016, 36(4): 1-6.
[15] Strobel G. Bioprospecting for microbial endophytes and their natural products[J]. Microbiology & Molecular Biology Reviews, 2003, 67(4): 491-502.
[16] 黄敬瑜,张楚军,姚瑜龙,等. 植物内生菌生物抗菌活性物质研究进展[J]. 生物工程学报, 2017, 33(2):178-186.
[17] 刘彩云,许瑞瑞,季洪亮,等. 一株生防内生真菌的分离筛选、鉴定及抑菌特性[J]. 植物保护学报, 2015, 42(5): 806-812.
[18] 魏景超. 真菌鉴定手册[M]. 上海:上海科学技术出版社, 1979: 380-384.
[19] 孔华忠. 中国真菌志(第35卷):青霉属及其相关有性型属(精)[M]. 北京:科学出版社, 2007: 228-231.
[20] 纪兆林,贺惠文,周慧娟,等. 地衣芽孢杆菌W10及其抗菌蛋白对桃褐腐病的抑制作用[J]. 园艺学报, 2015, 42(10): 1879-1888.
[21] 王志伟,纪燕玲,陈永敢. 植物内生菌研究及其科学意义[J]. 微生物学通报, 2015, 42(2): 349-363.
[22] 杨洪凤,薛雅蓉,余向阳,等. 内生解淀粉芽孢杆菌CC09菌株在小麦叶部的定殖能力及其防治白粉病效果研究[J]. 中国生物防治学报, 2014, 30(4):481-488.
[23] Strobel G. Bioprospecting for microbial endophytes and their natural products[J]. Microbiology & Molecular Biology Reviews, 2003, 67(4): 491-502.
[24] Houbraken J, Samson RA. Polyphasic taxonomy of the genusTalaromyces[J]. Studies in Mycology, 2014, 78(7): 175-341.
[25] Visagie CM, Jacobs K. Three new additions to the genusTalaromycesisolated from Atlantis sandveld fynbos soils[J]. Persoonia Molecular Phylogeny & Evolution of Fungi, 2012, 28(1): 14-24.
[26] Naraghi L, Heydari A, Rezaee S, et al. Biocontrol AgentTalaromycesflavus, Stimulates the Growth of Cotton and Potato[J]. Journal of Plant Growth Regulation, 2012, 31(4): 471-477.
[27] Naraghi L, Heydari A, Rezaee S, et al. Biological control of Verticillium wilt of greenhouse cucumber byTalaromycesflavus[J]. Phytopathologia Mediterranea, 2010, 49(3): 321-329.
[28] 魏彩燕,毛雪琴,柴荣耀,等. 草莓炭疽病生防菌株MT-06的鉴定及生物学特性[J]. 菌物学报, 2010, 29(4): 481-487.
[29] Ghanbari L, Mohammadi S, Naraghi L. Effect of extracellular fluid of Trichoderma andTalaromycesflavusisolates againstGaeumannomycesgraminisvar. tritici causal agent of wheat take-all disease[J]. Plant Protection Journal, 2013, 6(2): 173-181.
[30] 咸洪泉,汤伟,李安娜,等. 菌寄生真菌黄蓝状菌(Talaromycesflavus)几丁质酶基因的克隆与生物信息学分析[J]. 农业生物技术学报, 2011, 19(6): 1089-1098.
[31] 咸洪泉,汤伟,张丽青,等. 黄蓝状菌几丁质酶基因tfchi1的克隆、表达及抗菌活性[J]. 植物病理学报, 2012, 42(2): 146-153.
[32] Yamagiwa Y.TalaromyceswortmanniiFS2 emits beta-caryphyllene, which promotes plant growth and induces resistance [J]. Journal of General Plant Pathology,2012, 78(2): 145.
[33] 谭晓明,段玉鹏,谢大水. 柑橘叶片内生真菌分离及其与柑橘互作关系的初步研究[C].中国菌物学会学术年会, 2012.
[34] 武汉琴,苏经迁,谢明英,等. 茶树内生木霉种的鉴定及其在植物体内的定殖[J]. 菌物学报, 2009, 28(3):342-348.
[35] Naraghi L, Arjmandian A, Sharifi A HK, et al. Comparison between carbendazim fungicide andTalaromycesflavusin controling verticillium wilt of potato under field conditions[J]. International Journal of Agricultural Science & Research, 2014, 6(3): 96-97.
[36] 刘爱新,董汉松. 烟草几丁酶β-1,3-葡聚糖酶的抑菌作用[J]. 微生物学通报, 1999,(1):15-17.

