Fusarium oxysporim M1菌株的rDNA ITS鉴定及其纤维素酶活性及纯化研究
王世伟, 王卿惠, 马兆魁, 李小鹏, 张其法, 唐海平
(齐齐哈尔大学 生命科学与农林学院 抗性基因工程与寒地生物多样性保护 黑龙江省重点实验室, 黑龙江 齐齐哈尔 161006)
镰刀菌属(Fusariumsp.) 为真菌中较大一属,具重要学术和经济价值。镰刀菌能产生重要酶类,如纤维酶[1-3]、果胶酶[4]、木聚糖水解酶[5-6]等。通过生物转化可获得重要药物中间体或药物[7-9]。因此,镰刀菌在食品、医学等领域中具有重要作用。镰刀菌能降解有毒物质,在生物脱除氮氧化物,生物降解酚类、氰化物,吸收、蓄积、降解多环芳烃等方面发挥着巨大作用[10],在环境保护中具潜在应用价值[11]。但是,镰刀菌属是最难鉴定的属之一,形态学鉴定准确性不足,直接影响该菌株催化机制的深入研究[12]。镰刀菌分子鉴定弥补了形态学鉴定不足,已成为区分物种、变种、地理株的有效手段[13],广泛应用于镰刀菌属之间亲缘关系研究[14],特别是核糖体DNA(rDNA)在不同镰刀菌种间、甚至同种分离株间存在着高度变异等特点,因此成为镰刀菌鉴定理想方法[15]。本研究从黑龙江北大仓集团有限公司白酒大曲中分离了1株高产纤维素酶真菌M1,经形态和分子生物学综合分析,鉴定该菌株为尖孢镰刀菌(Fusariumoxysporum)。该菌能生产高活性纤维素酶,经发酵优化纤维素酶活力进一步提高。通过层析使酶纯化至同质,为进一步研究该酶催化机理提供参考。
1 材料与方法
1.1 材料
1.1.1 试验材料 黑龙江北大仓集团有限公司酿酒车间使用的北大仓白酒大曲(Daqu);ITS1/ITS4通用引物由上海生工(Sangon Biotech)合成,Taq酶和dNTP购自上海生工。
1.1.2 培养基 PDA培养基(固体加2%琼脂);刚果红培养基(质量分数,%):(NH4)2SO40.2,MgSO4·7H2O 0.05,K2HPO40.1,NaCl 0.05,羧甲基纤维素钠(CMC-Na)2.0,刚果红 0.02,琼脂 2.0,pH 7.5。粗酶发酵培养基(g/L):CMC-Na 4,酵母浸出膏5,胰蛋白胨10,NH4Cl 5,MgSO41,K2HPO41,KH2PO41,蒸馏水1 L,pH自然,其他药品均为分析纯。
1.1.3 仪器 朗基多功能PCR仪(MG96+/YPCR)购自广州飞迪生物科技有限公司;Alpha 凝胶成像系统购自美国Alpha Innotech公司;蛋白质纯化系统为美国Bio-Rad产品。
1.2 方法
1.2.1 菌株分离培养、形态学观察及产酶分析 称取0.1 g大曲,在无菌条件下接入250 mL 0.85%无菌生理盐水,120 r/min室温摇床活化2 d。取1 mL活化液,用无菌生理盐水稀释,取10-3稀释度的活化液涂布于20个PDA固体平板(每板100 μL)。30 ℃倒置培养3 d待菌落长出,然后挑取单菌落接种于PDA固体平板进行划线纯培养。将标记为M1的纯培养菌接种于PDA平板,30 ℃培养5 d待长出菌落,肉眼观察记录;将M1菌接种于PAD液体培养基,30 ℃ 150 r/min培养3 d,然后静止培养3 d,待液体培养基长出菌醭(pellicle);挑取少量菌醭,无菌条件下制片进行显微观察,对M1菌株进行初步的形态学鉴定。在无菌操作台下,用无菌接种环挑去菌醭(约1 mm2)转接到刚果红纤维素鉴别培养基上(挑取3次,转接到不同的部位)。28 ℃,倒置培养3 d,观察是否产生透明圈。根据透明圈有无判断该菌是否产生纤维素酶。
1.2.2 rDNA-ITS鉴定 取长好的菌醭3~4 g,无菌水冲洗2~3次,用无菌滤纸吸干多余水分,液氮研磨备用。按文献 [16] 提供的SDS方法提取M1真菌的DNA,ITS区段的PCR 扩增采用真菌通用引物ITS1/ITS4。上游引物ITS1:TCCGTAGGT GAACCTGCGG,下游引物ITS4:TCCTCCGCTTATTGATATGC。①PCR扩增反应总体积(50 μL):10×PCR buffer 5 μL,Mg2+(25 mmol/L) 4 μL,dNTPs (2.5 mmol/L) 4 μL,上下游引物(20 μmol/L)各2 μL,Taq聚合酶(5 U/μL)0.5 μL,模板DNA 2 μL,去离子水30.5 μL。②PCR扩增程序:94 ℃预变性5 min;94 ℃变性50 s,56 ℃退火 50 s,72 ℃延伸2 min,共40个循环;72 ℃延伸7 min。取扩增产物8 μL,与2 μL 6×loading 混合后进行琼脂糖凝胶(1%)电泳,电泳后凝胶在数字凝胶成像系统上分析、照相,剩余的PCR产物送上海生工长春分部测序。将所得真菌M1的rDNA ITS 序列输入GenBank中,获得GenBank登陆号,并通过Blast比对获得相似性最高的序列,确定真菌M1的分属地位。参照数据库中已经登记的其他真菌的rDNA ITS范围,对本研究中的真菌M1的rDNA ITS序列进行界定。 用MEGA5.05软件中的Clustal W进行多序列比对,再选用非加权组平均法(UPGMA)中的最大似然法(Maximum like lihood tree)模块构建系统发育树。
1.2.3 纤维素酶活性及发酵条件优化 将M1菌株3环转接入发酵培养基,30 ℃、120 r /min 摇瓶培养5 d,将培养液8 000 ×g 离心15 min,由于纤维素酶属于胞外酶,因此上清液即为该菌产生的纤维素酶粗酶液。本研究完全按照国标(QB 2583-2003)相关方法对真菌M1的纤维素酶活性进行测定。按附录B所述方法,通过测定纤维素酶降解底物滤纸和羧甲基纤维素钠生成的还原糖来反映纤维素酶的总酶活力。前者酶活力为滤纸酶活力(FPA),一般表示全酶活性;后者酶活力为羧甲基纤维素酶活力(CMCA),基本反映了内切酶活力。酶活定义为1 mL粗酶液在50 ℃,pH 6.0,1 h水解底物(滤纸或CMC-Na),生成相当于1 mg葡萄糖的还原糖量,为1个酶活力单位,以U/mL表示。采用二硝基水杨酸(DNS)试剂测定产生的还原糖的量。①优化温度对粗酶酶活性的影响:在原始发酵条件(自然pH)不变的情况下,改变发酵温度,采用不同的温度(20、30、35、45、50 ℃)进行发酵,研究温度对粗酶发酵液酶活性的影响;②初始pH对粗酶酶活的影响:在最优温度发酵条件下,以400 mmol/L的柠檬酸或氢氧化钠调节培养基的初始pH,产生不同的pH梯度:5.0、6.0、7.0、8.0、9.0,然后研究初始pH对酶活的影响。
1.2.4 纤维素酶的纯化和酶学性质 采用考马斯亮兰法测定各部层析液蛋白质含量[17];酶活的测定方法同QB 2583-2003标准;采用PAGE测定酶蛋白的纯度,浓缩胶为4%,分离胶为12%。在最优发酵条件下对M1菌株进行培养,离心获得纤维素酶的粗酶液,使用30%~70%饱和度硫酸铵(ASF)对粗酶液进行分级分离,方法参照文献[18]。获得的经分级分离样品记作ASF。ASF经浓缩、过滤后直接上样于疏水层析柱(Bio-Rad Duo Flow),疏水层析柱为Phenyl Sepharose 6 Fast Flow (2.0 cm×23 cm),每次进样2~3 mL。先用buffer B (1 mol/L (NH4)2SO4)对柱进行平衡,使没有结合在柱子上的杂蛋白与柱分离,将未结合杂蛋白尽量去除,然后用40%~0%硫酸铵(25 mmol/L PBS, pH 7.4)溶液进行梯度洗脱,流速为4 mL/min。等度洗脱使用25 mmol/L PBS buffer 120 mL 以4.0 mL/min的流速冲洗。表现最大酶活力峰收集后,经透析、浓缩后获得的样品记作HIC。HIC样品经透析除盐、超滤管(Milipore Amicon Ultra-15(10 kD))浓缩后,进样于DEAE-Sepharose FF( 2.0 cm×23 cm )柱。进样后用25 mmol/L S buffer (pH 7.2 ) 以3.0 mL/min的流速平衡洗脱,去除未结合蛋白质。然后用60%~100%硫酸铵逐渐上升的浓度进行洗脱,流速为4.5 mL/min。最后以流速为2.0 mL/min的1.0 mol/L (NH4)2SO4进行等梯度洗脱。表现最大酶活力的峰收集起来,样品经透析、冻干浓缩获得的浓缩液记作DEAE。然后进行SDS-PAGE检验。
2 结果与分析
2.1 真菌M1形态学初步鉴定
镰刀菌有性时期分别属于肉座菌科(Hypocreaceae)的赤霉属(Gillerella)、丛赤壳属(Nectria)、丽赤壳属(Calonectria)和小赤壳属(Micronectriella)等。除Gillerellazea极为常见和易培养外,大部分种类在培养基上较少形成子囊壳,而且有些种类至今未发现有性时期,因此在镰刀菌鉴定上主要根据无性时期的形态特征。图1为分离自北大仓白酒大曲的真菌M1菌株经纯培养后接种到固体PAD平板上的菌落形态。从图1可见,在PDA培养基上,菌落为白色,呈絮状突起、质密,由于大量孢子生成而呈粉质,菌落高2~3 mm,与镰刀菌菌落形态一致。

图1 大曲真菌M1菌落形态Fig.1 Characteristics of bacterial colonies from the fungus M1 strain
图2为PDA平板菌落的显微观察结果。图2 A、B、C和D为同一张制片的不同视野下观察的结果。图2A为M1菌株的菌丝形态,图2B为菌株M1小孢子的大小、形状和分布状态,图2C为分生孢子梗和大型分生孢子着生方式和形态,图2D为菌株的厚垣孢子形态。尖孢镰刀菌在自然条件或人工培养条件下可产生小型和大型分生孢子、分生孢子梗和厚垣孢子。如图2B、C、D所示,小型分生孢子无色,单胞,卵圆形、瓜子型等;大型分生孢子无色,多胞,镰刀形,略弯曲,两端细胞稍尖,少许弯曲,有隔;分生孢子梗分枝;厚垣孢子淡黄色,近球形,表面光滑,壁厚,间生、单生或串生,对不良环境具有抵抗力。从形态学观察可以判断菌株M1为镰刀菌属(Fusariumsp.)。

图2 大曲真菌M1的形态学观察结果Fig.2 Characteristics of the fungus M1 strain isolated from Dq of Beidacang spirit under microscopeA:菌丝形态;B:小孢子形态;C:分生孢子梗和大孢子形态;D:厚垣孢子A:Hypha;B:Micoroconidia;C:Conidiophore and Macroconidia;D:chamydospore
2.2 M1菌株产纤维素酶的检验
纤维素酶是一类能够水解纤维素的β-1,4-葡萄糖苷键生成葡萄糖的多组分酶的总称[19]。它是一种复合酶,纤维素彻底降解为葡萄糖至少需要内切葡聚糖酶(endo-β-1,4 -glucanases,EC 3.2.1.4) 、外切葡聚糖酶(exo-β-1,4-glucanases,EC 3.2.1.91) 和β-葡萄糖苷酶( β-1,4-glucosidases,EC 3.2.1.21)3个组分协同作用[20]。内切葡聚糖酶随机切割纤维素多糖链内部的无定型区,产生不同长度的寡糖和新链的末端。外切葡聚糖酶作用于这些还原性和非还原性的纤维素多糖链的末端,释放葡萄糖或纤维二糖。β-葡萄糖苷酶(纤维二糖酶)水解纤维二糖产生两分子的葡萄糖。刚果红(Congo red)本身能与培养基中的纤维素形成红色复合物。当纤维素被纤维素酶分解为寡糖或葡萄糖后,红色复合物无法形成,培养基中出现了以供试菌为中心的透明圈。如图3所示,在刚果红平板上接种的镰刀菌属(Fusariumsp.) M1产生了明显的透明圈,透明圈直径约为2~5 cm,说明菌株M1具有纤维素分解能力。
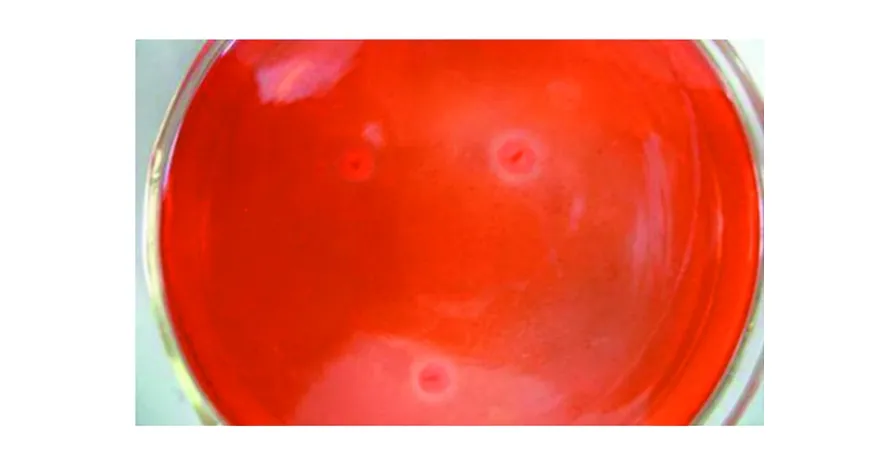
图3 M1菌株的刚果红染色结果Fig.3 Congo red staining of the fungus M1 strain
2.3 真菌M1的rDNA ITS片段PCR扩增
2.3.1 真菌M1的DNA提取 图4为提取到的M1菌株DNA样品在1% agarose凝胶电泳图。DNA Marker为限制性核酸内切酶Hind III 切割λDNA的产物。自上而下片段大小分别为23 130、9 416、6 557、4 361、2 322、2 027、564和125 bp。结果发现,DNA样品在凝胶中清晰可见1条带;2.3 kb以下,条带完整无降解,说明可作为下一步PCR扩增反应的模板。
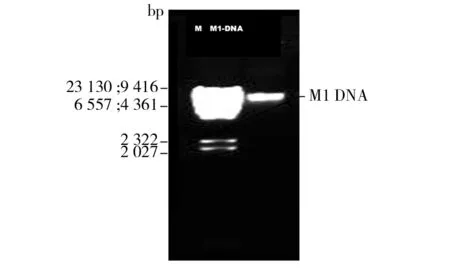
图4 M1的DNA提取后电泳结果Fig.4 Results of electrophoresis from DNA extraction of the fungus M1 isolated from Dq of Beidacang spirit (Agarose 1%)M:-λHind III digest DNA Marker
2.3.2 rDNA ITS片段PCR结果 本研究选用了一对扩增真菌rDNA基因片段的通用引物(TIS1/TIS4)。该引物通过PCR扩增能获得转录间隔区1、5.8S rRNA、转录间隔区2和28S rRNA的基因序列,广泛用于真菌分类的鉴别。如图5所示,使用λ-Hind III digest DNA Marker在1.8%的琼脂糖凝胶下电泳,获得了清晰的电泳图。除Marker外,其他泳道分别为不同管中的PCR产物,分别为P1、P0、P2、P3和P4,其中P0为空白对照(只加入了2 μL 6×PCR loading)。P1、P3样品的加入量均为4 μL,P2、P4样品的加入量均为8 μL。从图5可看出,除对照P0外,其他样品电泳后在Marker的564 bp附近都出现了明亮的条带,在564 bp标准条带偏下出现。各泳道PCR产物未出现其他杂带,扩增出片段符合预期值500 bp左右;且条带清晰、完整、明亮,说明扩增产物品质较好,可进行DNA测序。将PCR反应剩余P1、P2、P3和P4四种样品管用胶带封好,寄送上海生工长春测序分部进行测序。
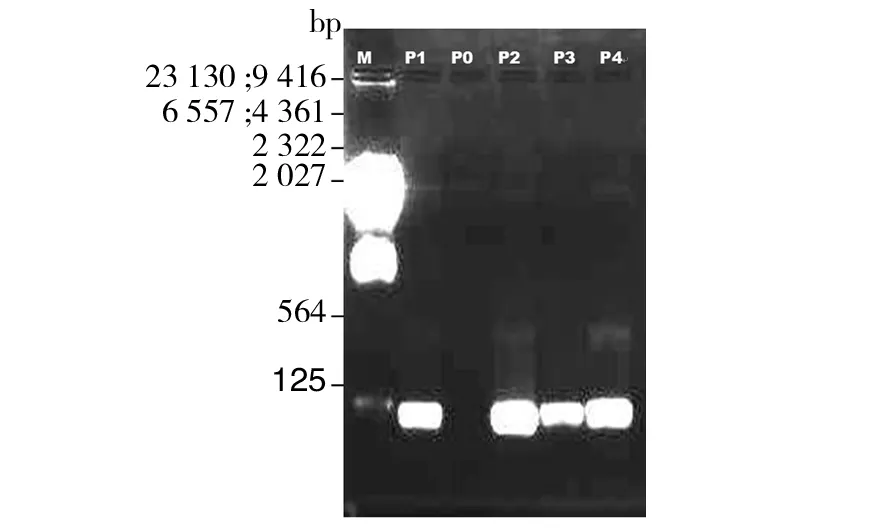
图5 真菌M1 rDNA ITS片段的PCR扩增图谱(1.8% agarose)Fig.5 rDNA ITS profiles of fungus M1(1.8% agarose)
2.4 真菌M1 rDNA ITS序列的Blast比对
2.4.1 rDNA ITS片段PCR产物测序结果 上述4管PCR产物测序结果表明其PCR产物序列一致。使用DNAman分析软件对DNA序列分析,发现该序列大小为506 bp,GC含量占50%。
2.4.2 序列提交NCBI的GenBank进行Blast比对 将真菌M1 rDNA ITS序列提交至NCBI中的GenBank数据库,获得登录号GenBank: KY436001.1。Blast比对分析结果显示,真菌M1的rDNA ITS序列与GenBank 中其他镰刀菌属(Fusarium)菌株序列的相似性高达99%。将相关镰刀菌属代表菌株rDNA序列下载后,使用Mega5.0分析软件,同Fusariumsp. M1的rDNA ITS序列进行Blast比对,采用最大似然法构建聚类分析图(图6)。如图6所示,Fusariumsp. M1(KY436001.1)与Fusariumoxysporimstrain Bt3聚为一类,亲缘关系最近,相似性达99%,与形态学观察结果完全一致。因此,结合形态学实验观察将Fusariumsp. M1确定为尖孢镰刀菌,命名为FusariumoxysporimM1。
2.5 真菌M1产纤维素酶活性分析
2.5.1 M1菌株优化前酶活性的测定结果 采用国标(QB 2583-2003)方法,分别以滤纸和CMC-Na为底物,测定FusariumoxysporimM1菌株的纤维素酶活性,结果见表1。从表1可以看出,镰刀菌FusariumoxysporimM1的滤纸酶活性为181.32

图6 Fusarium sp.M1 rDNA ITS最大似然树分析Fig.6 Maximum likelihood treeanalysis of rDNA ITS for strain Fusarium sp.M1
U/mL,相当于国际单位为16.8 IU/mL;CMCA活性为379.21 U/mL,相当于国际单位为35.25 IU/mL。说明镰刀菌具高纤维素分解能力。结果发现CMCA比FPA高许多,以不同纤维材料为底物测试同一种纤维素酶系并以还原糖的产生作标准时,得到的酶活力值也不同[20]。滤纸是不溶性的,而CMC-Na为可溶性的。张瑞萍等[21]研究发现CMCase比FPA高,说明酶对水溶性底物有较高活力,吸附对酶活性部位与纤维素分子链结合及催化均有影响。陆晨等[22]从森林腐质土壤中分离筛选得到1株高产纤维素酶的真菌B-5,以羧甲基纤维素钠为碳源,蛋白胨为氮源,28 ℃,180 r/min培养5 d,初始酶活FPA 酶活(FPase) 仅为2.09 IU/mL,CMC 酶活(CMCase)为5.20 IU/mL。韩寒冰等[23]研究菌株XA-1纤维素酶活力,发现最高CMCase 和FPA分别为318.44 U/mL和61.35 U/mL。Shang等[2]从土壤和腐烂稻草中分离出FusariumoxysporumF5具高纤维素降解能力,CMCA活力高达19.8 IU/mL。本研究分离的菌株FusariumoxysporimM1纤维素酶活性相对较高。

表1 菌株Fusarium oxysporim M1的纤维素酶活力测定结果Table 1 The results of the cellulose activity assay from Fusarium oxysporim M1 strain
2.5.2 M1菌株优化后酶活性测定结果 不同温度下菌株FusariumoxysporimM1的纤维素酶活力测定结果见表2。从表2可知,与原始的发酵条件(30 ℃)相比,20 ℃时全酶(FPA)和CMCase的活性均低于对照组的酶活,但降低的幅度不大;在35 ℃时,两种酶活性均略高于对照,分别为17.34和36.42 IU/mL;但在45和50 ℃时,酶活性明显降低。因此该纤维素酶的最佳发酵温度应为35 ℃。不同pH下菌株FusariumoxysporimM1的纤维素酶活力测定结果见表3。从表3可知,在自然pH 7.0为对照并以优化温度35 ℃为发酵条件,不同pH(6.0~8.0)范围内,对全酶的活性影响不大,pH 5.0酶活降低,pH 9.0酶活降低明显,最适pH为6.0。结合表2和表3可知,经温度和pH优化,获得最佳纤维素酶活性分别为FPA(17.91 IU/mL)和CMCA-DNS(37.97 IU/mL),酶活性通过优化有所提高。
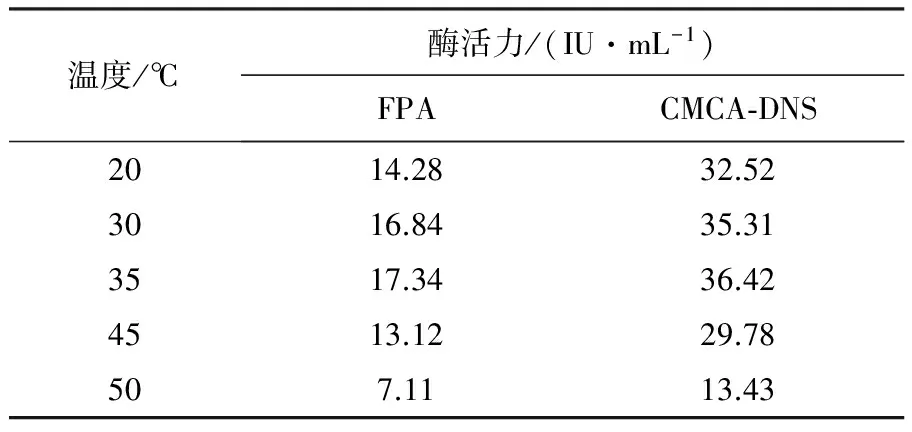
表2 不同温度下菌株Fusarium oxysporim M1的纤维素酶活力测定结果(IU/mL)Table 2 The results of the cellulose activity assay from Fusarium oxysporim M1 strain in different temperature (IU/mL)
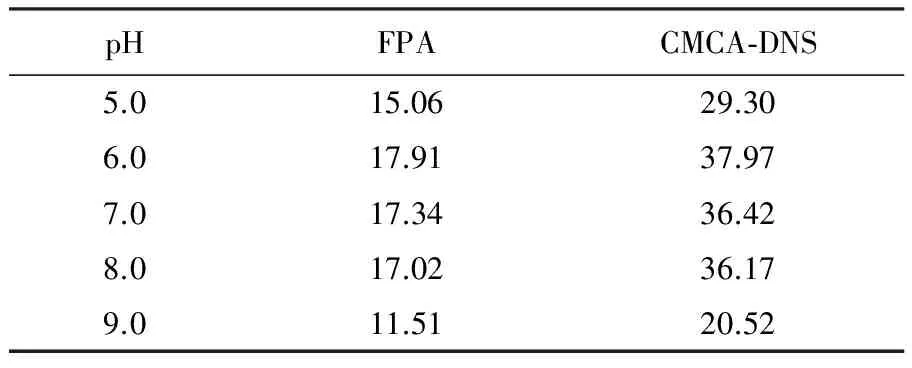
表3 不同pH下菌株Fusarium oxysporim M1的纤维素酶活力测定结果(IU/mL)Table 3 The cellulose activity assay from Fusarium oxysporim M1 strain in different pH values (IU/mL)
2.6 真菌M1产纤维素酶纯化与检验分析
2.6.1 纯化表分析 表4归纳了真菌M1产纤维素酶纯化过程和各个步骤的酶活测试结果,包括比酶活和纯化倍数以及得率等重要的纯化参数。整个纯化包括粗液的制备、硫酸铵分级分离(ASF)、疏水作用层析(HIC)和离子交换层析(DEAE)。从表4可知,粗酶液的酶活力为37.97 IU/mL(MCA-DNS),经过各步骤纯化后酶活性达到69.79 IU/mL。最后一步(离子交换)酶被纯化了17.7倍,得率为3.76%。说明纯化方法比较合理。从整个纯化方案上看,经过硫酸铵分级分离,酶液体积大大缩小,便于后续的层析操作;同时获得的样品可直接进样疏水层析,无须经过透析,可节省大量时间。整个操作过程始终处于0 ℃,保证了酶的稳定性和活力,也增加了酶的纯化倍数。

表4 菌株M1产纤维素酶的纯化表Table 4 Purification of cellulase from Fusarium oxysporim M1 strain
2.6.2 纯酶的电泳分析 图7为2步层析后经透析除盐获得样品的SDS-PAGE电泳图。如图7所示,经过疏水层析,在30 kDa~24 kDa范围内,还有至少3条明显的杂蛋白条带,但经过离子交换层析后这些杂蛋白已经完全去除。在62 kDa~40 kDa之间有一条明显的条带,大小约为60 kDa,说明纯化的纤维素酶的分子量大小为60 kDa左右。纤维素酶是多组分的酶系,整个纤维素降解是内切酶、外切酶和β-葡萄糖苷酶协调作用实现的。上述纤维素酶纯化方案是以羧甲基纤维素钠为直接作用的底物催化而设计的,因此纯化的纤维素酶的具体酶学特性以及高效催化机制有待研究。

图7 菌株M1纤维素酶纯化的SDS-PAGE电泳分析Fig.7 SDS-PAGE of Cellulase purified from Fusarium sp.M1
3 讨 论
本研究从北大仓白酒大曲分离鉴定了1株高产纤维素酶的真菌,通过rDNA ITS序列分析并结合形态学鉴定该菌为尖孢镰刀菌(FusariumoxysporimM1),不仅证明了镰刀菌的分子生物学鉴定的可靠性,丰富了北大仓白酒大曲的微生物多态性,同时也为高产纤维素酶的镰刀菌菌种资源的开发、利用提供参考。酶的纯化研究是研究镰刀菌产纤维素酶其他机制的基础。对纯酶的研究避免了细胞环境条件的影响,为进一步研究这种高效分解纤维素酶的作用机理以及酶结构和功能提供了数据。本研究也为今后从镰刀菌纤维素酶基因和蛋白质工程角度出发,构建产纤维素酶高产工程菌株,使镰刀菌资源更广泛地应用于生物转化和环境保护领域提供参考。
参考文献:
[1] Olajuyigbe FM, Nlekerem CM, Ogunyewo OA. Biodegradation of Methyl Cellulose byFusariumoxysporum[J]. Biochemistry Research International, 2016,(1):3978124.
[2] Shang TT, LI QT, Shanggui DENG.Screening and Isolation of Highly Efficient Cellulose-degrading Microorganisms andConstruction of Complex Microbial System[J].Agricultural Science & Technology, 2015, 16(4): 639-644, 652.
[3] 常鑫园,谢占玲,张凤梅,等.镰刀菌 Q7-31T 内切葡聚糖酶 Egn21 的分离纯化及酶学性质[J].微生物学报,2017, 57(1):33-42.
[4] 李文强,吴菲菲,李化强,等.金属离子对尖孢镰刀菌发酵液中果胶酶活性的影响[J].邵阳学院学报(自然科学版),2015,12(4):50-56.
[5] 赵联正,谢占玲 赵朋,等.一种新的镰刀菌Q7-31木聚糖酶Xyn9的分离纯化鉴定及酶学特性[J].江苏农业科学,2015,43(5):42-45.
[6] Sara G, Payne AM, Martin S, et al. Structural and functional characterization of a highly stable endo-β-1,4-xylanase fromFusariumoxysporumand its development as an efficient immobilized biocatalyst[J]. Biotechnology for Biofuels, 2016, 9(1):191.
[7] 代文亮,陶文沂,程龙.紫杉醇产生菌美丽镰刀霉K178的诱变育种[J].中国医药工业杂志,2008,39(4):251-257.
[8] 邓立新,舒正玉,夏晓峰,等.环孢菌素A产生菌的分子鉴定及其原生质体制备[J].福建师范大学学报(自然科学版),2008,24(2):63-79.
[9] 生措,任杰,王敏,等.不对称还原α-氨基苯乙酮菌种的筛选及转化条件优化[J].应用与环境生物学报,2012,18(2):281-286.
[10] 谯建军,田萍,姚秉华,等.染料结晶紫降解菌分离及其特性研究[J].环境污染治理技术与设备,2006,2(7):62-65.
[11] 蔡伟建,潘俊雅,李济吾.镰刀菌(Fusariumsp.) 对 2,4,6-三氯苯酚的降解特性及其机制[J]. 环境科学学报,2016,36(9):1387-1392.
[12] 郑平.环境微生物学实验指导[M].杭州:浙江大学出版社,2005.
[13] 张向民. 镰刀菌属分类学研究历史与现状[J].菌物研究,2005,3(2):59- 62 .
[14] Visentin I, Tamietti G, Valentino D, et al. The ITS region as a taxonomic discriminator betweenFusariumverticillioidesandFusariumproliferatum[J]. Mycological Reseach, 2009, 113(10): 1137-1145.
[15] 孙勇,缪倩,孙颖,等.6 种植物中内生镰刀菌的分离和鉴定[J].江苏农业科学,2010,(5):437-439.
[16] 王世伟,董原,李铁,等.一种适合抗癌药紫杉醇产生菌AFLP分析的DNA提取方法[J].高师理科学刊,2006,26(1):60-64.
[17] 牛青霞,申济奎.微量考马斯亮蓝法测定蛋白质含量[J].中国医学检验杂志,2001,2(5):345-347.
[18] 郑金花,郁建平.镰刀菌发酵培养液中纤维素酶的分离纯化[J].化学与生物工程,2010,27(12):65-68.
[19] 池雅琴,黄奎.纤维素酶活力测定方法研究进展[J].现代农业科技,2010,2010(24):32-34.
[20] 余兴莲,王丽,徐伟民.纤维素酶降解纤维素机理的研究进展[J].宁波大学学报(理工版),2007,20(1):78-82.
[21] 张瑞萍.纤维素酶活力测定方法[J].印染, 2002, 28(8):38-39.
[22] 陆晨,陈介南,王义强,等.一株产纤维素酶真菌的筛选及产酶条件优化[J].中南林业科技大学学报,2012,32(6):118-122.
[23] 韩寒冰,程水明,刘杰凤.一株产纤维素酶镰刀菌的筛选、鉴定与酶学性质[J].现代化工,2014,34(7):61-65.

