秸秆降解放线菌GC的筛选及其应用基础研究
史 彬, 黄魏魏, 付丹妮, 董祥洲, 任立伟, 朱启法, 刘永民*
(1.辽宁石油化工大学 化学化工与环境学部,辽宁 抚顺 113001; 2.安徽皖南烟叶责任有限公司,安徽 宣城 242000;3.清华大学 化学工程系,北京 100084)
秸秆是仅次于石油、煤炭、天然气的第四大能源,也是其中唯一的可再生资源。我国年产秸秆6~8亿 t,占世界总量的20%~30%[1-2],但目前大部分秸秆仍被直接遗弃或田间焚烧,造成严重的资源浪费和环境污染[3-4]。如能将秸秆进行适当处理,进而转化为工业原料[5-7]或生物燃料[8-9],不仅可以解决现有问题,还有望节约大量资源,极大地促进化工生产与环境保护之间的平衡。相比于传统的物理[10-12]和化学方法[13-15],生物法处理秸秆因操作简单、成本较低、无二次污染等优点,受到国内外学者的广泛关注[16]。放线菌是自然界木质纤维素的主要分解者之一[17],且兼具丝状真菌对秸秆的瓦解破坏能力和细菌繁殖适应性强等特性[18],但目前文献报道的秸秆降解微生物仍以真菌、细菌及多菌种协同作用为主[19-21],极少涉及放线菌。此外,放线菌已广泛应用于抗生素、酶制剂、维生素和有机酸的生产,以及甾体转化、烃类发酵、废水处理等诸多方面[22-23],对化工生产具有重要意义。 本研究运用循环流化技术,从土壤样品中筛选出1株高效秸秆降解放线菌(命名为GC)。经鉴定菌株GC为左式链霉菌,可在LB等基础培养基中快速繁殖,并具有高产纤维素酶和降解木质素的能力,采用GC单菌种处理小麦秸秆即可达到较为理想的降解效果。经初步研究,除分泌纤维素酶和木质素酶外,菌株GC可将秸秆转化为多种石油烃、有机醇及植物甾醇。本研究为秸秆等农业面源污染物的资源化利用提供参考。
1 材料与方法
1.1 材料
1.1.1 供试土壤与秸秆 河北保定腐烂发黑秸秆和田间土壤。
1.1.2 培养基(g/L) 无机盐液体培养基:(NH4)2SO41.0,KH2PO40.5,K2HPO40.5,MgSO4·7H2O 0.2;纤维素液体培养基:CMC-Na 10.0,NH4Cl 2.0,KH2PO44.0,MgSO4·7H2O 0.3,CaCl2·2H2O 0.3,蛋白胨 3.0,酵母粉 0.5,吐温-80 0.2;木质素液体培养基:MgSO4·7H2O 0.5,CaCl20.2,Na2HPO42.0,NaH2PO41.0,玉米粉20.0,大豆蛋白胨 20.0;LB液体培养基:蛋白胨 10.0,酵母粉 5.0,NaCl 10.0。高氏一号液体培养基:可溶性淀粉 20.0,KNO31.0,K2HPO40.5,MgSO4·7H2O 0.5,FeSO4·7H2O 0.01;无机盐固体培养基:在无机盐液体培养基的基础上添加1%粉碎后的新鲜小麦秸秆和2%的琼脂。培养基所用试剂均为分析纯。
1.2 方法
1.2.1 菌株筛选与鉴定 运用循环流化法筛选目标菌株[24],将50 g部分自然腐烂小麦秸秆和200 g土壤放入流化床中,环流液为灭菌后的无机盐液体培养基(2 L)。气泵持续向流化床注入新鲜空气,在蠕动泵的作用下环流液自下而上通过流化床并持续循环,调节气泵和蠕动泵转速使秸秆和土壤处于悬浮状态。每2 d取5 mL环流液稀释至10-2、10-4、10-6和10-8浓度,分别涂布于以小麦秸秆为唯一碳源的无机盐固体培养基,初步判断菌株是否具有秸秆降解能力。将长出的菌落分别在LB、PDA或高氏一号固体培养基中分离纯化。纯化后的菌株再分别通过刚果红染色法进行复筛[25],选取水解圈与菌落直径比值较大的菌株继续纤维素酶活测定,优选出产酶活力较高的为目标菌株。菌株鉴定由北京三博远志生物技术有限责任公司完成。通过菌落PCR扩增测定细菌的16S rDNA序列,用MEGA 4构建分子进化树,采用Neighbor-Joining法的Complete Deletion 模式建树,用Bootstrap进行检验,并重复1 000次。
1.2.2 菌株生长特性 将菌株GC分别接种到LB和高氏一号液体培养基中,30 ℃、170 r/min振荡培养,定期取样。将样品在4 ℃、5 000 r/min条件下离心10 min,弃上清液,加入去离子水重悬,相同条件离心洗涤3次,保留离心得到的固体,冷冻干燥后称重。
1.2.3 纤维素酶活测定[26]将菌株GC接种到纤维素液体培养基中,30 ℃、170 r/min振荡培养3 d。4 ℃、5 000 r/min离心10 min,取上清液为粗酶液,根据酶活力大小适当稀释1~2倍作为待测酶液。纤维素内切(CMC)酶活和滤纸(FDA)酶活(滤纸酶活即总酶活)在底物CMC-Na(1%)和新华1号滤纸(50 mg)存在下用柠檬酸缓冲液(pH=5)测得。反应在50 ℃下进行30 min或1 h。产生还原糖的量由3,5-二硝基水杨酸(DNS)法测定。酶活单位(U)定义为在标准条件下每分钟水解纤维素释放1 μg葡萄糖所需的酶量 。
1.2.4 木质素酶活测定 将菌株GC接种至木质素液体培养基,发酵3 d后,经离心取上清液为粗酶液。木质素过氧化物酶(Lip)、锰过氧化物酶(MnP)和漆酶(Lac)测试方法参照文献[27-29]。
1.2.5 秸秆降解失重率测定 将菌株GC接种到LB液体培养基中,30 ℃、170 r/min振荡培养3 d。另取50 mL锥形瓶高温烘干称重(W1)。新鲜小麦秸秆研磨成2 mm左右的小段后,60 ℃烘干至恒重。称取1 g左右烘干后的小麦秸秆(精确到0.1 mg,W2),与含0.5%酵母粉的无机盐液体培养基(质量为小麦秸秆质量的7.5倍),一并加至50 mL锥形瓶中。121 ℃灭菌15 min后,接菌组接入GC菌悬液1 mL,空白对照组接入1 mL无菌水,30 ℃固态发酵处理20 d。灭菌后,烘干称重,记为W3,每一条件设两组平行。秸秆失重率(%)= ((W1+W2-W3)/W2)×100%。以接入1 mL无菌水的相同处理样品为空白对照。
1.2.6 秸秆降解特性研究 ①菌体和秸秆表面结构分析:将菌株GC液体培养3 d后离心,弃上清液,用0.1 mol/L PBS洗涤3次,经戊二醛固定、乙醇梯度脱水干燥后,样品喷金,用扫描电镜观察菌体形态。秸秆表面结构分析时,固态发酵处理后的秸秆样品高温灭菌、烘干。以未经处理的新鲜秸秆为空白对照,做相同处理,镀金后进行电镜观察。②秸秆官能团变化分析:将固态发酵处理后的秸秆样品高温灭菌、烘干,以未经处理的新鲜秸秆为空白对照,做相同处理,所得样品粉碎研磨后用红外光谱法(FT-IR)分析[30]。③木质纤维素含量变化分析:将固态发酵处理后的秸秆样品用72%的硫酸溶液洗涤,除去纤维素和半纤维素。不溶性的木质素经过滤、洗涤、烘干后称重,计算剩余的木质素含量。滤液经高效液相色谱(HPLC)分析,计算纤维素和半纤维素含量。以未经处理的新鲜秸秆作为空白对照,进行相同分析[31]。④秸秆降解产物分析:将固态发酵处理后的秸秆样品用正丁醇回流提取,提取液用无水硫酸钠脱水,旋转蒸发浓缩,所得样品经气质联用(GC-MS)分析[32]。
2 结果与分析
2.1 菌株筛选与鉴定
定期取循环流化床液体样品涂布于以小麦秸秆为唯一碳源的无机盐固体培养基,得到40株长势良好的菌株。经固体培养基分离纯化和刚果红染色法复筛,得到透明水解圈与菌落直径比值较大的菌株继续进行纤维素酶活测定,其中菌株GC所产纤维素酶活最高,纤维素内切酶活和滤纸酶活分别可达67.57 U/mL和19.69 U/mL,选取GC为目标菌株。将GC液体培养成熟后,离心洗涤以获得菌体,再经戊二醛固定、乙醇洗脱干燥、样品喷金后,通过扫描电镜(SEM)观察其菌体特征。如图1所示,菌株GC具有典型的放线菌形态特征,菌丝为丝状、钩状或螺旋状,直径小于1 μm。通过16S rDNA测序分析,菌株GC与Streptomycesdrozdowiczii的同源度为99%,初步鉴定为放线菌的左式链霉菌,系统发育树见图2。

图1 菌株GC的SEM图Fig.1 SEM images of the strain GC
2.2 菌株GC生长培养基的对比测试
将菌株GC分别接种于LB和高氏一号液体培养基,定期取样、离心、冻干,测量细胞干重,结果见图3。菌株GC在LB液体培养基中前期生长缓慢,8 h后迅速繁殖,8~10 h时可达到生长速率的最大值,48 h时干重最高可达0.25 g/100 mL,48 h后生长缓慢,并出现干重下降迹象,可能是由于生长条件恶化而发生菌体自溶。菌株GC在高氏一号液体培养基中的生长趋势与在LB液体培养中基本相同,但生长速率更为缓慢,96 h时获得干重的最大值,仅为0.19 g/100 mL。说明LB液体培养基的营养更为丰富,更适于菌株GC的生长,所以后续实验均采用LB培养基。

图2 菌株GC的系统发育树Fig.2 The phylogenetic tree of the strain GC
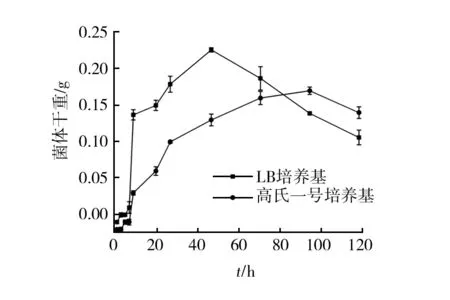
图3 GC的生长曲线Fig.3 Growth curve of strain GC
2.3 菌株GC纤维素酶活和木质素酶活的测定
将菌株GC在纤维素液体培养基中培养,定期取样、离心,取上清液为粗酶液,测量其CMC酶活和FDA酶活,结果见图4。CMC酶活在前10 h增长缓慢,10 h后快速增长,96 h时达到酶活最大值,为67.57 U/mL。 FDA酶活表达速率与CMC酶活类似,前期酶活较低,但后期迅速达到酶活最大值,在24~120 h范围内均稳定在19.69 U/mL左右。对比图3、图4发现,菌株GC前期的纤维素酶活变化曲线与其生长曲线几乎同趋势变化,纤维素酶的产生与菌株生长密切相关,菌株生长产生纤维素酶,该酶又将纤维素降解产生的能量反过来提供给菌株生长。这与尹礎等[33]报道的结果基本一致,体现了菌株GC纤维素酶的产生为生长相关型。
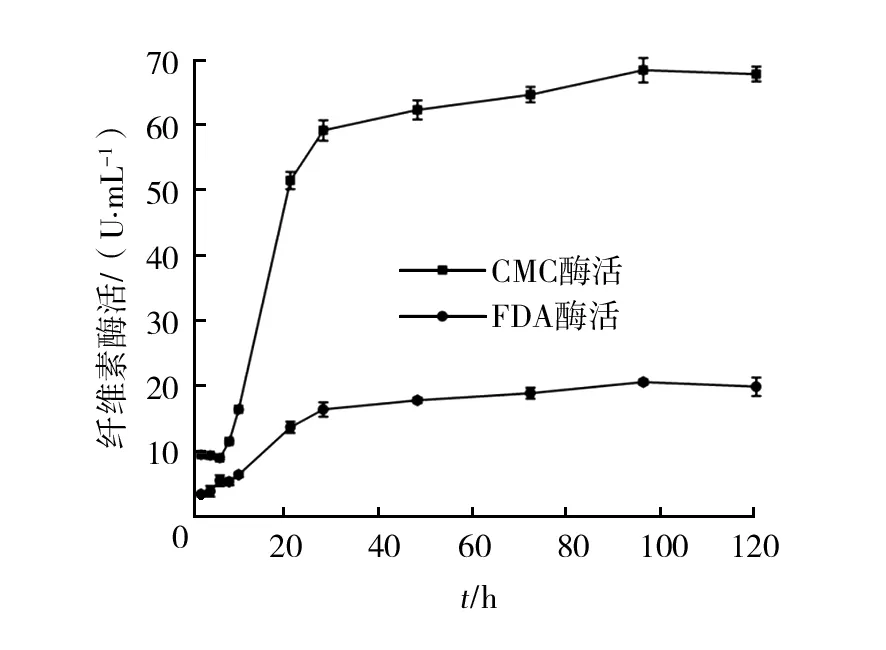
图4 纤维素内切酶活和总酶活Fig.4 Cellulase endonuclease activity and total enzyme activity
木质素的降解至少需要3种酶的参与,即木质素过氧化物酶(Lip)、锰过氧化物酶(MnP)和漆酶(Lac)。将菌株GC在木质素液体培养基中培养,定期取样、离心,取上清液为粗酶液。粗酶液的Lip、MnP和Lac酶活最大值分别为0.042、0.095和0.02 U/mL。说明菌株GC不但能够高效表达纤维素酶,还有一定的木质素降解能力,可单独用于秸秆的生物处理。Lima等[34]报道的Streptomycesdrozdowiczii菌株同样具有一定的纤维素酶活性,但未发现其具有木质素降解能力。
2.4 菌株GC对秸秆降解能力的测定
秸秆样品经固态发酵处理20 d后,高温灭菌、烘干称重,计算得到菌株GC处理后小麦秸秆的失重率为11.52 %,空白对照组的秸秆失重率均小于0.5%,说明菌株GC具有良好的单独处理秸秆能力。将秸秆样品用72%的硫酸溶液洗涤、过滤、烘干,分别将固体称重,滤液经HPLC分析,计算秸秆各组成的含量变化,结果见图5。菌株GC处理后小麦秸秆的纤维素含量由原来的40.16%降至37.56%,半纤维素含量由原来的20.89%降至18.96%。木质素的相对含量则由25.07%上升至27.41%,但绝对质量仍减少了8.2 mg。说明菌株GC在处理秸秆过程中,主要通过所产纤维素酶将纤维素和半纤维素体外水解为葡萄糖,并在菌体内被代谢利用,而对木质素的利用率要低于纤维素。

图5 秸秆处理前后各组分的含量变化Fig.5 The content of each component before and after the treatment of straw
秸秆处理前后的SEM观察结果见图6,其中未经菌株GC处理的秸秆样品(图6a),表面仍较为平滑、结构完整,而经菌株GC处理后秸秆样品(图6b)表面已参差不齐,结构遭到明显破坏。说明菌株GC的木质素利用率虽然相对较低,但对秸秆表面木质素层的瓦解破坏能力在秸秆降解过程中起到十分重要的作用,这也是菌株GC能够单独处理秸秆的重要原因。


图6 未经GC处理秸秆(a)和经GC处理秸秆(b)的SEM图Fig.6 SEM images of GC-untreated straw (a) and GC-treated straw (b)
2.5 菌株GC处理后的秸秆官能团测定
采用FT-IR法分析菌株GC处理前后秸秆表面的官能团变化,结果见图7。其峰位变化主要集中于500~910 cm-1和1 500~3 600 cm-1范围内。3 200~3 600 cm-1处代表羟基的伸缩振动,与醇类或酚类的形成有关。3 381 cm-1处吸收峰向3 386 cm-1处转移,推测秸秆处理过程中可能有醇类物质的形成。1 760~1 690 cm-1的吸收峰由C=O键的伸缩振动产生。1 732 cm-1吸收峰的消失,说明C=O发生重聚反应,形成了一些大分子次级产物。小于910 cm-1区域的吸收峰常与苯环的取代位置有关,667 cm-1处吸收峰由C-H键的弯曲振动产生,Chai等[35]认为该吸收峰的消失,代表长链烷烃的形成。
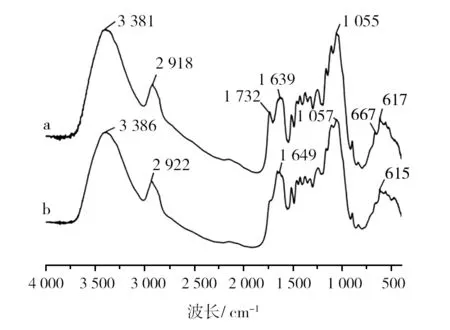
图7 未经GC处理(a)和经GC处理(b)秸秆FT-IR图Fig.7 FT-IR image of GC-untreated (a) and GC-treated straw (b)
2.6 菌株GC降解秸秆的产物测定
秸秆样品经有机溶剂反复抽提,对提取液进行GC-MS分析。由表1可以看出,GC处理后的产物中包含二十二烷(docosane)、二十三烷 (tricosane)、二十四烷(tetracosane)、三十一烷(hentriacontane)等多种石油烃组分,一种有机醇(2-丙基-1-戊醇(2-propyl-1-pentanol)),另外还有菜油甾醇(campesterol)、豆甾醇(stigmasterol)、谷甾醇(sitosterol)等多种植物甾醇,该结果与处理产物的红外分析结果基本一致。上述产物中,既包括石油烃等被认为是不可再生的重要化工能源,还包括2-丙基-1-戊醇等难于合成的化工原料,以及具有较高市场价值的甾醇类保健品。如针对菌株GC的这一特征,对菌株GC发酵培养条件进行深入的优化或对菌株GC进行诱变处理,有望实现基于微生物发酵技术的秸秆等农业面源污染物资源化利用。

表1 秸秆处理产物的GC-MS分析结果Table 1 The analysis results of GC-MS of straw treated products
3 讨 论
利用循环流化方法从土壤样品中分离筛选出1株高产纤维素酶的放线菌GC,经16S rRNA鉴定该菌为左式链霉菌(Streptomycesdrozdowiczii)。菌株GC的纤维素酶活表达速率曲线与其生长曲线几乎同趋势变化,说明菌株GC纤维素酶的产生为生长相关型,并具有一定的木质素降解能力。菌株GC固态处理小麦秸秆20 d后,秸秆的失重率可达11.52%,说明菌株GC具有良好的单独处理小麦秸秆能力。菌株GC处理秸秆产物包含多种石油烃、有机醇和植物甾醇,说明其具有将秸秆等农业面源污染物资源化利用的能力,但要形成具有竞争力的工业生产菌株,仍需要大量的深入研究。
参考文献:
[1] 王久臣,戴林,田宜水,等.中国生物质能产业发展现状及趋势分析[J].农业工程学报,2007,23(9):276-282.
[2] 毕于运,王亚静,高春雨.中国主要秸秆资源数量及其区域分布[J].农机化研究,2010,32(3):1-7.
[3] Anvaru B, Mazza G. Lignin in straw of herbaceous crops[J].Industrial Crops and Products,2008,28(3):237-259.
[4] Park J,Lee Y, Ryu C, et al. Slow pyrolysis of rice straw: analysis of products properties, carbon and energy yields[J].Bioresource Technology,2013,155C(2):63-70.
[5] Tengerdy RP,Szakacs G. Bioconversion of lignocellulose in solid substrate fermentation[J].Biochemical Engineering Journal,2003,13(13):169-179.
[6] Shrestha P, Rasmussen M, Khanal SK, et al. Solid-substrate fermentation of corn fiber by Phanerochaete chrysosporium and subsequent fermentation of Hydrolysate into ethanol[J].Journal of Agricultural and Food Chemistry,2008,56(11):3918-3924.
[7] Rasmussen ML, Shrestha P, Khanal SK,et al. Sequential saccharification of corn fiber and ethanol production by the brown rot fungusGloeophyllumtrabeum[J].Bioresource Technology,2010,101(10):3526-3533.
[8] 顾克军,张斯梅,许博,等.江苏省水稻秸秆资源量及其可收集量估算[J].生态与农村环境学报,2012,28(1):32-36.
[9] 刘鹏,那伟,王秀玲,等. 吉林省主要农作物秸秆资源评论及能源化利用分析[J].吉林农业科学,2010,35(3):58-64.
[10] 刘睿,万楚筠,黄茜,等.秸秆预处理技术存在的问题与发展前景[J].环境科学与技术,2009,32(5):88-91.
[11] Suresh K, Ranjan A, Singh S, et al. Mechanistic investigations in sono-hybrid techniques for rice straw pretreatment[J].Ultrasonics Sonochemistry,2014,21(1):200-207.
[12] Feng L, Li R d, Raninger B, et al. Efficiency of anaerobic digestion of straw pretreated with microwave energy[J].Chinese Journal of Environmental Engineering,2009,3(8):1503-1508.
[13] 孙君社,苏东海,刘莉,等.秸秆生产乙醇预处理关键技术[J].化学进展,2007,19(Z2):1122-1128.
[14] Ibrahim AH. Pretreatment of straw for bioethanol production[J].Energy Procedia,2012,14(14):542-551.
[15] Ma H, Liu WW, Liu P, et al. Enhanced enzymatic saccharification of rice straw by microwave pretreatment[J].Bioresource Technology,2009,100(3):1279-1284.
[16] Scott GM, Akhtar M, Lentz MJ, et al. New technology for papermaking: commercializing biopulping[J].Tappi Journal,1998,81(11):220-225.
[17] Abdulla HM, EI-Shatoury SA. Actinomycetes in rice straw decomposition[J].Waste Management,2007,27(6):850-853.
[18] Walter S, Schrempf H. Physiological Studies of Cellulase (Avicelase) Synthesis in Streptomyces reticuli[J].Applied and Environmental Microbiology,1996,62(3):1065-1069.
[19] Wang HY, Fan BY. Screening of three straw-cellulose degrading microorganism[J].Acta Microbiologica Sinica,2010,50(7):870-875.
[20] Raj A, Chandra R, Reddy MMK. Biodegradation of kraft lignin by a newly isolated bacterial strain, Aneurinibacillus aneurinilyticus from the sludge of a pulp paper mill[J].World Journal of Microbiology and Biotechnology,2007,23(6):793-799.
[21] Chang AJ, Fan JY, Wen XH. Screening of fungi capable of highly selective degradation of lignin in rice straw[J].International Biodeterioration and Biodegradation,2012,72(8):26-30.
[22] Akond MA, Jahan MN, Sultana N, et al. Effect of Temperature, pH and NaCl on the Isolates of Actinomycetes from Straw and Compost Samples from Savar, Dhaka, Bangladesh[J]. American Journal of Microbiology and Immunology,2016,1(2):10-15.
[23] 郑有坤,刘凯,熊子君,等.药用植物内生放线菌多样性及天然活性物质研究进展[J].中草药,2014,45(14):2089-2099.
[24] 韩慧龙,汤晶,江皓,等. 真菌-细菌修复石油污染土壤的协同作用机制研究[J].环境科学,2008,29(1):189-195.
[25] 邹潇潇,易子霆,孙前光,等. 纤维素降解真菌DF14101的筛选与鉴定[J].微生物学杂志,2016,36(6):68-72.
[26] 王义刚,白腐菌预处理促进稻草纤维素酶水解的研究[D].南京:南京林业大学,2013.
[27] Kirk TK, Croan S, Ming T, et al. Production of multiple ligninases byPhanerochaetechrysosporium:effect of selected growth conditions and use of a mutant strain[J].Enzyme and Microbial Technology,1986,8(1):27-32.
[28] Li YZ, Gao PJ, Wang ZN. Separatio nutritional regulation of synthesis of lignin peroxidase byPhanerochaetechrysosporiumME-446[J].Acta Microbiologica Sinica,1994,34(1):29-36.
[29] Arora DS, Gill PK. Effect of various media and supplements on production by some white rot fungi[J].Bioresource Technology,2001,77(1):89-91.
[30] Gasson JR, Forchheim D, Sutter T, et al. Modeling the Lignin Degradation Kinetics in an Ethanol/Formic Acid Solvolysis Approach. Part 1. Kinetic Model Development[J].Industrial and Engineering Chemistry Research,2012,51(32):10595-10606.
[31] 陈贤情,商晋,宋慧芳,等. 中国农业工程学会2011年学术年会论文集[C].北京:中国农业工程学会,2012:1-6.
[32] 李亚红,李术娜,王树香,等. 产芽孢木质素降解菌 MN-8 的筛选及其对木质素的降解[J].中国农业科学,2014,47(2):324-333.
[33] 尹礎,夏乐先,柳建设,等. 一株纤维素降解菌株的分离鉴定及产酶特征研究[J].环境科学与技术,2009,32(3):50-53.
[34] Lima A, Nascimento R, Bon E, et al.Streptomycesdrozdowicziicellulase production using agro-industrial by-products and its potential use in the detergent and textile industries[J].Enzyme and Microbial Technology,2005,37(2):272-277.
[35] Chai L Y, Zhang H, Yang WC, et al. Biodegradation of ferulic acid by a newly isolated strain ofCupriavidussp. B-8[J].Journal of Central South University,2013,20(7):1964-1970.

