枯草芽胞杆菌降解毒死蜱特性研究
陈 琳, 李祖明*, 刘彦霞, 倪 芳, 白志辉, 高丽萍
(1. 北京联合大学 生物化学工程学院,北京 100191;2. 中国科学院 生态环境研究中心, 北京 100085)
枯草芽胞杆菌属于革兰阳性菌[1],呈短杆状,可以运动,没有荚膜[2]。该菌生长快速,不具备致病性,所需营养简单,可产生耐热性高、抗逆性强的芽胞,能在极端的外部环境条件下存活,易于保藏、储存和繁殖,分布广泛,不仅存在于植物体表、根际、土壤等外界环境中,也属于常见的植物内生细菌,发酵作用良好,可分泌多种抗生素和蛋白酶,已成为芽胞杆菌中应用潜力较大的菌种,受到国内外学者普遍关注[3-5]。Zouari等[6]发现枯草芽胞杆菌SPB1可以产生生物表面活性剂;Norgaard等[7]发现枯草芽胞杆菌可以产生氨基酸;Lee等[8]发现枯草芽胞杆菌可以降解组胺;Seenivasan等[9]发现枯草芽胞杆菌可以被用作益生菌促进罗氏沼虾的生长发育和能量利用;宋聪等[10]以枯草芽胞杆菌J18进行冬枣采后黑斑病的防治,浓度为1×108cfu/mL 的菌液对病害的防效为80.67%。枯草芽胞杆菌3728制剂对小麦白粉病、玉米锈病的防治效果接近三唑酮,具有很好的应用开发前景[11]。长期使用化学杀菌剂,会引起病原菌抗药性增强、环境污染和果品农药残留等严重问题[12-13]。毒死蜱即O,O-二乙基-O-(3,5,6-三氯-2-吡啶基)硫代磷酸酯[14],作为一种广谱性杀虫剂,已广泛应用于全球农业中,是中国和美国等国家使用最普遍的一类有机磷农药[15-16]。然而研究发现毒死蜱与神经发育不良、自身免疫紊乱、氧化应激和DNA损伤等有关[17-19],它的大量使用对动植物产生了许多不利的影响,因其产生的食品安全问题已经引起了人们的广泛关注[20]。大量研究证明微生物对土壤和水中的有机磷农药均有很好的降解作用,且不会造成二次污染[21]。微生物降解是解决食品农药残留问题的有效措施之一[22]。对毒死蜱进行微生物降解,因其生态友好性、底物特异性、成本低廉性[23],成为去除食品和地表水中毒死蜱一种可靠有效的方法[15-24]。Harishankar等[25]发现肠道菌群能降解毒死蜱;孟庆林等[26]发现洋葱伯克霍尔德菌能降解毒死蜱,降解率可达69.87%;李珣等[27]发现菌株CJC-3能使毒死蜱的降解率高达76.03%;Liu等[28]发现寡养单孢菌YC-1也能降解毒死蜱。芽胞杆菌也可以用来降解毒死蜱,已报道的芽胞杆菌有蜡样芽胞杆菌[29-30]、侧芽胞杆菌[31]和短小芽胞杆菌[32],但鲜见有关枯草芽胞杆菌降解毒死蜱的文献报告,仅罗鑫等[33]从水稻土壤中分离获得1株降解毒死蜱的枯草芽胞杆菌,未见从蔬菜上分离可降解毒死蜱枯草芽胞杆菌的文献报导。本文研究了1株从油菜叶面分离的枯草芽胞杆菌对毒死蜱的降解特性。
1 材料与方法
1.1 材料
1.1.1 菌株 从油菜叶面上分离筛选出来的枯草芽胞杆菌(Bacillussubtilis)3374菌株,将其编号为GU086422,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号:CGMCC No. 3374。
1.1.2 试剂 毒死蜱乳油,宝灵化工股份有限公司(江苏);毒死蜱标准液,中国计量科学研究院;甲醇(HPLC级)、OCEANPAK等。
1.1.3 培养基 菌种活化培养基、种子培养基、发酵培养基(质量分数,%):胰蛋白胨1,酵母提取物0.5,氯化钠1,pH 6.8 ~ 7.2;菌种保藏培养基再加1.5 ~ 2的琼脂;121 ℃灭菌30 min。
1.2 方法
1.2.1 菌株活化 将冰箱内保存的枯草芽胞杆菌3374菌株划线于固体培养基平板上,30 ℃活化1 d,挑选单菌落进一步纯化,最后再筛选出单菌落保存于斜面固体培养基上。
1.2.2 液体种子制备和发酵 将活化的枯草芽胞杆菌3374菌株依照5%接种量接种于装有种子培养基的三角瓶中,30 ℃、180 r/min培养24 h,得液体种子。按照10%的接种量将液体种子接种到盛有发酵培养基的三角瓶中,30 ℃、180 r/min培养24 h,得到菌体浓度达到109cfu/mL以上的发酵液。
1.2.3 生物量测定 以菌液在波长600 nm所测光密度值OD600表示[34]。
1.2.4 毒死蜱的降解 无菌条件下,配制含有一定浓度毒死蜱的枯草芽胞杆菌3374菌株发酵培养液若干,将枯草芽胞杆菌种子液按照5%接种量接种到该发酵培养液中,即实验组;以未接种发酵培养液为空白组。不同处理组同时置于摇床上震荡培养,每个实验组有3个平行,分别采样测定毒死蜱残留量,考察pH、毒死蜱浓度和温度等不同因素对水溶液中枯草芽胞杆菌3374降解毒死蜱的影响。培养白菜到幼苗期,在白菜幼苗上均匀喷洒240 mg/L毒死蜱后,再喷洒2×107cfu/mL枯草芽胞杆菌3374菌液,以无菌蒸馏水代替菌液作对照,每个实验组有3个平行,在不同时间采样测定毒死蜱残留量。
1.2.5 菌液中毒死蜱提取[26]首先用20 mL二氯甲烷对20 mL菌液进行初提取,再用15 mL的二氯甲烷分两次进行进一步萃取。收集提取液,用氮吹仪吹干溶剂,再用85%甲醇溶液溶解,待测。
1.2.6 白菜上毒死蜱提取[35-36]精确称取15 g匀浆好的试样于50 mL聚乙烯离心管中,加入3 g NaCl、1.5 g无水CH3COONa及15 mL 1%乙酸乙腈溶液,漩涡1 min,5 000 r/min离心10 min。取2 mL上清液转入装有100 mg PSA(N-丙基乙二胺)、100 mg C18(C18烷基-硅胶)、300 mg无水MgSO4和30 mg GCB(石墨化炭黑)的5 mL离心管中,漩涡1 min使其混匀,5 000 r/min离心5 min,上清液过 0.22 μm滤膜,收集于自动进样瓶中,供液相检测。
1.2.7 毒死蜱含量测定 采取液相色谱法[37]。色谱条件:色谱柱为Hypersil ODS柱(250 mm×4.6 mm,5 μm);柱温为室温;流动相为甲醇-水(体积比85∶15)的混合溶液,流速为1 mL/min;紫外检测波长289 nm;进样量为20 μL。HPLC法只针对目标物毒死蜱进行了定量的检测以及绘制标准曲线,标准曲线的R值>0.999,说明该曲线可以用来检测毒死蜱含量。液相色谱法检测毒死蜱标准液所得标准曲线为Y=aX+b,a=16 594.7,b=-837.083,R2=0.999 328 8,R= 0.999 664 3(见图1)。

图1 毒死蜱检测标准曲线Fig.1 Standard curve of detecting chlorpyrifos
1.2.8 降解率计算 计算公式:R(%)=((c0-c1)/c0)×100。其中,R代表菌株对农药的降解率;c1为实验组毒死蜱质量浓度(mg/L);c0为空白组毒死蜱质量浓度(mg/L)。
2 结果与分析
2.1 菌株的生长曲线
将枯草芽胞杆菌3374菌株接种到发酵培养基中培养一段时间,分别在不同培养时间取样测定该发酵液的OD600值,测定该菌株的生长量,结果见图2。

图2 枯草芽胞杆菌生长曲线Fig.2 Growth Curve of Bacillus subtilis
由图2可知,随着培养时间逐渐增加,枯草芽胞杆菌3374菌株在培养基中生物量始终保持上升趋势。培养8 h后进入指数生长期,16 h后增加趋势下降,24 h后生物量趋于稳定,此时枯草芽胞杆菌3374菌株生物量达到相对稳定。故选取培养24 h进行毒死蜱降解实验,考察不同毒死蜱浓度、pH、温度对毒死蜱降解规律的影响。
2.2 pH对生物量和降解率的影响
将枯草芽胞杆菌3374菌株接种到含有480 mg/L毒死蜱不同pH的培养基中,培养24 h后取样测定毒死蜱含量,结果见图3。

图3 pH对枯草芽胞杆菌生物量和毒死蜱降解率的影响Fig.3 Biomass and chlorpyrifos degradation dynamic by Bacillus subtilis 3374 under different initial pH
由图3可知,在pH 5.0~9.0范围内,枯草芽胞杆菌3374菌株生物量增长趋势较平缓。然而枯草芽胞杆菌3374对毒死蜱的降解率随着pH增加呈逐渐下降趋势,尤其在酸性条件下明显优于碱性条件;然而毒死蜱降解率较高,均高于85%。可见,pH对枯草芽胞杆菌3374的生物量和毒死蜱降解率的影响并不呈正相关,可能是菌体生长与菌体中对毒死蜱起降解作用酶的活性受pH变化而变化,而且这两因素所受到pH的影响不完全相同及吻合而导致的。考虑到菌剂在实际应用中常采用中性条件,而酸性条件可能会影响植物的正常生长,对毒死蜱在白菜上降解规律的研究带来不便,故选取pH 7.0作为适宜pH。
2.3 毒死蜱浓度对生物量和降解率的影响
将枯草芽胞杆菌3374菌株接种到含不同浓度毒死蜱的培养基中,培养24 h后取样测定毒死蜱含量,结果见图4。
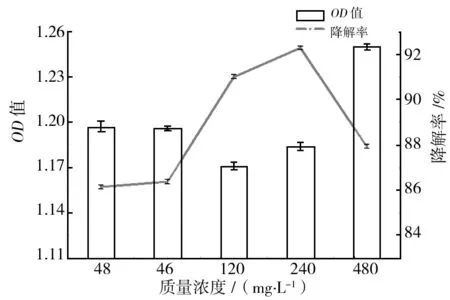
图4 初始浓度对枯草芽胞杆菌生物量和毒死蜱降解率的影响Fig.4 Biomass and chlorpyrifos degradation dynamic by Bacillus subtilis 3374 under different initial concentration
由图4可知,枯草芽胞杆菌3374菌株生物量在不同毒死蜱浓度下有差别。随着毒死蜱浓度的增加,枯草芽胞杆菌3374菌株生物量呈先下降再上升趋势;在毒死蜱质量浓度为120 mg/L时,生物量最低;然后又逐步上升。随着毒死蜱浓度的增加,枯草芽胞杆菌3374菌株对毒死蜱的降解率呈与生物量相反的趋势,降解率逐步升高,在毒死蜱质量浓度为240 mg/L时降解率达到最高,其后下降。在毒死蜱浓度为48 mg/L时,尽管降解率最低,但依旧高于80%,说明枯草芽胞杆菌3374菌株对高浓度毒死蜱依旧具有较高降解能力,所以研究该菌株对高浓度毒死蜱的果蔬残留及废水处理具有十分重要的意义。
2.4 培养温度对生物量和降解率的影响
将枯草芽胞杆菌3374菌株接种到含有240 mg/L毒死蜱的培养基中,培养24 h后取样测定毒死蜱含量,结果见图5。由图5可知,不同培养温度下枯草芽胞杆菌3374菌株生物量不同。随着培养温度上升,枯草芽胞杆菌3374菌株生物量呈先升高再下降趋势;温度为30 ℃时,生物量达到最高;其后又逐渐降低。培养温度对降解率的影响趋势与其对生物量的影响相似,降解率随着温度的升高先增加,在30 ℃达到最高,之后又逐渐下降。可能是因为培养温度通过影响枯草芽胞杆菌生物量来影响其对毒死蜱的降解。可见,枯草芽胞杆菌3374菌株在20~40 ℃均有较高的降解力,均高于80%,能够有效地用于对毒死蜱农药降解过程。

图5 温度对枯草芽胞杆菌生物量和毒死蜱降解率的影响Fig.5 Biomass and chlorpyrifos degradation dynamic by Bacillus subtilis 3374 under different temperature
2.5 枯草芽胞杆菌降解白菜叶面上残留毒死蜱的特性
为验证枯草芽胞杆菌3374菌株在实际应用中是否还能发挥高效降解毒死蜱的作用,本研究在白菜幼苗上均匀喷洒240 mg/L毒死蜱后,再喷洒2×107cfu/mL枯草芽胞杆菌菌液,以无菌蒸馏水代替菌液作对照,不同时间采样测定毒死蜱残留量,结果见图6。
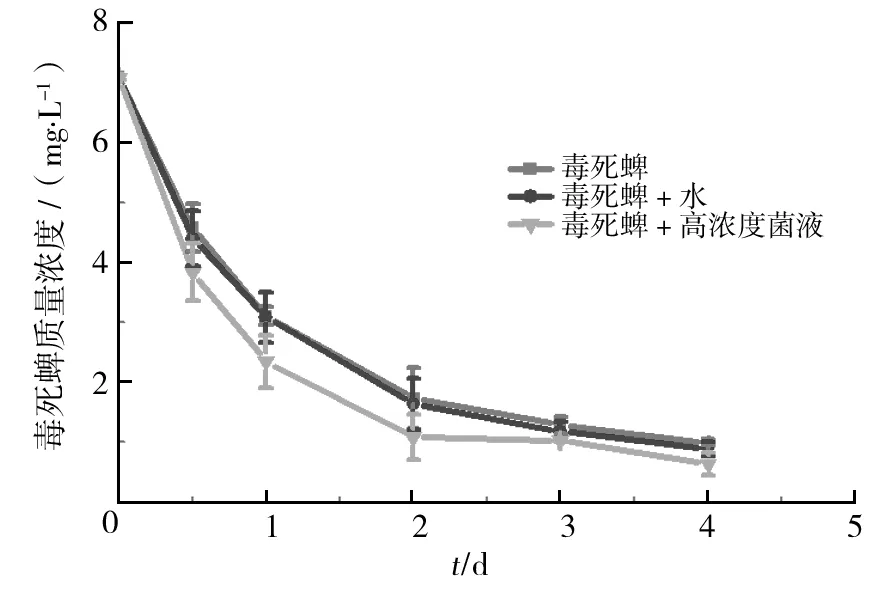
图6 枯草芽胞杆菌降解白菜毒死蜱特性Fig.6 Degradation dynamic of chlorpyrifos by Bacillus subtilis 3374 onto chinese cabbage
由图6可知,白菜表面残留的毒死蜱在实验初期降解速度比较快,随着时间延长,降解速度逐渐趋于平缓。毒死蜱+水处理组相较于毒死蜱处理组,降解曲线几乎重合;而毒死蜱+高浓度菌液处理组相较于毒死蜱处理组,降解曲线下降比较明显,2 d后毒死蜱残留即可达国家安全标准1 mg/L,该组对毒死蜱的降解效果明显优于其他两组;说明一定浓度的枯草芽胞杆菌3374菌液喷施到白菜上能加快残留毒死蜱的降解。可见,枯草芽胞杆菌3374菌株在白菜上具有有效提高毒死蜱降解的能力。
3 讨 论
近年来,毒死蜱作为一种中等毒性的广谱杀虫剂,已成为替代敌敌畏、甲胺磷等高等毒性有机磷农药的最佳选择之一[38-39]。毒死蜱的微生物降解可有效解决毒死蜱残留问题,我们现已分离筛选出多种降解毒死蜱的菌株。本研究从油菜叶际筛选出1株枯草芽胞杆菌3374菌株,通过控制不同的条件,揭示了该菌株在水溶液中对毒死蜱的降解规律,结果表明在毒死蜱质量浓度为240 mg/L、pH 7.0、温度30 ℃的较优条件下,枯草芽胞杆菌3374菌株对毒死蜱的降解率达到92.48%,说明该菌株在水溶液中具有高效降解毒死蜱能力。同时将该菌株以及一定浓度的毒死蜱喷施到白菜上,分析白菜上毒死蜱残留的降解速度,结果表明枯草芽胞杆菌3374能够有效提高白菜叶面上毒死蜱残留的降解速度,说明其在白菜上具有有效降解毒死蜱的能力,显示出其在无公害农产品生产中具有广阔的应用潜力。
参考文献:
[1] Van Dij J, Hecker M.Bacillussubtilis: from soil bacterium to super-secreting cell factory[J]. Microb. Cell Factories, 2013, 12(2):1-6.
[2] 陈尚智, 胡勇有. 枯草芽胞杆菌对微污染水体的净化作用[J]. 环境科学学报, 2011,31(8): 1594-1601.
[3] 赵新林, 赵思峰. 枯草芽胞杆菌对植物病害生物防治的作用机理[J]. 湖南农业学报, 2011, 50(15): 3025-3028.
[4] 王晓阁. 枯草芽胞杆菌研究进展与展望[J]. 中山大学研究生学刊, 2012, 33(3): 14-23.
[5] 李春凤, 林显华, 谷巍. 枯草芽胞杆菌在饲料生产及环境防治中的应用[J]. 中国饲料, 2013,(1):10-17.
[6] Zouari R, Ellouze-Chaabouni S, Ghribi-Aydi D. Optimization ofBacillussubtilisSPB1 biosurfactant production under solid-state fermentation using by-products of a traditional olive mill factory[J]. Achievements in the Life Sciences,2014, 8(2):162-169.
[7] Nφrgaard JV, Canibe N, Nielsen B, et al. First studies on a new concept for amino acid provision throughB.subtilisin situ valine production in young pigs[J]. Livestock Science,2012, 147(1-3): 33-39.
[8] Lee YC, Lin CS, Liu FL, et al. Degradation of histamine byBacilluspolymyxaisolated from salted fish products[J]. Journal of Food and Drug Analysis,2015, 23(4): 836-844.
[9] Seenivasan C, Radhakrishnan S, Muralisankar T, et al.Bacillussubtilison survival, growth,biochemical constituents and energy utilization of the freshwater prawn.Macrobrachiumrosenbergiipost larvae[J]. Egyptian Journal of Aquatic Research,2012, 38(3): 195-203.
[10] 宋聪, 黄亚丽, 谢晨星, 等. 河北省冬枣黑斑病病原菌的分离鉴定及生物防治初探[J]. 微生物学杂志, 2016, 36(5): 85-89.
[11] 胡江春, 王楠, 潘华奇, 等. 海洋微生物抗菌脂肽及新生物农药研发[J]. 微生物学杂志, 2013, 33(6): 1-5.
[12] 邓振山, 陈苗, 张伟民, 等. 苹果树内生真菌抗腐烂病和炭疽病活性菌株的筛选[J]. 微生物学杂志, 2015, 35(5): 61-66.
[13] 张亚, 王凌宇, 刘双清, 等. 湖南省草莓灰霉病的发生与防治[J].微生物学杂志, 2015, 35(1): 79-84.
[14] Liu J, Tan LM, Wang J. Complete biodegradation of chlorpyrifos by engineeredPseudomonasputidacells expressing surface-immobilized laccases[J]. Chemosphere,2016,157: 200-207.
[15] Chishti Z, Hussain S, Arshad KR, et al. Microbial degradation of chlorpyrifos in liquid media and soil[J]. Journal of Environmental Management,2013,114:372-380.
[16] Fu Y, Liu FF, Zhao CL, et al. Distribution of chlorpyrifos in rice paddy environment and its potential dietary risk[J]. Journal of Environmental Sciences,2015,35:101-107.
[17] Ostwal P, Dabadghao VS, Sharma SK, et al. Chlorpyrifos toxicity causing delayed myeloneuropathy[J]. Ann.Indian Acad. Neurol,2013,16 (4):736.
[18] Rauh V, Arunajadai S, Horton M, et al. Seven-year neurodevelopmental scores and prenatal exposure to chlorpyrifos, a common agricultural Pesticide[J]. Environmental Health Perspectives,2011,119 (8): 1196-1201.
[19] Khalil AM. Toxicological effects and oxidative stress responses in fresh waters nail, Laniste scarinatus, following exposure to chlorpyrifos[J]. Ecotoxicol Environ Saf,2015, 116:137-142.
[20] Sotomayor V, Lascano C, deD′Angelo, et al. Developmental and polyamine metabolism alterations inRhinellaarenarumembryos exposed to the organophosphate chlorpyrifos[J]. Environmental Toxicology Chemistry,2012, 31(9): 2052-2058.
[21] 明惠青, 李莉. 甲胺磷降解菌的筛选及降解特性研究[J]. 微生物学杂志, 2006, 26(2): 60-62.
[22] 陈琳, 李祖明. 类球红细菌应用进展[J]. 微生物学杂志, 2016, 36(3): 105-108.
[23] Shen YJ, Lu P, Mei H, et al. Isolation of a methyl parathion-degrading strainStenotrophomonassp. SMSP-1 and cloning of theophc2 gene[J]. Biodegradation, 2010, 21(5): 785-792.
[24] Abraham J, Shanker A, Silambarasan S. Role of Gordonia sp JAAS1 in biodegradation of chlorpyrifos and its hydrolyzing metabolite 3,5,6-trichloro-2-pyridinol[J]. Letters In Applied Microbiology, 2013, 57(6): 510-516.
[25] Harishankar MK, Sasikala C, Ramya M. Efficiency of the intestinal bacteria in the degradation of the toxic pesticide, chlorpyrifos[J]. 3 biotech, 2013, 3(2):137-142.
[26] 孟庆林, 梁金钟, 王风青. 果蔬中残留毒死蜱农药降解菌的选育及鉴定[J]. 食品与发酵工业, 2016,42(4): 108-113.
[27] 李珣, 尚建超, 蓝潇, 等. 毒死蜱降解菌的筛选及降解特性[J]. 江苏农业科学, 2016, 44(9): 479-481.
[28] Liu RH, Jiang H, Xu P, et al. Engineering chlorpyrifos-degradingStenotrophomonassp. YC-1 for heavy metal accumulation and enhancedchlorpyrifos degradation[J]. Biodegradation, 2014, 25(6): 903-910.
[29] Lakshmi CV, Kumar M, Khanna S. Biodegradation of chlorpyrifos in soil by enriched cultures[J]. Current Microbiology, 2009, 58(1):35-38.
[30] 段海明. 一株蜡状芽胞杆菌降解毒死蜱的影响因素研究[J]. 安全与环境学报, 2015, 15(2): 174-177.
[31] 王晓, 楚小强, 虞云龙, 等. 毒死蜱降解菌株BacilluslatersprorusDSP 的降解特性及其功能定位[J]. 土壤学报,2006, 43(4): 648-654.
[32] Anwar S, Liaquat F, Khan QM, et al. Biodegradation of chlorpyrifos and its hydrolysis product3,5,6-tricholoro-2-pyridinol byBacilluspumilusstrain C2A1[J]. J Hazard Mater, 2009, 168 (1): 400-405.
[33] 罗鑫,张海燕,邵彪,等.毒死蜱降解菌的筛选·鉴定·降解特性[J]. 安徽农业科学,2017,45(19):56-57.
[34] 李淑英, 苏亚丽, 周元清, 等.重金属胁迫培养对2种枯草芽胞杆菌生长曲线的影响[J]. 安徽农业科学, 2011, 39(1): 443-446.
[35] 王连珠, 周昱, 陈泳, 等. QuEChERS样品前处理-液相色谱-串联质谱法测定蔬菜中66 种有机磷农药残留量方法评估[J]. 色谱, 2012, 30(2): 146-153.
[36] Cao XL, Liu SH, Yang XQ, et al. A modified QuEChERS sample preparation method for simultaneous determination of 62 pesticide residues in edible fungi using gas chromatography-triple quadrupole mass spectrometry[J]. Food Analytic Methods, 2016, 9:263-274.
[37] 贺江, 龙海波. 分散液相微萃取-高效液相色谱法测定水体中毒死蜱残留[J]. 江苏农业学报, 2015, 31(5):1179-1183.
[38] Jing Ge, Mengxiao Lu, DonglanWang, et al. Dissipation and distribution of chlorpyrifos in selected vegetables through foliage and root uptake[J]. Chemosphere, 2016, 144:201-206.
[39] 李亚楠, 刘晶晶, 陈少华. 毒死蜱的应用现状及降解研究进展[J]. 广东农业科学, 2011, 6(46):92-96.

