中链脂肪酸联合α-亚麻酸对APP/PS1转基因小鼠学习记忆行为及大脑Aβ42、Tau蛋白表达的影响
李 峰,张新胜,徐 庆,张 永,于晓明,刘 鹿,杨雪艳,刘英华,薛长勇空军总医院 营养科,北京 004;解放军总医院 营养科,北京 00853
中链脂肪酸联合α-亚麻酸对APP/PS1转基因小鼠学习记忆行为及大脑Aβ42、Tau蛋白表达的影响
李 峰1,张新胜2,徐 庆2,张 永2,于晓明2,刘 鹿2,杨雪艳2,刘英华2,薛长勇21空军总医院 营养科,北京 100142;2解放军总医院 营养科,北京 100853
目的 探讨中链脂肪酸(medium-chain fatty acid,MCFA)和α-亚麻酸(α-linolenic acid,ALA)对APP/PS1转基因小鼠学习记忆功能及大脑Aβ42、Tau蛋白表达的影响。方法 将25只4周龄APP/PS1转基因小鼠随机分为ALA+MCFA组(8只)、MCFA组(9只)和长链脂肪酸(long chain fatty acid,LCFA)组(8只,对照组),同窝野生型小鼠为WT组(10只,正常对照组)。各组小鼠用不同脂肪酸配制饲料连续喂养至36周龄,用Morris水迷宫进行定位航行实验和空间探索实验,并记录平均逃避潜伏期、平台穿越次数和平台象限滞留时间百分比。免疫组化法检测海马Aβ沉积,Western blot方法检测APP、Aβ42蛋白及Tau蛋白表达。结果 与LCFA组小鼠相比,ALA+MCFA组和MCFA组小鼠水迷宫定位航行试验平均逃避潜伏期明显缩短(P<0.05),空间探索试验平台穿越次数则明显较高(P<0.05),海马组织Aβ斑块数目相对较少,且皮质和海马Aβ42蛋白及Tau蛋白表达均较低(P<0.05)。结论 与LCFA相比,ALA和MCFA能通过减少Aβ42蛋白生成及Tau蛋白磷酸化水平,改善APP/PS1转基因小鼠学习记忆功能,具有潜在的延缓阿尔茨海默病发生和进展的作用。
中链脂肪酸;α-亚麻酸;阿尔茨海默病;APP/PS1转基因AD小鼠;Morris水迷宫
材料和方法
1 实验动物与分组 SPF级12周龄健康雄性APP/PS1转基因小鼠25只(APPSWe.PSEN1d9),实验动物许可证编号SCXK(沪)2017-0010,由上海南方模式生物科技股份有限公司提供,随机分为ALA+MCFA组8只、MCFA组9只、长链脂肪酸(long chain fatty acid,LCFA)组8只,经鉴定后同窝阴性野生型小鼠(不含APP及PS1基因型)10只作为WT组。
2 实验用脂肪酸来源及饲料配方 ALA、MCFA和LCFA均由日清奥利友(中国)投资有限公司提供。在普通大小鼠维持期饲料(AIN-96G)基础上,ALA+MCFA组分别添加5%的ALA和MCFA,MCFA组和LCFA组分别添加10%的MCFA和LCFA(饲料配方见表1)。
3 主要试剂及仪器 Morris水迷宫系统(北京智鼠多宝生物科技有限责任公司)、梅特勒ME104E分析天平,解剖器械,酶标仪(航新ZS-2SWK),台式高速冷冻离心机TGL-16(湘仪公司)等。
4 检测指标 1)Morris水迷宫试验:干预至36周龄时行Morris水迷宫实验[7](Morris water maze,MWM),先行定位航行实验训练,连续4 d,每日以小鼠四个象限的逃避潜伏期均值作为小鼠当日的学习成绩。第5天行空间探索试验,记录小鼠60 s内在平台象限的滞留时间百分比以及穿越目标象限平台的次数。2)小鼠大脑海马和皮质病理:第37周龄时麻醉处死各组小鼠,每组随机取2只小鼠左半脑置于2%多聚甲醛固定24 h后作包埋、切片等处理,采用SP方法进行免疫组化染色。以兔抗APP抗体(ab15272)、Aβ1-42抗体(ab201060)、Tau抗体(ab32057)(1∶200)抗体为一抗,二抗孵育37℃20 min(山羊抗兔超敏二步法PV9001),冷衫胶封片显微镜观察。3)Western blot免疫印迹检测:每组随机各取3只小鼠大脑,小心分离完整的皮质和海马组织(冰上操作),按质量与体积比1∶9加入1×细胞裂解液,常规操作处理后,加入APP抗体(ab15272)、Aβ1-42抗体(ab201060)、Tau抗体(ab32057)4℃过夜,TBST漂洗次3次,10 min/次;加入1∶10 000辣根过氧化物酶标记的二抗室温孵育2 h;ECL发光液显影。

表1 各组小鼠饲料脂肪酸配方Tab. 1 Compositions of diet formulas with different fatty acid for experimental mice
5 统计学分析 所有数据采用SPSS22.0软件进行统计分析,平台穿越次数数据为非正态分布,以中位数(最大值,最小值)表示,四组比较采用Kruskal-Wallis H检验,两两比较采用Bonferroni法;其余实验数据均以-x±s表示,其中定位航行实验数据采用重复测量的方差分析方法,两两比较采用LSD法;其他数据采用单因素方差分析,两两比较采用Dunnett t法(以LCFA组为控制组)。P<0.05为差异有统计学意义。
结 果
1 一般情况 ALA+MCFA及MCFA组小鼠均无异常,LCFA组2只小鼠出现咬伤、皮肤破溃,单笼喂养后1只死亡,另1只小鼠进行性体质量下降;WT组1只小鼠在做水迷宫过程中死亡,相关数据均剔除。
2 ALA、MCFA、LCFA对摄食的影响 在9个月的干预期内,ALA+MCFA、MCFA和LCFA组日均饲料消耗量和能量摄入量均无统计学差异,ALA+MCFA组日均饲料消耗量和能量摄入量则显著高于MCFA组。见表2。
3 ALA、MCFA、LCFA对定位航行试验的影响重复测量设计资料的方差分析显示,连续4 d定位航行试验过程中,4组小鼠的逃避潜伏期均值均不同程度地下降,WT组成绩明显好于其他三组(P<0.05);除了WT组,ALA+MCFA组第2、3、4天的潜伏期均值与另外两组比较都是最低的,且显著小于LCFA组(P<0.05),而在第4天时又明显小于MCFA组,说明其学习能力最好;MCFA组潜伏期均值降低速度较稳定,与LCFA组相比第1、4天时有统计学差异(P<0.05);各组与第1、2天的成绩进行组内比较显示,仅ALA+MCFA组逃避潜伏期均值在第3、4天出现明显下降(P<0.05),也说明该组小鼠学习能力改善最为显著。见表3。
4 ALA、MCFA、LCFA对空间探索试验的影响空间探索试验中,4组小鼠在平台所在象限(第3象限)穿越平台次数的中位数:ALA+MCFA组2.5次,MCFA组2.0次,LCFA组0次,WT组3.0次。ALA+MCFA、MCFA组均高于LCFA组,差异均有统计学意义(P<0.05)。4组小鼠在平台象限滞留时间占总时间(60 s)的百分比:ALA+MCFA组27.54%,MCFA组27.54%,LCFA组17.63%,WT组38.28%;4组中WT组成绩最好,ALA+MCFA组和MCFA组基本相同,LCFA组成绩最差;与LCFA组相比,WT组有统计学差异(P<0.05),ALA+MCFA和MCFA组无统计学差异(P>0.05)(见图1,表4)。从历时5 d的Morris水迷宫试验结果来看,ALA+MCFA组和MCFA组学习记忆功能均优于LCFA组,且小鼠逃避潜伏期均值、在平台所在象限内穿越平台平均次数的差异均有统计学意义,说明ALA和MCFA都能明显提高APP/PSl转基因模型小鼠Morris水迷宫成绩,而添加ALA后效果更佳。定位航行试验和空间探索实验小鼠游泳轨迹见图1。

表2 各组小鼠的平均摄入量Tab. 2 Average diet intakes of each group (-x±s)
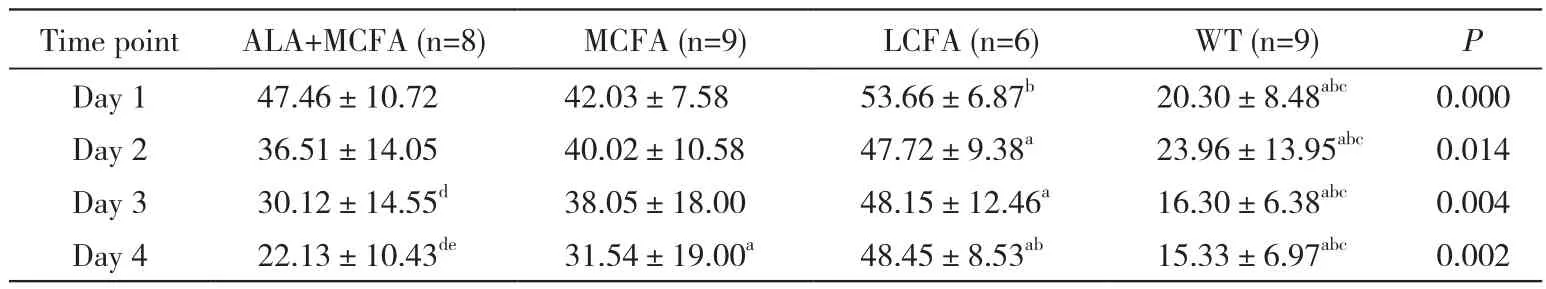
表3 各组小鼠定位航行试验4个象限中逃避潜伏期均值Tab. 3 Four quadrant average escape latencies of mice in place navigation test (s, -x±s)

表4 空间探索试验结果Tab. 4 Results of spatial probe test in each group

表5 各组小鼠海马、皮质组织蛋白表达水平Tab. 5 Protein expression levels of cerebral hippocampus and cortex in each group (-x±s)

图 1 各组小鼠定位航行和空间探索实验游泳轨迹 A:ALA+MCFA; B:MCFA; C:LCFA; D:WTFig. 1 Representative pictures of swimming trails in place navigation test (day 4) and spatial probe test (day 5, no plate)A:ALA+MCFA; B:MCFA; C:LCFA; D:WT
5 Western blot检测结果 Western印迹灰度应用Scion image软件分析后,各项指标与GADPH内参值的面积灰度比值如表5、图2所示,与WT组相比,APP/PS1三组小鼠海马、皮质的Aβ42、APP和Tau蛋白水平均不同程度增加(P<0.05)。与LCFA组相比,ALA+MCFA组和MCFA组海马和皮质Aβ42和Tau蛋白表达量则明显减少(P<0.05),APP水平无统计学差异(P>0.05)。ALA+MCFA组与MCFA组皮质Aβ42、APP和Tau蛋白水平均无统计学差异(P>0.05),海马APP、Tau水平也无统计学差异(P>0.05),但MCFA组Aβ42蛋白表达水平明显较高(P<0.05)。

图 2 Western blot检测小鼠大脑皮质和海马Aβ42、APP和Tau蛋白的表达A:皮质; B:海马; 1: MCFA; 2: ALA+MCFA; 3: LCFA; 4: WTFig. 2 Expression of Aβ42, APP and Tau protein in mice scerebral cortex and hippocampus detected by Western blotA: Cortex; B: hippocampus; 1: MCFA; 2: ALA+ MCFA; 3: LCFA; 4: WT
6 ALA、MCFA等对APP/PS1小鼠脑海马组织Aβ沉积的影响 如图3所示,Aβ沉积呈类圆形棕黄色斑块。与野生对照组相比,AD模型组小鼠脑海马Aβ斑块数量明显增多。与LCFA组相比,ALA+MCFA和MCFA组小鼠脑海马组织CA1、DG区Aβ斑块相对较少。
讨 论
目前,Morris水迷宫实验是研究小鼠学习记忆能力较为成熟可靠的方法[8]。笔者用不同脂肪酸配比饲料干预AD模型小鼠至9月龄时,发现与WT组相比,模型组小鼠反应较迟钝,Morris水迷宫试验成绩普遍较差,Western blot和病理免疫组化结果也显示模型组小鼠出现不同程度AD表现。
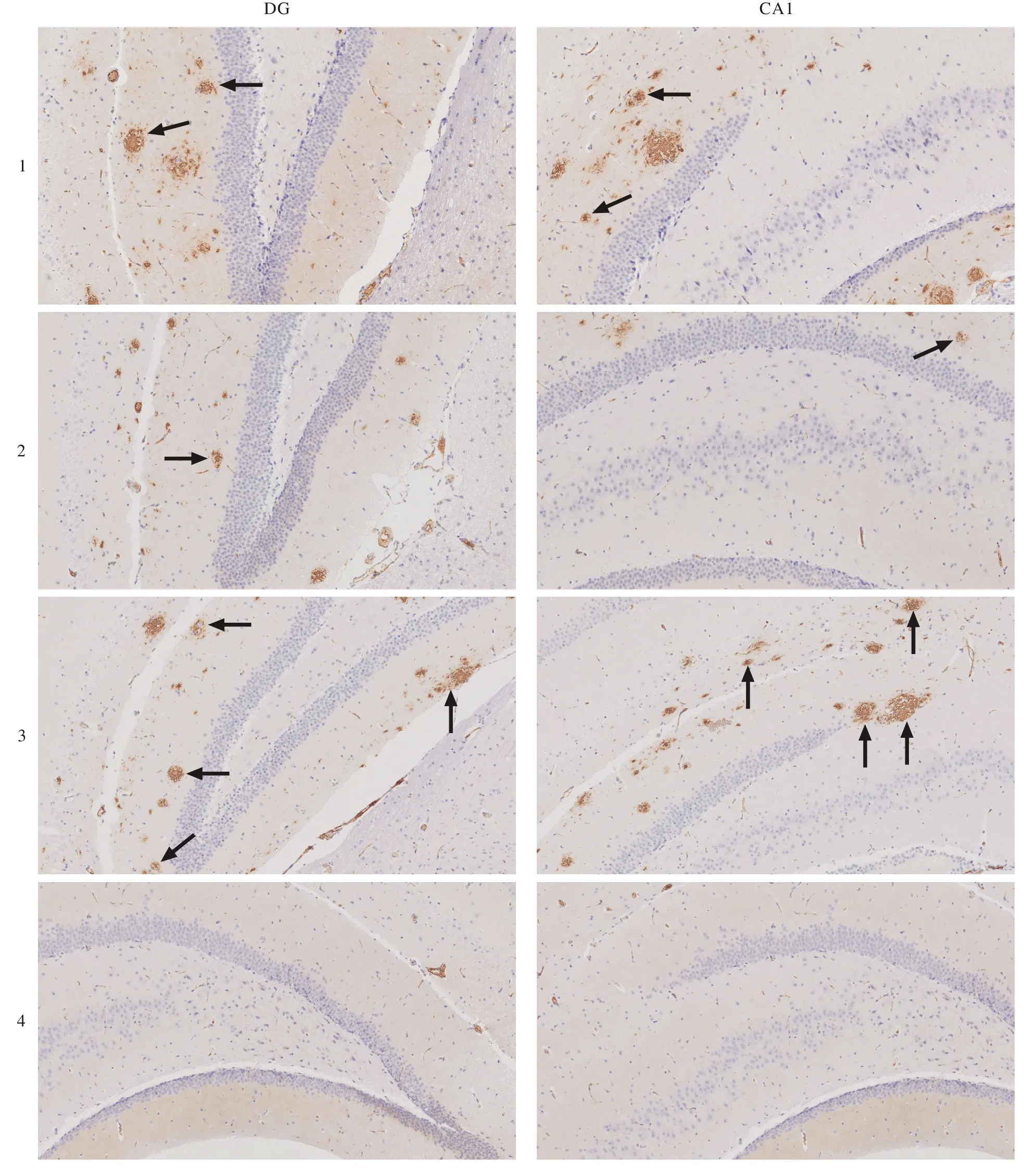
图 3 各组小鼠脑海马DG、CA1区组织Aβ斑块免疫组织化学染色, 放大倍数为10×10; 1:MCFA; 2:ALA+ MCFA; 3:LCFA; 4:WT)Fig. 3 Immunohistochemical staining results of Aβ plaque in cerebral hippocampus DG and CA1 (magnif i cation, 10×10; 1: MCFA; 2:ALA+MCFA; 3: LCFA; 4: WT)
MCFA具有快速被氧化、促进酮体生成等特点。研究指出生酮饮食可以减少AD模型小鼠Aβ42的含量[9],其可能机制是AD患者神经元获取、转运葡萄糖的能力下降,特别是在疾病早期,而酮体被证明是一种优秀的替代性能源[10]。Rebello等[11]通过观察轻度认知功能障碍(mild cognitive impairment,MCI)AD患者也进一步证实,连续24周每天摄入56 g中链三酰甘油(medium chain triglyceride,MCT),可显著提高患者酮体水平并改善记忆力。我们的研究也观察到MCFA具有改善APPswe/PS1DE9双转基因小鼠认知功能的作用。ALA则是所有n-3 PUFAs的前体物质,可在人体内合成二十碳五烯酸(eicosapentaenoic acid,EPA),再经过β氧化作用转换成二十二碳六烯酸(docosahexaenoicacid,DHA),从而发挥与DHA和EPA相似的生理功能[12]。国外有学者比较了AD患者、无症状AD患者和健康成人发现,AD患者大脑中ALA水平明显下降,且AD患者<无症状AD患者<对照组[13]。更有研究证实红细胞膜上的ALA与韩国老人患有轻度老年痴呆的风险有关,补充ALA可以降低痴呆发生的风险[14]。国内学者研究指出,长期ALA治疗可以降低大鼠脑内Aβ的沉积,改善衰老相关性神经病理改变[15]。也有研究证实,ALA可以调节APP加工和Aβ降解过程,从而抑制毒性蛋白Aβ的形成,发挥神经保护作用[16]。Lee等[17]研究指出,ALA确实具有抑制胆固醇摄取和Aβ42细胞毒性的作用,因此具有潜在治疗AD的能力。我们的研究结果也印证了此观点,ALA和MCFA都能明显改善APP/PSl转基因AD模型小鼠Morris水迷宫学习记忆功能和病理情况,从本研究的结果可以看出两者联合作用时效果更佳。
综上,可以认为ALA、MCFA均有改善AD模型小鼠学习记忆能力的作用,其作用机制可能是减少AD模型小鼠Aβ42毒性蛋白的生成与沉积并降低了Tau蛋白的磷酸化水平。鉴于AD发生和进展等病理变化的复杂性,ALA和MCFA对大脑神经元的保护作用以及其改善学习记忆功能的机制还需我们进一步深入研究。
1 Boublay N, Schott AM, Krolak-Salmon P. Neuroimaging correlates of neuropsychiatric symptoms in Alzheimer's disease: a review of 20 years of research[J]. Eur J Neurol, 2016, 23(10): 1500-1509.
2 Chouraki V, Seshadri S. Genetics of Alzheimer's disease[J]. Adv Genet, 2014, 87 : 245-294.
3 Rodriguez-Casado A, Toledano-Díaz A, Toledano A. Defective Insulin Signalling, Mediated by Inflammation, Connects Obesity to Alzheimer Disease; Relevant Pharmacological Therapies and Preventive Dietary Interventions[J]. Curr Alzheimer Res, 2017,14(8): 894-911.
4 Morris MC, Tangney CC. Dietary fat composition and dementia risk[J]. Neurobiol Aging, 2014, 35(Suppl 2): S59-S64.
5 Jankowsky JL, Fadale DJ, Anderson J, et al. Mutant presenilins specifically elevate the levels of the 42 residue beta-amyloid peptide in vivo: evidence for augmentation of a 42-specific gamma secretase[J]. Hum Mol Genet, 2004, 13(2): 159-170.
6 宗园媛, 王晓映, 王海林, 等. APP/PS双转基因阿尔茨海默病小鼠模型的老年斑及行为学动态分析[J]. 中国比较医学杂志,2008, 18(9): 8-12.
7 武海霞, 吴志刚, 刘红彬, 等. Morris水迷宫实验在空间学习记忆研究中的应用[J]. 神经药理学报, 2014, 4(5): 30-35.
8 Van der Auwera I, Wera S, Van Leuven F, et al. A ketogenic diet reduces amyloid beta 40 and 42 in a mouse model of Alzheimer's disease[J]. Nutr Metab (Lond), 2005, 2: 28.
9 Ding F, Yao J, Rettberg JR, et al. Early decline in glucose transport and metabolism precedes shift to ketogenic system in female aging and Alzheimer's mouse brain: implication for bioenergetic intervention[J].PLoS ONE, 2013, 8(11): e79977.
10 Lei E, Vacy K, Boon WC. Fatty acids and their therapeutic potential in neurological disorders[J]. Neurochem Int, 2016, 95 : 75-84.
11 Rebello CJ, Keller JN, Liu AG, et al. Pilot feasibility and safety study examining the effect of medium chain triglyceride supplementation in subjects with mild cognitive impairment: A randomized controlled trial[J]. BBA Clin, 2015, 3 : 123-125.
12 Kim KB, Nam YA, Kim HS, et al. α-Linolenic acid :nutraceutical, pharmacological and toxicological evaluation[J].Food Chem Toxicol, 2014, 70 : 163-178.
13 Snowden SG, Ebshiana AA, Hye A, et al. Association between fatty acid metabolism in the brain and Alzheimer disease neuropathology and cognitive performance : A nontargeted metabolomic study[J].PLoS Med, 2017, 14(3): e1002266.
14 Kim M, Nam JH, Oh DH, et al. Erythrocyte α-linolenic acid is associated with the risk for mild dementia in Korean elderly[J].Nutr Res, 2010, 30(11): 756-761.
15 Gao H, Yan P, Zhang S, et al. Chronic alpha-linolenic acid treatment alleviates age-associated neuropathology: Roles of PERK/eIF2α signaling pathway[J]. Brain Behav Immun, 2016, 57 :314-325.
16 Lee AY, Lee MH, Lee S, et al. Alpha-Linolenic Acid from Perilla frutescens var. japonica Oil Protects Aβ-Induced Cognitive Impairment through Regulation of APP Processing and Aβ Degradation[J]. J Agric Food Chem, 2017, 65(49): 10719-10729.
17 Lee MJ, Park SH, Han JH, et al. The effects of hempseed meal intake and linoleic acid on Drosophila models of neurodegenerative diseases and hypercholesterolemia[J]. Mol Cells, 2011, 31(4):337-342.
Effects of medium-chain fatty acid and α-linolenic acid on learning, memory behavior and expressions of Aβ42, Tau protein in brain in APP/PS1 transgenic mice
Objective To investigate the effects of medium-chain fatty acid (MCFA) and α-linolenic acid (ALA) on learning and memory behavior of APP/PS1 transgenic mice and expression levels of Aβ42 , Tau protein in their brains. Methods Twentyif ve APP/PS1 transgenic mice, aged 4 weeks, were randomly divided into ALA+MCFA group (combined intervention group, n=8),MCFA group (intervention group, n=9) and long chain fatty acid (LCFA) group (control group, n=8) according to their fasting body weight, and another 10 wild type mice (WT) served as normal control group. The mice were fed diets with different fatty acid formulas for 36 weeks. Then Morris water maze was used to perform place navigation test and spatial probe test, meanwhile the average escape latency, time across the platform and time percent during platform quadrant were recorded. Immunohistochemical assay was used to detect Aβ deposition in hippocampus, and the APP, Aβ42 and Tau protein levels were detected by western blot.Results Compared with LCFA group, the average escape latency of Morris water maze place navigation test in ALA+MCFA and MCFA group reduced signi fi cantly (P<0.05), and the time across the platform on probe day was signi fi cantly greater (P<0.05), Aβ plaques in hippocampus were relatively less, and the level of Aβ 42 and Tau protein in cortex and hippocampus were relatively lower (P<0.05). Conclusion ALA and MCFA can improve the learning and memory function of the APP/PS1 transgenic mice by reducing the production of Aβ42 protein and the phosphorylation of Tau protein, therefore they may have the potential to delay the development and progress of Alzheimer's disease.
medium-chain fatty acid;α-linolenic acid; Alzheimer's disease; APP/PS1 transgenic mice; Morris water maze?种以记忆和认知损害为特点的神经退行性疾病[1],其病理表现主要包括β淀粉样蛋白斑块(amyloid plaques,AP)和神经纤维缠结(neurofibrillary tangles,NFT)等[2]。进行性的认知功能损伤给AD患者日常生活造成极大的负面影响,随着我国逐渐进入老龄化社会,AD也成为整个社会沉重的负担,目前AD的治疗仅限于对症治疗,因此前期的预防和干预是缓解AD发生和进展的关键措施[3]。大脑是人体中脂肪含量最多的器官,与各种脂肪酸的关系十分密切,脂类是组成大脑组织干重的主要物质,不同脂肪酸对于脑神经组织和认知功能的影响历来是研究的热点[4]。从美国Jackson实验室引进的APPswe/PS1DE9双转基因小鼠,可表达突变的人类早老素(DeltaE9)和人鼠淀粉样前蛋白(APPswe)融合体[5],是研究AD发病机制、病理学及行为学改变的理想动物模型。9月龄时该模型小鼠老年斑数量体积明显增加,出现与阿尔茨海默病患者相似的老年斑改变[6]。本研究运用Morris水迷宫检测9月龄APP/PS1转基因AD模型小鼠经不同脂肪酸干预后空间学习记忆功能变化情况,并使用Western blot和免疫组化法测定脑内海马和皮质组织β淀粉样蛋白前体蛋白(APP)、β淀粉样蛋白(amyloid-beta protein 42,Aβ42)、Tau蛋白水平,以阐明中链脂肪酸(medium chain fatty acid,MCFA)联合 α-亚麻酸 (α-linolenic acid,ALA)改善APP/PS1转基因AD小鼠脑功能的作用机制,为将来MCFA和ALA应用于AD患者或临床前人群,延缓AD的发生和进展奠定理论基础。
LI Feng1, ZHANG Xinsheng2, XU Qing2, ZHANG Yong2, YU Xiaoming2, LIU Lu2, YANG Xueyan2, LIU Yinghua2, XUE Changyong21Department of Nutrition, Chinese PLA Air Force General Hospital, Beijing 100142, China;2Department of Nutrition, Chinese PLA General Hospital, Beijing 100853, China
Corresponding author: XUE Changyong. Email: cnxcy@163.com; LIU Yinghua. Email: liuyinghua77@163.com
中图分类号:R 749.16
A
2095-5227(2018)06-0523-06
10.3969/j.issn.2095-5227.2018.06.017网络出版时间:2018-04-24 15:07 网络出版地址:http://kns.cnki.net/kcms/detail/10.1117.R.20180424.1507.002.html
2018-01-31
国家自然科学基金项目(81541067)
Supported by the National Natural Science Foundation of China (81541067)作者简介:李峰,男,在读硕士,主治医师。Email: lifengineer@
163.com
薛长勇,男,硕士,主任医师,硕士生导师。Email: cn xcy@163.com;刘英华,女,博士,副主任医师,主任,硕士生导师。
Email: liuyinghua77@ 163.com

