负压创面疗法与常规无菌纱布对感染创面愈合影响的比较
王国旗,唐佩福
解放军总医院 骨科,北京 100853
感染是导致创面难以愈合的重要因素之一[1-4]。由于感染等因素导致的创面难以愈合困扰着相当比例的人群。近年来众多研究相继报道负压创面疗法(negative pressure wound therapy,NPWT)在感染性创面中的应用,发现其可以有效减轻创面感染程度,加速创面愈合[5-9]。课题组前期对负压创面疗法治疗金黄色葡萄球菌感染创面进行了研究,发现其可以减少创面细菌数量、促进创面愈合[10-12]。本研究对负压创面疗法治疗的铜绿假单胞菌感染创面的愈合程度进行定量分析,并与传统无菌纱布治疗进行对比,以探索负压创面疗法治疗感染创面的优势。
材料和方法
1 实验动物 选取巴马香猪18只,购自解放军医学院医学动物中心,体质量15 kg左右,雌性,术前适应性饲养1周。本研究经解放军总医院动物伦理委员会审批。
2 铜绿假单胞菌感染创面的模型建立 常规麻醉、玛贝拉脱毛膏脱毛、消毒,然后在巴马香猪背部建立一个直径50 mm深达肌肉层的软组织创面,去除肌肉腱膜,充分止血后接种0.5 ml(总菌量约为5×107CFU)铜绿假单胞菌菌液,涂抹均匀,半透明膜敷料覆盖24 h,以确保细菌的稳定黏附和定植。
3 分组及处理 半透明膜敷料覆盖24 h后(建模成功,0 d)将巴马香猪随机分为负压创面疗法组和无菌纱布治疗组并分别进行治疗。每天密切观察敷料变化情况,每2 d更换敷料1次。负压创面疗法组敷料购自武汉维斯第公司,对照组纱布为临床常用无菌纱布。整个治疗过程中两组未采用抗生素等其他治疗措施。分别于0 d、4 d、8 d、12 d、16 d定量检测创面大小,充分麻醉后切取创面肌肉组织2块(每4天取材1次),大小约为0.5 cm×0.5 cm×0.5 cm,重量不低于200 mg,取材时注意标记创面侧。用于生长因子表达水平检测的标本保存于-80℃冰箱中,用于组织病理学检测的标本保存于10%中性甲醛溶液中。
4 荧光定量PCR检测VEGF和TGF-β1表达首先提取总RNA,然后将其反转录为cDNA,最后按照荧光定量PCR说明书分别加入相应试剂、引物、提取的总RNA样品等进行PCR反应。荧光定量PCR数据处理方法:变化的倍数(fold change)=2-ΔΔCT;ΔΔCT=(CT靶基因-CT内参)实验组-(CT靶基因-CT内参)对照组。
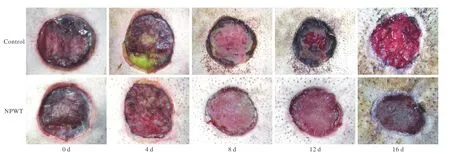
图 1 软组织创面外相 (0 d代表建模成功, 4 d代表治疗的第4天, 后面的以此类推)Fig. 1 Appearance of wounds (0 d represents the successful establishment of model and 4 d means the 4th day of treatment, so on and so forth)
5 免疫组化染色 观察新生毛细血管抗CD31抗体购自英国Abcam公司。首先将标本制作成蜡块,进行组织切片。然后依据说明书经过脱蜡、柠檬酸-柠檬酸钠修复、加胎牛血清、加一抗、过夜、加入二抗、冲洗、终止显色、封片等步骤进行染色。采用Image Pro Plus专业图像分析软件对免疫组化切片进行分析,巴马香猪标本检测参数包括毛细血管面积。其中毛细血管面积检测:在同一标本中随机选取5个视野,应用软件测算每个视野中毛细血管的面积(Area),取平均值。
6 统计学方法 采用SPSS22.0软件进行统计分析。采用两因素重复测量方差分析对各定量指标进行比较,事后检验采用LSD法。P<0.05为差异有统计学意义。
结 果
1 创面外观及覆盖情况 在治疗第4天时对照组创面较为污秽并且存在大量脓样物,实验组尽管存在少量污物,但已经可见肉芽组织生长。治疗第8天,对照组创面可见黑色痂,创面中心可见新生肉芽组织,此时实验组依然可见脓性物质,而且主要集中在创面的边缘,但创面中心明显富含新鲜肉芽组织。治疗第12天,对照组创面黑痂中心发红,而实验组创面新生肉芽组织丰富,肉眼已经看不到脓性物质,创面明显小于对照组。治疗第16天,实验组创面已与周围组织平齐,缺损组织已由肉芽组织填充,已经不再需要负压吸引,创面依然小于对照组(P<0.01)。负压创面疗法组和对照组创面完全愈合时间分别为(18.8±2.0) d和(23.5±2.7) d (P<0.01)。创面愈合情况及直径大小结果见图1和图2。
2 肉芽组织厚度分析 在治疗的第4天显微镜下两组均已出现肉芽组织,而负压创面疗法肉芽组织厚度明显大于对照组(P<0.01)。随着治疗时间的延长,两组创面肉芽组织厚度均逐渐升高,但实验组肉芽组织厚度明显高于对照组(P均<0.01)。肉芽组织厚度示意图及随治疗时间变化见图3。图 2 软组织创面直径大小随治疗时间延长的变化情况(aP<0.01)Fig. 2 Diameter of wounds changes over time (aP<0.01)
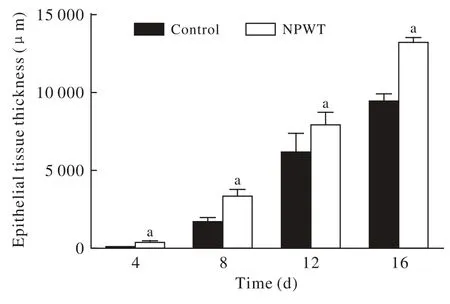
图 3 两组新生肉芽组织厚度比较(aP<0.01, vs对照组)Fig. 3 Comparison of epithelial tissue thickness between two groups(aP<0.01, vs control group)
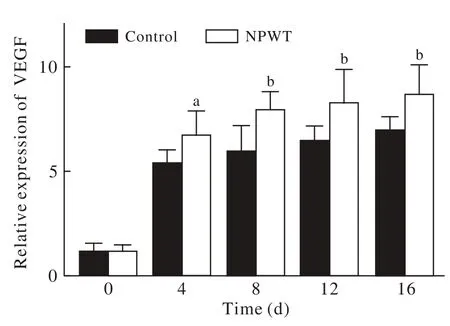
图 4 两组VEGF表达对比(aP<0.05,bP<0.01, vs对照组)Fig. 4 Comparison of expression level of VEGF between two groups(aP<0.05, bP<0.01, vs control group)
3 生长因子表达比较 治疗第4天、第8天、第12天和第16天负压创面疗法组VEGF表达水平均高于对照组(P<0.05),见图4。治疗的第8天、第12天和第16天负压创面疗法组TGF-β1表达水平明显高于对照组(P<0.01)。见图5。
4 新生毛细血管定量分析 以建模前软组织内毛细血管面积为参考(此时血管面默认为“1”),从治疗的第4天开始两组新生毛细血管面积均逐渐增加,在治疗的第4、8、12、16天负压创面疗法血管面积明显大于对照组(P<0.05,P<0.01,P<0.01,P<0.01)。见图6。
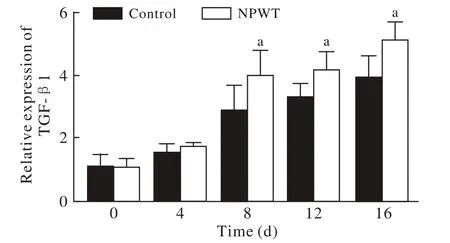
图 5 两组TGF-β1表达水平对比(aP<0.01, vs对照组)Fig. 5 Comparison of expression level of TGF-β1 between two groups (aP<0.01, vs control group)

图 6 两组新生毛细血管面积对比(aP<0.05,bP<0.01, vs对照组)Fig. 6 Comparison of area of newborn capillaries (Fold change,aP<0.05,bP<0.01, vs control group)
讨 论
感染创面的修复过程主要分为3个阶段,即损伤后炎症反应阶段、肉芽组织形成阶段、瘢痕形成阶段。如果某一阶段时间延长,那么整个愈合时间也会延长,如感染持续存在就会导致局部持续性的炎症反应,进而延长这一阶段的时间。要治愈软组织感染,一方面要去除破坏软组织的不利因素,这些因素包括细菌、生物膜、毒素、过度表达的细胞因子等,另一方面要促进创面局部血液供应、形成新鲜肉芽组织给植皮或封闭创面等提供有利条件。临床上实现上述目的通常采用外科清创、局部应用抗菌剂、无菌纱布覆盖等措施[13-15]。但通常情况下外科清创会清除较多的正常软组织以减少创面细菌及生物膜的残留,这种情况可能不利于愈合。因此,这种方法更倾向于首先消灭细菌,之后处理愈合问题。负压创面疗法是处理开放合并软组织感染创面的重要方法之一,目前临床上应用广泛[16-18]。
本研究发现负压创面疗法治疗下铜绿假单胞菌感染创面与对照组相比更清洁,但创面仍有脓性分泌物,直到治疗的第8天仍可见。尽管有感染的存在,负压创面疗法组创面随着治疗时间延长明显缩小,其在治疗的第8天开始明显小于对照组。肉芽组织厚度分析显示,从治疗的第4天开始负压创面疗法组创面新生肉芽组织厚度明显厚于对照组。而两组在治疗的第4天时创面均有脓性物质,对照组相对明显。这说明负压创面疗法治疗时,尽管创面依然存在感染,但已经开始形成新鲜的肉芽组织。这可能得益于负压创面疗法在负压吸引下海绵孔对创面进行的物理牵拉作用。因此,负压创面疗法治疗时肉芽组织形成较多可能是其促进愈合的重要机制之一。
与常规无菌纱布治疗相比,负压创面疗法治疗时创面VEGF表达水平明显增高,说明负压创面疗法可以去除铜绿假单胞菌生物膜对创面VEGF的抑制,为VEGF促进局部新生组织内血管的形成提供条件,间接地加强了创面细菌的清理;而新生毛细血管定量分析结果进一步证实了负压创面疗法的作用。TGF-β1表达水平增加,促进创面的表皮修复,加速创面的覆盖,而负压创面疗法由于负压作用自身带有组织牵拉的作用,也可以刺激肉芽的生长及表皮爬行。
本研究的不足:未对创面细菌变化进行定量分析;未对负压创面疗法治疗下创面免疫表达变化进行分析。
综上,负压创面疗法是处理软组织感染创面的有效方法之一,与常规无菌纱布覆盖治疗相比,负压创面疗法可有效促进开放伤软组织感染创面新生肉芽组织的形成,加快创面愈合。
1 Hurlow J, Blanz E, Gaddy JA. Clinical investigation of biofilm in non-healing wounds by high resolution microscopy techniques[J].J Wound Care, 2016, 25(Suppl 9): S11-S22.
2 Moore MF. Biofilms, Their Role and Treatment Options in the Chronic Non-Healing Wound[J/OL]. http://surgicaltechnology.com/31-Orthopaedic-Surgery.htm#934.
3 Snyder RJ, Bohn G, Hanft J, et al. Wound Biofilm : Current Perspectives and Strategies on Biofilm Disruption and Treatment[J].Wounds, 2017, 29(6): S1-S17.
4 Chen S, Li R, Cheng C, et al. Pseudomonas aeruginosa infection alters the macrophage phenotype switching process during wound healing in diabetic mice[J/OL]. https://onlinelibrary.wiley.com/doi/abs/10.1002/cbin.10955.
5 Liu Y, Zhou Q, Wang Y, et al. Negative pressure wound therapy decreases mortality in a murine model of burn-wound sepsis involving Pseudomonas aeruginosa infection[J]. PLoS ONE, 2014, 9(2):e90494.
6 Davis K, Bills J, Barker J, et al. Simultaneous irrigation and negative pressure wound therapy enhances wound healing and reduces wound bioburden in a porcine model[J]. Wound Repair Regen, 2013, 21(6): 869-875.
7 Lalliss SJ, Stinner DJ, Waterman SM, et al. Negative pressure wound therapy reduces pseudomonas wound contamination more than Staphylococcus aureus[J]. J Orthop Trauma, 2010, 24(9):598-602.
8 Li T, Zhang L, Han LI, et al. Early application of negative pressure wound therapy to acute wounds contaminated with Staphylococcus aureus: An effective approach to preventing biofilm formation[J].Exp Ther Med, 2016, 11(3): 769-776.
9 Liu D, Zhang L, Li T, et al. Negative-pressure wound therapy enhances local inflammatory responses in acute infected soft-tissue wound[J]. Cell Biochem Biophys, 2014, 70(1): 539-547.
10 刘道宏. 负压创面疗法治疗感染性软组织损伤相关机制研究[D]. 北京 : 解放军医学院, 2014.
11 李曈曈. 负压治疗在急性软组织创伤感染中的作用与机制研究[D]. 天津 : 南开大学, 2016.
12 李志锐. 新型负压引流冲洗敷料的研发及其治疗感染性软组织损伤疗效的评价[D]. 北京: 解放军医学院, 2016.
13 Thompson E. Debridement Techniques and Non-Negative Pressure Wound Therapy Wound Management[J]. Vet Clin North Am Small Anim Pract, 2017, 47(6): 1181-1202.
14 Han G, Ceilley R. Chronic Wound Healing: A Review of Current Management and Treatments[J]. Adv Ther, 2017, 34(3): 599-610.
15 Bigliardi PL, Alsagoff SAL, El-Kafrawi HY, et al. Povidone iodine in wound healing : A review of current concepts and practices[J].Int J Surg, 2017, 44 : 260-268.
16 Bhandari M, Jeray KJ, Petrisor BA, et al. A Trial of Wound Irrigation in the Initial Management of Open Fracture Wounds[J]. N Engl J Med, 2015, 373(27): 2629-2641.
17 Bellosta R, Luzzani L, Bontempi F, et al. Negative pressure wound therapy (NPWT) treatment of total supra-aortic debranching graft infection[J]. Arch Med Sci, 2018, 14(2): 466-469.
18 Tamir E, Finestone AS, Wiser I, et al. Outpatient Negative-Pressure Wound Therapy Following Surgical Debridement:Results and Complications[J/OL]. http://insights.ovid.com/pubmed?pmid=29649067.

