微波消融联合人工辅助技术治疗近肝门处肝癌的有效性和安全性
卢玉菡,于晓玲
解放军总医院 介入超声科,北京 100853
原发性肝细胞癌(hepatocellular carcinoma,HCC)为临床上常见的恶性肿瘤,首选治疗方式多为外科手术切除[1-2]。但具有严重肝硬化病史、肝功能不全及以及多发HCC患者常不具备外科手术机会。对于不能完全手术切除的HCC患者多选择超声引导下经皮热消融治疗[2-3]。该技术具有实时性强、创伤小、安全性高等优点[4],并且相对于外科手术切除,可对同一患者同一病灶或不同部位病灶进行多次、多点重复消融。然而,当肿瘤位于肝门部时,由于肝门部存在肝门静脉、肝静脉、胆管等重要组织结构,周围常毗邻胰腺及肠管等重要组织,热消融治疗易导致肠道损伤或胰、胆管瘘等严重并发症[5-7]。尤其是微波消融肿瘤组织内升温快、温度高,更容易导致相邻组织的热损伤[8],并且血管组织“热沉效应”会直接影响消融效果,增加肿瘤复发率。近年来随着介入超声辅助技术(人工腹水、无水乙醇注射、人工胸水、实时测温等)的发展,使得热消融技术的应用范围不断扩大,危险部位肿瘤的消融治疗逐渐可行[9]。其中人工腹水在肝肿瘤消融中应用越来越普遍,其使目标消融区域与周围重要脏器分开,可以避免热损伤,尽管如此,若肿瘤靠近肝内胆管或血管则另需注射无水乙醇辅助微波消融。本文回顾性分析140例近肝门部HCC患者局部微波消融治疗的安全性和有效性,为临床治疗提供帮助。
资料和方法
1 资料 选取2016年3月- 2017年7月本院介入超声科收治的140例肝门部HCC患者(157个结节),按治疗方法分为两组。观察组70例(77个结节),男45例,女25例,年龄32 ~ 79 (55.41±10.52)岁;结节直径0.8 ~ 5.0(2.83±1.71) cm;Child分级A级48例,B级22例。对照组70例(80个结节),男48例,女22例,年龄29 ~ 75(55.64±10.58)岁;结节直径0.7 ~ 4.9(2.78±1.72) cm;Child分级A级46例,B级24例。两组患者一般资料无统计学差异(P均>0.05)。见表1。
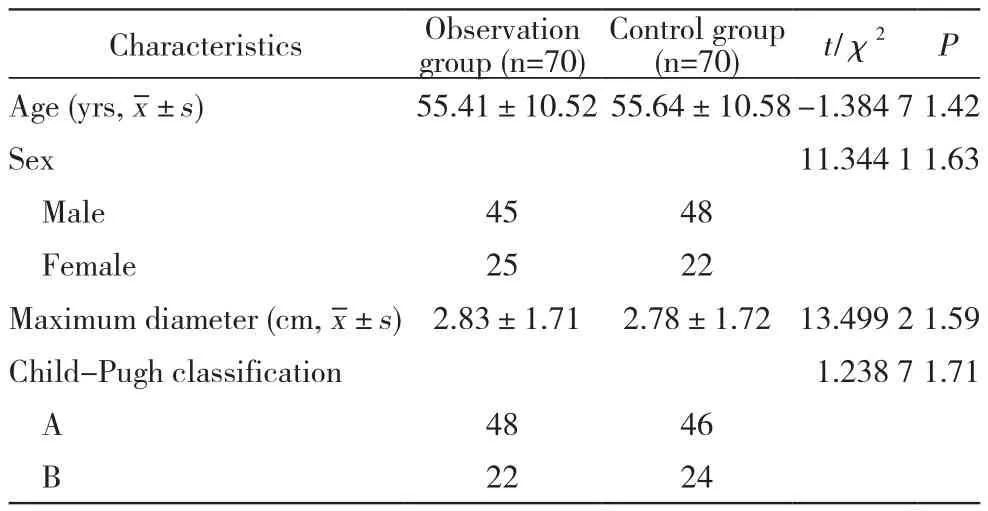
表1 两组肝癌患者一般资料比较Tab. 1 Comparison of general data between the two groups
2 手术患者标准 1)位于近肝门处(二维超声图像上显示病灶距肝门重要结构最短距离0.5 cm以内)的病灶,不可切除或拒绝接受手术切除的HCC患者;2)单个肿瘤直径<5 cm或3个以上肿瘤(每个肿瘤最大直径不超过3 cm)者;3)无严重凝血障碍、血小板功能异常性疾病。凝血酶原时间<25 s,凝血酶原活动度<40%,血小板计数>40×109/L。对于有心脏疾病或脑梗病史的患者,需经麻醉科、心内科及神经内科会诊确定停服抗凝药的时间,一般为3 ~ 7 d,Child-Pugh分级A级或B级者;4)术前谈话并签署知情同意书。
3 仪器 西门子Sequoia 512型彩色多普勒超声诊断仪,变频凸阵探头频率2.5 ~ 5.0 MHz,及匹配穿刺引导装置;南京康友KY 2000微波消融治疗仪(2 450 MHz,输出功率10 ~ 80 W),连续可调,内置水冷却循环系统;微波针(长度15 cm,外径15 G),采用硬质缝隙微波发射,可直接穿刺深部组织,针表层采用特殊防粘处理,消融过程中可实时监测温度。
4 治疗方法 1)对照组:采取微波消融配合人工腹水技术进行治疗。选择合适进针路径,常规铺巾、麻醉。在超声引导下16G穿刺针插入病灶与胃肠之间,先注入0.9%氯化钠注射液10 ml(含0.1 ml造影剂)确定针尖在胃肠间隙内,然后注入足够量(100 ~ 1 500 ml)的0.9%氯化钠注射液,直到目标病灶或正常肝和胃肠道间至少有5 mm的距离为止。若注入1 500 ml 0.9%氯化钠注射液仍未将病灶与胃肠道分离,则视为人工腹水失败,患者再选择其他治疗方式,如粒子植入、放化疗等。2)观察组:在对照组患者治疗的基础上注射无水乙醇,即在靠近肝门大血管、胆管的肿瘤边缘插入一个或两个21 G穿刺针用以注入乙醇,在严格的温度监测下,在肿瘤的边缘注射小剂量(1 ~ 5 ml/次)乙醇,可分多次注入。通常,直径<2 cm的病灶使用1根微波天线,≥2 cm的病灶使用两根针并且针间距不超过1.8 cm,微波针离胆囊或肝门部大血管至少5 mm,两根针同时激发以得到更大的消融范围。3)测温系统:两组微波消融均需要实时测温。将20 G热电偶插到最接近病灶的胆囊、大血管附近或人工腹水内,实时温度监测,当热电偶温度达到54℃时停止微波发射,当温度低于45℃时重新启动。直到整个肿瘤在二维超声上显示被高回声完全覆盖为止。
5 疗效评价 注入足量(100 ~ 1 500 ml)0.9%氯化钠注射液后,二维超声图像显示胃肠道与病灶分离,病灶能清楚显示并顺利完成微波消融,则视为人工液腹技术成功;穿刺针准确到达病灶位置,无水乙醇顺利注入病灶内,并且顺利完成微波消融。则视该项技术成功。微波消融术后1周内行超声造影、CT或MRI检查以确定是否需要再次治疗。治疗后第3、6、12个月进行随访,行增强CT/MRI检查、肝功能等检查。消融1个月后增强影像检查消融灶内或周边无异常强化定义为完全消融。随访期内若增强CT/MRI提示治疗灶周边出现强化或治疗灶体积增大,则视为肿瘤局部进展。
6 统计学方法 采用SPSS18.0统计软件进行统计分析,年龄、病灶直径等计量资料比较采用t检验,性别、Child分级、技术成功率、肿瘤完全消融率及肿瘤局部进展率等计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
结 果
1 人工腹水及无水乙醇用量 观察组:1次微波消融过程中,注射0.9%氯化钠注射液的量为120 ~1 500(561.6±460.9) ml;注入无水乙醇的次数1 ~ 2(1.1±0.5)次,总剂量为 2 ~ 28(8.3±5.6) ml。对照组:1次微波消融过程中,注射00.9%氯化钠注射液的量为 130 ~ 1 500(490.6±447.8) ml。
2 总体技术成功率与肿瘤完全消融率 观察组的总体技术成功率为97.14%(68/70),肿瘤完全消融率为96.10%(74/77);对照组患者的总体技术成功率为95.71%(67/70),肿瘤完全消融率为90%(72/80),两组差异有统计学意义(P<0.05)。两组患者的总体技术成功率则无统计学差异(P>0.05)。见表2。
3 肿瘤局部进展率 观察组术后第3、6、12个月的肿瘤局部进展率分别为2.60%(2/77)、9.09%(7/77)、14.29%(11/77),对照组患者术后3、6、12个月的肿瘤局部进展率分别为2.5%(2/80)、8.75%(7/80)、10%(8/80)。两组患者术后3个月肿瘤局部进展率均无统计学差异(P>0.05),术后第6个月、12个月的肿瘤局部进展率有统计学差异(P<0.05)。见表3。
4 两组并发症比较 两组术后均未出现胰、胆管瘘、肠道损伤等严重并发症。部分观察组患者术后出现局部疼痛,疼痛评分3级的占2.60%,口服止疼药后缓解;14.29%的患者疼痛评分1 ~ 2级,未给予任何处理。持续1 ~ 14 d后消失;21.4%的患者术后出现发热,最高温度37.5℃ ~39.7℃,持续约1 ~ 7 d,未经处理或使用退热药后缓解;44.3%患者术后出现恶心或呕吐的症状,持续2 ~5 d后消失;1例术后1个月超声造影显示门静脉右支血栓形成,未经任何处理3个月后消失。对照组术后局部疼痛、发热、恶心或呕吐的发生情况与观察组一致;此外对照组有1例发现肿瘤腹壁种植,随后接受了I125粒子植入治疗获得良好的治疗效果。
5 典型病例 47岁男性肝门部HCC患者。二维超声示肝门部不均质低回声结节,大小2.8 cm×1.9 cm×2.2 cm,边界不清,形态欠规则,彩色多普勒可见病灶内少量血流信号,病灶临近门静脉及胃肠道(图1A、图1B)。在造影条件下,16 G穿刺针插入病灶与胃肠之间,先注入0.9%氯化钠注射液10 ml(含0.1 ml造影剂)确定针尖在位置,然后注入780 ml的0.9%氯化钠注射液使正常肝和胃肠道间分离(图1C)。然后插入两根微波天线行微波消融(图1D)。消融术后,造影示消融区大部分无增强,但其前方仍有小部分高增强,但因病灶前方紧邻门静脉,因此超声引导下插入1根21G穿刺针注入2 ml无水乙醇(图1E),消融过程中20G测温针插入病灶与门静脉之间,实时测温(图1F)。患者术后消融区有轻微疼痛,发热,体温最高37.8℃,未服用任何退热药物自行缓解。患者术后第3、6、12个月随访均未出现肿瘤局部进展。
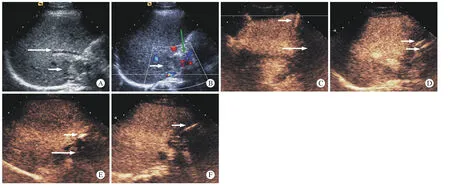
图 1 47岁男性肝门部HCC微波消融治疗过程A:肝门部HCC(短箭头),靠近门静脉(长箭头); B:HCC(短箭头),胃肠道(绿箭头); C: 造影条件下,16 G穿刺针(短箭头)插入病灶与胃肠之间,注入780 ml的0.9%氯化钠注射液(长箭头)使正常肝和胃肠道间分离; D:插入两根微波天线(箭头); E:消融术后,造影示消融区(长箭头)前方有小部分高增强,插入1根21 G穿刺针(短箭头)注入2 ml乙醇;F:20 G测温针(箭头)插入病灶与门静脉之间,实时测温Fig. 1 A 47 year-old male with HCC. Microwave ablation procedure for HCC lesion adjacent to hepatic hilum A: HCC (short arrow) adjacent to the portal vein (long arrow); B: HCC (short arrow) and gastrointestinal tract (green arrow); C:Under the condition of contrast, the 16 G puncture needle (short arrow) was inserted between the focus and the gastrointestinal tract,and 780 ml of 0.9% sodium chloride solution (long arrow) was injected into the normal liver and the gastrointestinal tract; D: Insert two microwave antennas (arrow heads); E: After ablation, there was a small enhancement in front of the ablation area (long arrow), and a 21 G puncture needle (short arrow) was inserted with 2 ml of ethanol; F: 20 G temperature probe (arrow) was inserted between lesion and portal vein to measure temperature in real time

表2 两组总体技术成功率与肿瘤完全消融率比较Tab. 2 Comparison of overall technical success rate and complete ablation rate of the two groups (n, %)

表3 两组术后肿瘤局部进展率比较Tab. 3 Comparison of local progression rates in two groups (n,%)
讨 论
原发性肝癌发病率居恶性肿瘤第5位,肿瘤相关死亡率居第3位。目前临床治疗的主要手段是手术+放化疗。随着医学技术的进步,影像学引导下微创介入治疗手段逐渐应用于肿瘤治疗领域,对于肝肿瘤的介入治疗,CT及超声引导较为常见[10-11],超声引导具有“实时性”,对于肝病变治疗的灵活性常优于CT,由于肝门部解剖结构复杂,病灶常靠近胆管、血管、胃肠道、胆囊等重要结构,采取微波消融治疗易出现胃肠穿孔、胆管损伤、消融不完全等问题[12-15]。因此部分学者认为肝门部肿瘤不适宜行经皮热消融治疗[16-18]。
近年来,随着介入超声辅助技术的不断发展,困难部位肝肿瘤也并非消融“禁区”。Chopra等[19]首先报道了靠近胆囊的肝肿瘤局部射频消融安全性和有效性的研究。国外对人工腹水联合射频消融的研究中发现人工腹水不会引起热沉效应[20]。Dou等[21]对20例位于尾状叶的HCC患者行超声引导经皮微波消融联合无水乙醇注射治疗,完全消融率达90%。随访时间平均18.4个月,无死亡或并发症发生。证实在严格的温度控制下超声引导经皮微波消融联合无水乙醇注射治疗尾状叶肿瘤是可行有效的。Zhang等[22]对36例靠近胃肠道HCC的患者进行人工腹水经皮微波消融治疗,技术成功率为88.9%(32/36),完全消融率96.9%(31/32),平均随访时间12.1个月,肿瘤局部进展率16.1%(5/31),1例患者出现消融区感染。人工液腹联合微波消融治疗是治疗胃肠道原发性和转移性肝癌的一种安全有效方法,可达到良好的局部控制。
人工腹水技术有着很好的隔热效果,在对患者行微波消融治疗时,人工腹水技术的配合使用主要是为了将病灶与胃肠道分离开,一个方面是为了排除胃肠气体干扰使病灶在超声图像上显示更清楚,一方面避免在消融的过程中对胃肠道等重要器官或组织造成热损伤。而注射无水乙醇是为了改善临近肝门等重要脏器肿瘤消融不彻底的情况[23]。
从本文的研究结果来看,观察组患者的总体技术成功率和肿瘤完全消融率分别为97.14%和96.10%,而对照组患者的总体技术成功率和肿瘤完全消融率分别为95.71%和90%,说明在微波消融配合人工腹水辅助技术治疗方案的基础上注射无水乙醇可有效提高肿瘤的完全消融率,同时不会降低总体技术成功率。而从术后肿瘤局部进展率来看,术后3个月两组患者的肿瘤局部进展率无统计学差异,而术后6个月、12个月观察组患者的肿瘤局部进展率显然低于对照组患者,说明注射无水乙醇可有效提高患者的远期疗效。
两组患者术后并发症发生情况基本类似。一般肝被膜附近的肿瘤消融后出现不同程度腹痛,这可能是由肝被膜受刺激引起的。消融后坏死组织被机体吸收可导致体温升高。此外观察组中1例术后1个月超声造影显示门静脉右支血栓形成,其原因可能是热量导致血液凝固,未经任何处理3个月后消失。对照组患者1例出现肿瘤腹壁种植,该患者随后接受了I125粒子植入治疗获得良好的治疗效果。
本研究存在一些局限,样本量少、随访时间较短。为进一步验证近肝门部肿瘤微波消融治疗的安全性和有效性,需要更大样本量、更长随访时间、多中心的研究。
综上所述,微波消融射配合使用人工腹水辅助技术治疗近肝门处肝癌具有良好的有效性和安全性,而在此治疗基础上消融困难的位置注射无水乙醇,可有效提高微波消融的治疗效果和远期疗效。
1 Lee EC, Kim SH, Park H, et al. Survival analysis after liver resection for hepatocellular carcinoma: A consecutive cohort of 1002 patients[J]. J Gastroenterol Hepatol, 2017, 32(5): 1055-1063.
2 Pascual S, Herrera I, Irurzun J. New advances in hepatocellular carcinoma[J]. World J Hepatol, 2016, 8(9): 421-438.
3 杨晓环, 黄十佳, 于杰, 等. 超声引导经皮微波消融治疗邻近血管的原发性肝癌的长期疗效[J]. 肿瘤学杂志, 2016, 22(1):24-28.
4 Facciorusso A, Serviddio G, Muscatiello N. Local ablative treatments for hepatocellular carcinoma: An updated review[J]. World J Gastrointest Pharmacol Ther, 2016, 7(4): 477-489.
5 庞武, 陈莉红, 戴毅, 等. 超声引导下微波消融、手术切除治疗肝癌的临床效果及安全性研究[J]. 中国医药导刊, 2017, 19(5): 458-459.
6 申文凤, 冯志强, 张洪义,等. 超声引导下经皮微波消融治疗高龄小肝癌疗效分析[J]. 中国医刊, 2015, 50(12): 42-45.
7 Ma S, Ding M, Li J, et al. Ultrasound-guided percutaneous microwave ablation for hepatocellular carcinoma: clinical outcomes and prognostic factors[J]. J Cancer Res Clin Oncol, 2017, 143(1):131-142.
8 Yu J, Liang P, Yu XL, et al. Local tumour progression after ultrasound-guided microwave ablation of liver malignancies: risk factors analysis of 2529 tumours[J]. Eur Radiol, 2015, 25(4):1119-1126.
9 伍晓敏, 周平, 马树花, 等. 超声引导下激光消融治疗高危部位小肝癌[J]. 南方医科大学学报, 2016, 36(1): 120-125.
10 Li B, Liu C, Xu XX, et al. Clinical Application of Artificial Ascites in assisting CT-guided Percutaneous Cryoablation of Hepatic Tumors Adjacent to the Gastrointestinal Tract[J]. Sci Rep, 2017, 7(1):16689.
11 Khong K, Nguyen H, Li CS, et al. Percutaneous Radiofrequency Ablation of Hepatocellular Carcinoma against the Diaphragm: Is Artificial Ascites Necessary?[J]. Open Journal of Radiology,2014, 4(1): 32-43.
12 张雪花, 张潆化, 梁萍. 超声引导下微波消融治疗肝癌246例并发症分析[J]. 解放军医学院学报, 2015, 36(9): 883-885.
13 张德东, 于晓玲, 梁萍, 等. 171例肝恶性肿瘤经皮微波消融疗效及并发症[J]. 军医进修学院学报, 2012, 33(4): 350-352.
14 Lin MX, Ye JY, Tian WS, et al. Risk Factors for Bile Duct Injury After Percutaneous Thermal Ablation of Malignant Liver Tumors: A Retrospective Case-Control Study[J]. Dig Dis Sci, 2017, 62(4):1086-1094.
15 Liu SR, Liang P. Complications of Microwave Ablation for Liver Tumors[M]//Liang P, Yu XL, Yu J. Microwave Ablation Treatment of Solid Tumors. Springer Netherlands, 2015 : 65-76.
16 Bruix J, Sherman M, . Management of hepatocellular carcinoma : an update[J]. Hepatology, 2011, 53(3): 1020-1022.
17 Cuschieri A, Bracken J, Boni L. Initial experience with laparoscopic ultrasound-guided radiofrequency thermal ablation of hepatic tumours[J]. Endoscopy, 1999, 31(4): 318-321.
18 De Santiba?es E, Mc Cormack L, Pekolj J, et al. [Multimodal treatment of hepatocellular carcinoma][J]. Acta Gastroenterol Latinoam, 2001, 31(5): 367-375.
19 Chopra S, Dodd GD 3rd, Chanin MP, et al. Radiofrequency ablation of hepatic tumors adjacent to the gallbladder: feasibility and safety[J].AJR Am J Roentgenol, 2003, 180(3): 697-701.
20 Kang TW, Lim HK, Lee MW, et al. First-line radiofrequency ablation with or without artificial ascites for hepatocellular carcinomas in a subcapsular location: local control rate and risk of peritoneal seeding at long-term follow-up[J]. Clin Radiol, 2013, 68(12):e641-e651.
21 Dou JP, Yu J, Cheng ZG, et al. Ultrasound-Guided Percutaneous Microwave Ablation for Hepatocellular Carcinoma in the Caudate Lobe[J]. Ultrasound Med Biol, 2016, 42(8): 1825-1833.
22 Zhang M, Liang P, Cheng ZG, et al. Efficacy and safety of artificial ascites in assisting percutaneous microwave ablation of hepatic tumours adjacent to the gastrointestinal tract[J]. Int J Hyperthermia, 2014, 30(2): 134-141.
23 Zhou P, Kong Y, Liang P. Percutaneous Microwave Ablation with Temperature Monitor Combined with Ethanol Ablation for Hepatocellular Carcinoma Abutting the Gastrointestinal Tract[M]//Liang P, Yu XL, Yu J. Microwave Ablation Treatment of Solid Tumors. Springer Netherlands, 2015 : 109-120.

