我国部分猪场猪圆环病毒3型流行病学调查
张 志,郝占武,2,张美晶,张丽丽,2,刘 爽,吴发兴,李晓成,王树双
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 青岛农业大学,山东青岛 266109)
猪圆环病毒(Porcine circovirus,PCV)是目前最小的单链环状DNA病毒,从发现第1株PCV到现在已经有35年[1]。根据PCV基因组和致病性不同,PCV可以分为PCV-1、PCV-2和PCV-3 3个亚型[2-3]。PCV-1感染猪后不引起任何临床症状;PCV-2感染猪后则会引起断奶仔猪多系统衰竭综合症(PMWS)、皮炎性肾病、渐进性消瘦、生长发育不良等多种临床症状复杂的疫病[4-6];PCV-3是一种从猪体内鉴定的新亚型,其临床症状和致病机制尚不明确。从宿主和感染类型来看,3种PCV亚型存在较大差异。PCV-1主要存在于PK15等一些传代细胞系中,但不引起明显的细胞病变;PCV-2是目前猪群中最常见的引起临床感染和发病的类型,广泛存在于世界各地猪场;PCV-3自2016年发现以来,已先后有美国、中国、韩国、波兰、巴西等国家陆续报道发现[7-11]。PCV-3感染率和流行率的快速增长,引起了人们的关注。但遗憾的是,感染PCV-3的猪只仅表现生长不良,其他临床症状并不明显。通过组织病理学检查,仅可看到病猪的心脏和多系统炎性浸润等病理变化[3]。但这些症状和病理变化并不是猪感染PCV-3后引起的特征性病变,加上PCV-3分离培养较困难,病原检测手段还不完善,因此 PCV-3的诊断有很大困难,对其预防和控制更加不易。为此,本研究收集了我国部分猪场PCV-3的流行病学背景资料,利用荧光PCR方法开展了PCV-3被动监测,深入分析了PCV-3感染与临床症状的关系,以及PCV-3感染与仔猪年龄的相关性等,为后续研究提供了技术支持。
1 材料与方法
1.1 样品和病毒
80份猪临床发病样品:来自福建、山东、河南等10个省份的猪群,其中 :67份样品明确记录了采样猪的腹泻、发热或呼吸道症状等临床表现,13份样品没有任何相关症状记录;51份样品记录了采样仔猪日龄(表1)。PCV-3阳性样品(编号SD66):本实验室(中国动物卫生与流行病学中心畜病监测室)鉴定和保存。
1.2 主要试剂
Real Time Taq 试剂盒(RR390A):宝生物工程(大连)有限公司产品;病毒DNA提取试剂盒(DNAZol):Life公司产品。
1.3 检测方法
以本实验室建立的Taqman荧光PCR作为PCV-3的检测方法。该方法的上游引物为PCV3-F110:5'- gatgatgaagcggcctcgtgttttga-3';下游引物为 PCV3-R284:5'- tcggtcggggtccagttgtttatcgta -3';探针为5'-FAM-caccccgcaaaaatcacgcaaacc-BHQ1-3'。引物与探针均由宝生物工程(大连)有限公司合成。
1.4 检测程序
根据DNAzol说明书,从猪样品中提取总基因组DNA,分别进行PCV-3荧光PCR。荧光PCR反应体系包括:Premix EX-Taq反应液12.5 μL,上游引物(10 μmol/L)、下游引物(10 μmol/L)和荧光探针(5 μmol/L)各 1 μL,DNA 标准品 2 μL,用ddH2O 补充至25 μL。荧光PCR反应扩增条件为:95 ℃预变性3 min,45个扩增循环(95 ℃ 5 s,60 ℃ 14 s),60 ℃读取荧光。
1.5 统计分析
根据荧光PCR检测结果和病料背景资料,进行流行病学和统计学分析。
2 结果
2.1 样品中的PCV-3检测
在检测结果的判定中,Ct值<35的样品判断为阳性样品,≥35且<37的判断为可疑样品,≥37的判断为阴性样品。可疑样品重复检测1次,如仍≥35且<37则判为阳性。在本研究采集的80份猪样品中,利用荧光PCR检测方法,共检测出22份阳性,阳性检出率为27.50%(图1)。
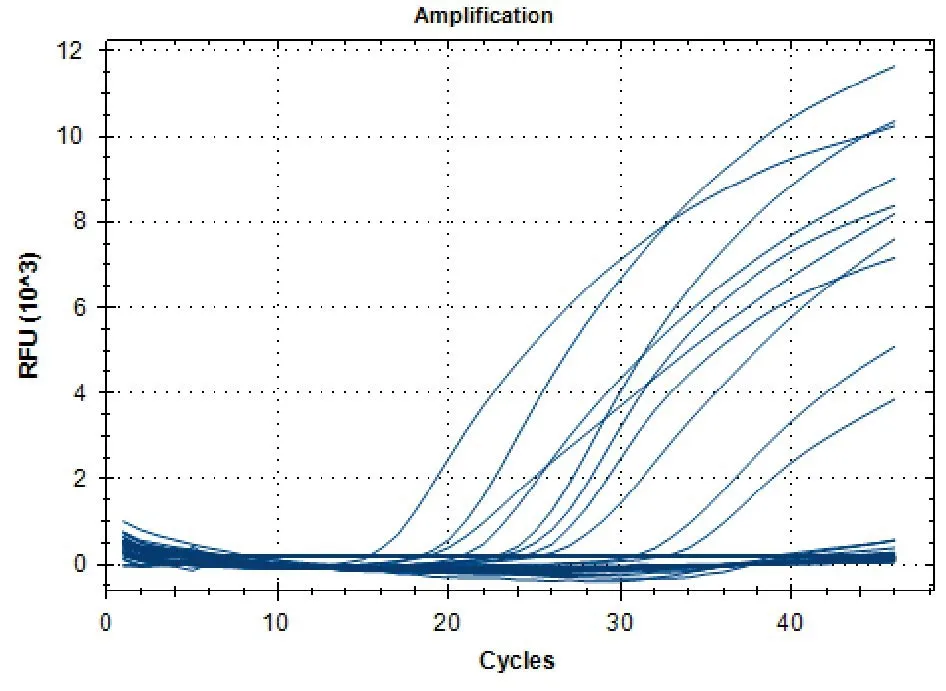
图1 荧光探针PCR方法检测临床样品PCV-3的结果
2.2 PCV-3感染与分布
采集的猪样品来自山东、福建、广西、河南、江西、湖北、四川、江苏、黑龙江、海南等10省份,其中从山东、河南、广西、福建等4省份检测到了PCV-3,分别为:山东采集48份,检出阳性13份;河南省采集6份,阳性2份;广西采集7份,阳性4份;福建采集9份,阳性3份(表1)。由此可以看出,PCV-3不仅存在于我国南方,而且北方的山东、河南等养猪大省也有分布,表明PCV-3在我国分布较为广泛。
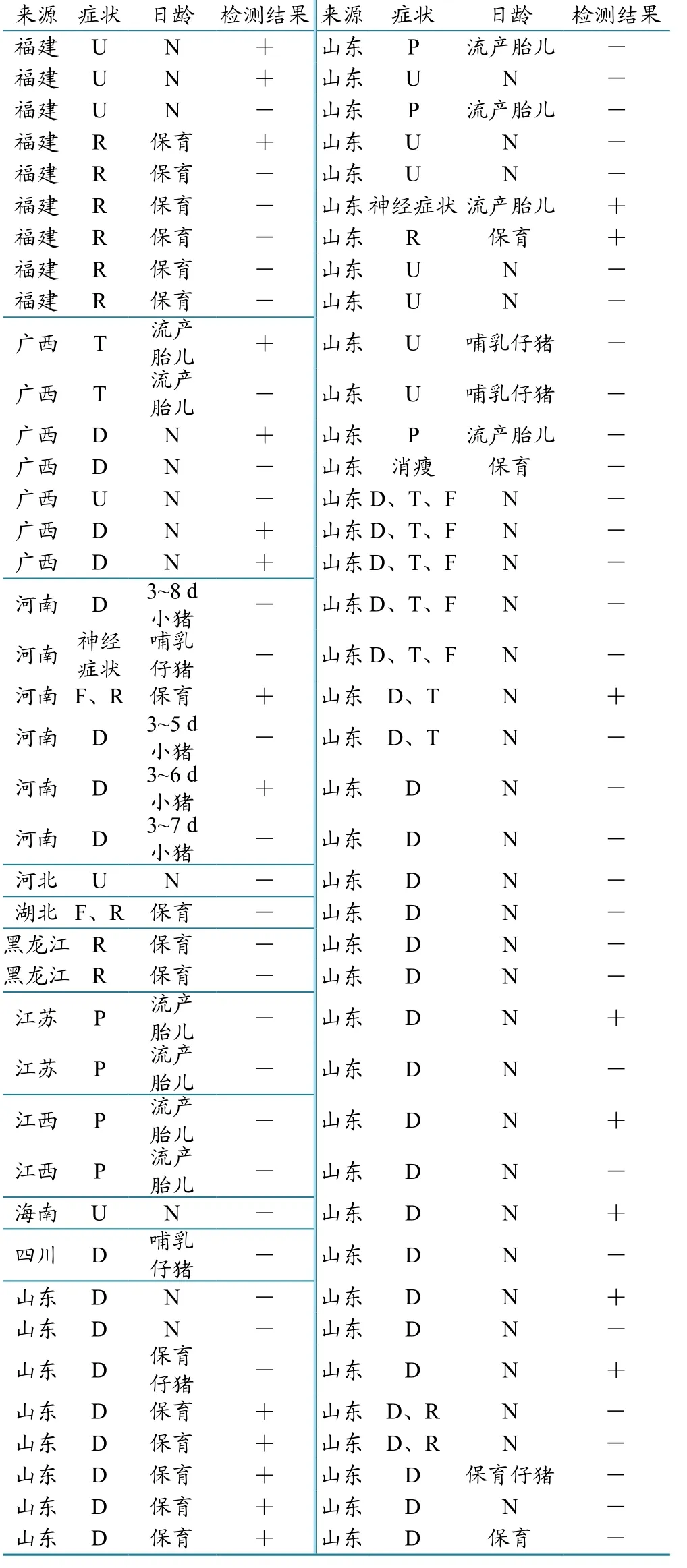
表1 样品来源、分布以及PCV-3检测情况
2.3 临床症状与PCV-3感染相关性
80份发病样品中,13份没有记录症状或症状不明,因此没有对这些样品进行分析,其余67份的分析结果汇总详见表2。从中可以看出,腹泻样品的PCV-3阳性检出率最高,为34.09%(15/44),其次是呼吸道症状样品,为27.27%(3/11),高热症状样品的阳性检出率最低,为14.29%(1/9)。该结果提示,临床症状不同样品的PCV-3感染率存在一定差异,腹泻样品可能是检测PCV-3的优选采样组织。
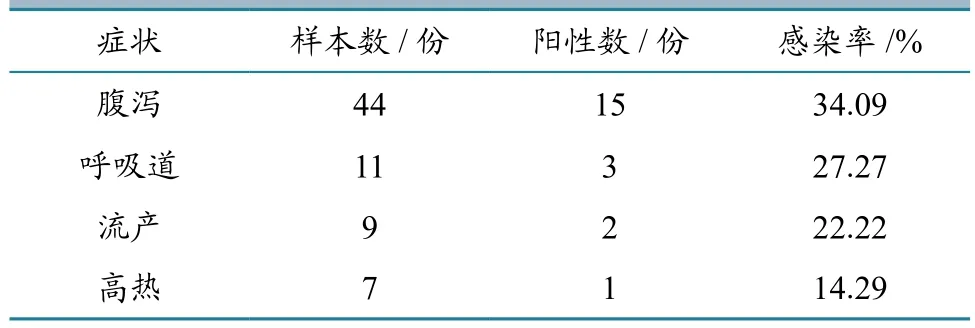
表2 临床症状与PCV-3感染的关系
检测还发现,同时表现腹泻、发热、流产等多种症状的11头猪样品中,PCV-3感染率为18.18%(2/11)。另外从表现神经症状的2份品中检测出1份PCV-3阳性,而7份表现繁殖障碍和1份表现消瘦的样品中,均没有检测出PCV-3阳性。
2.4 猪群生长阶段与PCV-3感染的关系
在采集的80份发病样品中,有39份记录了采样时的仔猪生长阶段。其中:10份流产胎儿样品中,检测到2份PCV-3阳性,阳性检出率为20.00%(2/10);8份哺乳仔猪样品中检测到1份阳性,阳性检出率为12.50%(1/8);20份保育仔猪样品中,检测到8份阳性,阳性检出率为40.00%(8/20)。这表明保育仔猪中的PCV-3感染率最高(图2)。
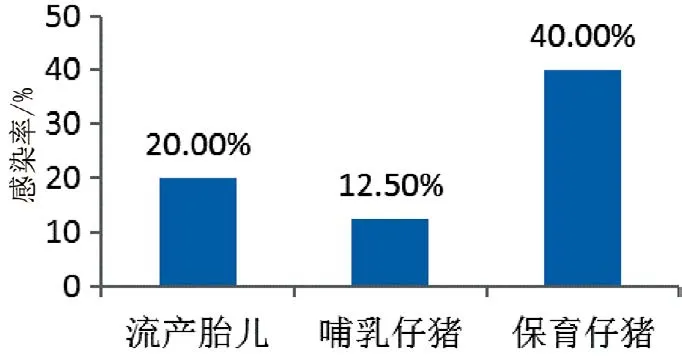
图2 不同生长阶段仔猪的感染状况
3 讨论
近年来,以PCV-2亚型为主的PCV感染已成为我国猪群的一种常见性多发性疫病。监测结果说明,PCV-2在我国猪群中呈现感染率高、感染面广的特点。早在2003年,陆国林等[12]对浙江省规模化猪场进行了PCV2病原学检测时就发现,猪场PCV-2的平均感染率为28.0%,猪个体感染率为21.7%;陈义祥等[13]对广西14市97个猪场的197份组织病料进行PCV2检测,发现阳性率为54.8%;梁红虎等[14]通过PCR方法,对广东省20个猪场的患病断奶仔猪病料进行PCV2检测,发现阳性率为100%;Sun 等[15]检测了国内规模化猪场的450份病料,发现PCV2阳性率为47.33%,与PRV的共感染率为62.44%;Wang等[16]检测了黑龙江等4省的127份临床样品,发现PCV2感染率为99.21%。
就在PCV-2的感染尚未有效控制之时,2016年Palinski等[17]发现了PCV-3新亚型,并通过组织切片观察到该病原感染的猪体内出现了炎性反应。随后我国、韩国等也相继有检测到本病原的报道。在国内,2017年Shen等[18]从发病猪样品中检测到了PCV-3,证明该病原也存在于我国猪群中;同年,Deng等[19]采用间接ELISA,对我国猪群开展了PCV3血清学调查,发现2015-2017年我国猪群PCV-3的感染率从22.35%上升到51.88%,表明PCV-3早已在我国猪群中流行和扩散。另外,广东、河北等省份已经通过病原学检测方法,证实这些省份存在PCV-3感染[20-21]。结合本研究中的广西、福建、山东、河南等4省份的检测结果,这些研究结果说明我国猪群中的PCV-3感染已非常严重,且感染范围越来越广泛,流行范围还在不断扩大,必须引起重视。
据报道,PCV-2主要侵害哺乳仔猪、保育猪、育肥猪和怀孕母猪,引起的特征性临床症状为患猪体质不良、皮肤苍白,还可引起PMWS等多种表现各异的疫病[22]。而PCV-3初次鉴定时,感染PCV-3的猪并没有呈现特征性临床特征,仅仅利用组织切片观察到部分组织出现了病理变化。而且这些猪中有的还同时存在PCV-3和其他病原的共感染,况且分离和培养PCV-3的技术还不成熟,无法有效开展动物试验。因此,PCV-3感染引起何种特征性临床症状目前无法获得直接结论,必须借助其他方法。此次监测数据表明,腹泻样品中的PCV-3感染率最高,表明腹泻可能是PCV-3感染后引起的症状之一。从检出率来看,腹泻样品中的PCV-3的检出率明显高于其他症状样品,提示在采集样品时,腹泻样品是检测PCV-3的优先候选样品。Zhai等[20]分别检测了患有严重呼吸道疾病、中等呼吸道疾病、腹泻、非腹泻等4种不同症状断奶仔猪血清中PCV-3的阳性率,发现严重呼吸道疾病仔猪血清中的PCV-3阳性率最高,为63.75%(51/80),其次是出现腹泻的断奶仔猪,阳性率为17.14%(6/35)。这一结果与本研究结果基本一致。本次研究还显示,PCV-3感染除了与呼吸道症状和腹泻存在相关性以外,还与流产、高热等存在一定的相关性。当然,由于条件所限,本研究所采集样品地区的代表性、畜种和日龄的代表性均有明显不足,需要在后续研究中进一步补充和验证。
另外,本研究首次探索了PCV-3在猪群中的年龄分布状况。从结果中可以看出,在仔猪的3个生长阶段,PCV-3的感染率也各不相同,尤以保育仔猪的感染率最高。这可能与保育仔猪体内的母源抗体滴度已经下降到很低,但又比哺乳仔猪和流产胎儿有更多机会接触外界环境中的外源病毒有关。
4 结论
综上所述,本研究利用荧光PCR技术,结合流行病学相关数据,获得了PCV-3在我国10个省份猪群中的流行状况:北方的山东、河南,南方的广西、福建等省份的猪群中存在PCV-3感染,表明分布较为广泛;PCV-3在保育仔猪中的感染率最高;PCV-3的检出率与腹泻样品密切相关。这些结果为PCV-3的采样、监测和防控提供了依据。
[1] TISCHER I,GELDERBLOM H,VETTERMANN W,et al. A very small porcine virus with circular single-stranded DNA [J]. Nature,1982,295(5844):64-66.
[2] ALLAN G M,MC NEILLY F,MEEHAN B M,et al.Isolation and characterisation of circoviruses from pigs with wasting syndromes in Spain,Denmark and Northern Ireland [J]. Veterinary microbiology,1999,66(2):115-23.
[3] PHAN T G,GIANNITTI F,ROSSOW S,et al.Detection of a novel circovirus PCV3 in pigs with cardiac and multi-systemic inflammation[J]. Virology journal,2016,13(1):184. doi:10.1186/s12985-016-0642-z.
[4] MOROZOVL Z,SIRINARUMITR T,SORDEN D,et al. Detection of a novel strain of porcine circovirus in Pigs with Postweaning multisystemic wasting syndrome[J]. Journal of clinical microbiology,1998,36(9):2535-2541.
[5] ELLIS J,HASSARD L,CLARK E,et a1. Isolation of circovirus from lesions of pig with postweaning multisystemic wasting syndrome [J]. Canadian veterinary journal larevue vétérinaire canadienne,1998,39(1):44-51.
[6] CHAE C. A review of porcine circovirus 2-associated syndromes and diseases [J]. Veterinary journal,2005,169(3):326-336.
[7] KU X,CHEN F,LI P,et al. Identi fi cation and genetic characterization of porcine circovirus type 3 in China [J].Transboundary and emerging diseases,2017,64(3):703-708. doi:10.1111/tbed.12638.
[8] KWON T,YOO S J,PARK C K,et al. Prevalence of novel porcine circovirus 3 in Korean pig populations [J].Veterinary microbiology,2017,207:178-180. doi:10.1016/j.vetmic.2017.06.013.
[9] ZHENG S,WU X,ZHANG L,et al. The occurrence of porcine circovirus 3 without clinical infection signs in Shandong Province [J]. Transboundary and emerging diseases,2017,64(24):1337-1341. doi:10.1111/tbed.12667.Ł
[10] STADEJEK T,WOZNIAK A,MIEK D,et al. First detection of porcine circovirus type 3 on commercial pig farms in Poland [J]. Transboundary and emerging diseases,2017,64(5):1350-1353. doi:10.1111/tbed.12672.
[11] TOCHETTO C,LIMA D A,VARELA A P M,et al.Full-Genome Sequence of Porcine Circovirus type 3 recovered from serum of sows with stillbirths in Brazil [J].Transboundary and emerging diseases,2018,65(1):5-9. doi:10.1111/tbed.12735.
[12] 陆国林,朱家新,俞国乔,等. 浙江省规模养猪场圆环病毒2型感染的病原学调查[J]. 中国动物检疫,2003,20(8):28-29.
[13] 陈义祥,刘翠权,何丹,等. 广西猪圆环病毒2 型感染的流行病学调查[J]. 中国兽医科技,2005,35(10):827-831.
[14] 梁红虎,罗满林,刘镇明,等. 检测猪圆环病毒2型的一种PRC方法[J]. 华南农业大学学报(白然科学版),2003,24(3):91-92.
[15] SUN J,HUANG L,WEI Y,et al. Prevalence of emerging porcine parvoviruses and their co-infections with porcine circovirus type 2 in China [J]. Archives of virology,2015,160(5):1339-1344.
[16] WANG L,GE C,WANG D,et al. The survey of porcine teschoviruses,porcine circovirus and porcine transmissible gastroenteritis virus infecting piglets in clinical specimens in China[J]. Tropical animal health and production,2013,45(5):1087-1091.
[17] PALINSKI R,PIÑEYRO P,SHANG P,et al. A novel porcine circovirus distantly related to known circoviruses is associated with porcine dermatitis and nephropathy syndrome and reproductive failure [J]. Journal of virology,2016,91(1):e01879-16.
[18] SHEN H,LIU X,ZHANG P,et al. Genome characterization of a porcine circovirus type 3 in South China [J]. Transboundary and emerging diseases,2018,65(1).
[19] DENG J,LI X,ZHENG D,et al. Establishment and application of an indirect ELISA for porcine circovirus 3[J]. Archives of virology,2018,163(2):479-482.doi:10.1007/s00705-017-3607-7.
[20] ZHAI S L,ZHOU X,ZHANG H,et al. Comparative epidemiology of porcine circovirus type 3 in pigs with different clinical presentations [J]. Journal of virology,2017,14(1):222. doi:10.1186/s12985-017-0892-4.
[21] 庞笑语,王建昌,韩庆安,等. 河北省猪群中检出猪圆环病毒3型[J]. 中国动物检疫,2017,34(11):70-73.
[22] KHAMPEE K,谭涛. 猪圆环病毒病的临床症状与防控措施[J]. 猪业科学,2010,2:20-23.

