粒用高粱耐盐种质资源鉴选与评价
范 娜,白文斌,彭之东,赵建武
(1. 山西省农科院高粱研究所,山西 榆次 030600;2. 高粱遗传与种质创新山西省重点实验室,山西 榆次 030600)
土壤盐渍化是影响农业生产和生态环境的世界性问题之一,盐胁迫影响植物的发芽、生长,最终导致农作物减产。目前全球耕地盐渍化对农作物的生产已构成较大威胁,并且呈现逐年增长的趋势[1]。世界上大约有20%的耕地及一半的灌溉地演化为盐渍地,山西省共有盐碱化土壤 2.618万hm2,盐碱地主要分布在大同、朔州、忻州、晋中、吕梁、临汾、运城、太原等地[2]。
高粱是世界和中国主要的粮食作物和饲料作物之一,属于短日照 C4植物,生长能力较强,可用作粮、饲、酿造等多种用途,是干旱半干旱地区的主要作物[3]。盐胁迫对高粱的生长发育有很大影响,根据田间土壤盐分运行规律,作物在萌发和幼苗生长期间受盐胁迫的危害尤为严重[4]。多年来,国内外对高粱的耐盐性以及筛选鉴定方法进行了研究,王宝山等[5]研究了高粱根、地上部、生长叶片及叶鞘、成熟叶片及叶鞘对NaCl胁迫的响应,发现NaCl胁迫下叶鞘鲜质量降幅最大,其次是生长叶片,成熟叶鞘和成熟叶片的变化最小;研究还发现,NaCl胁迫对植株生长的抑制主要是抑制正在生长的器官,对地上部生长的抑制作用大于根部。长期盐胁迫加速器官的衰老和死亡,降低高粱主根长、根体积、苗高,致使植株鲜质量和干质量下降。Francios等[6]对高粱整个生育期的耐盐性进行了研究,发现高粱芽期的耐盐性高于其它生长时期。对高粱种质资源的大量研究表明,高粱芽期、苗期均耐盐的品种很少。秦岭等[7]对103份高粱种质资源在芽期进行耐盐性鉴定与评价,表明在盐浓度为1.86%时不同品种间的耐盐能力存在较大差异,高粱在芽期耐盐致死浓度约为2.08%。粒用高粱作为耐盐作物已经引起国内外学者的重视,但是都集中在粒用品种的研究,对粒用高粱耐盐材料的筛选及耐盐性研究尚少见报道。本试验采用了室内模拟盐胁迫对不同粒用高粱材料在萌发期、苗期的影响,采用相关分析、主成分分析和聚类分析, 旨在为高粱耐盐材料的筛选及耐盐性研究提供理论依据,为高粱耐盐品种选育和耐盐基因挖掘提供材料。
1 材料和方法
1.1 供试材料
前期进行了室内筛选试验,从400份材料中选出50份有特点的亲本材料。试验材料名称见表1。
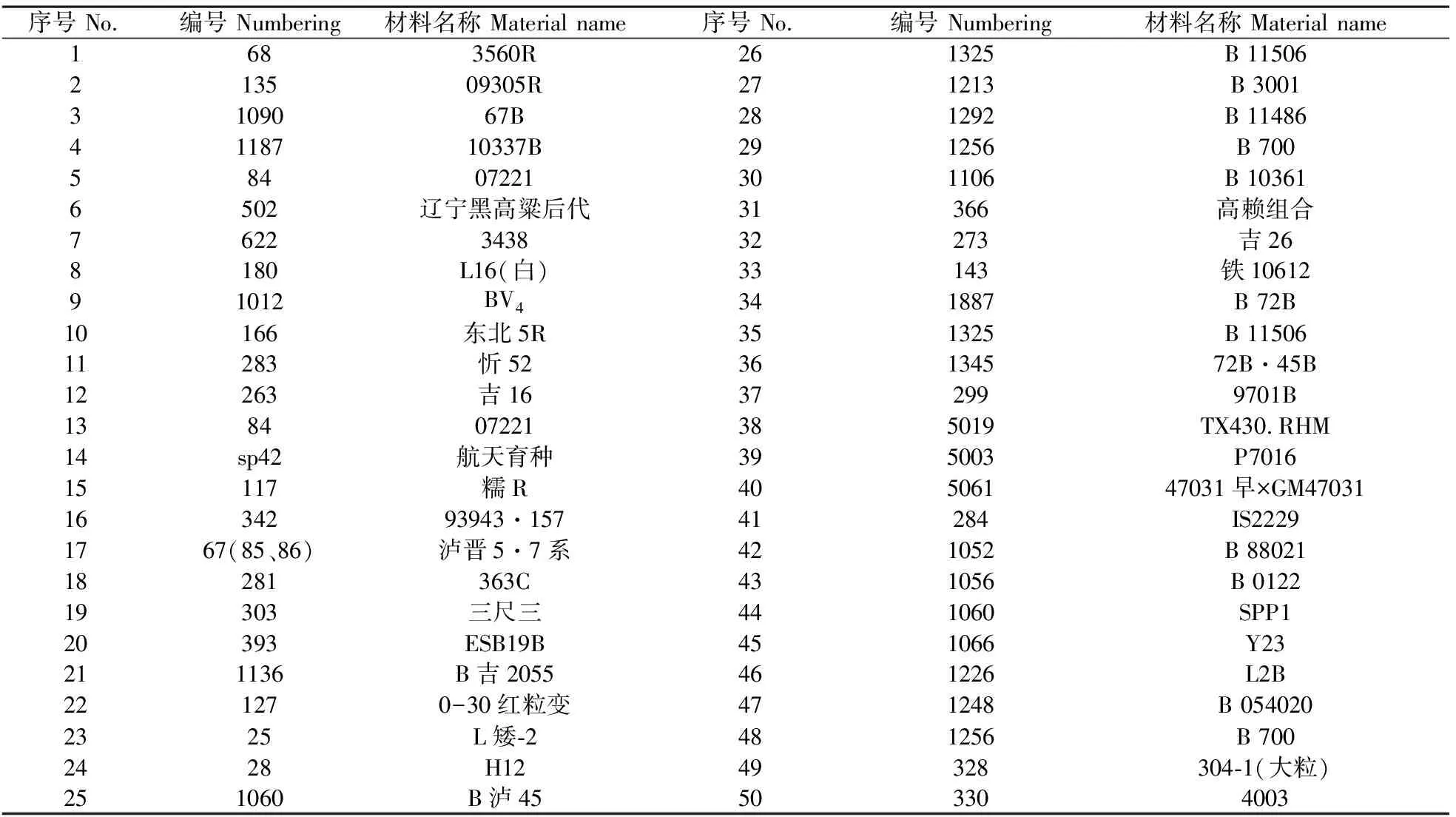
表1 高粱材料一览表
1.2 试验方法
1.2.1 萌发期材料筛选 将50份材料用 70%酒精活化30 s,然后用无离子水冲洗干净。培养皿中用双层滤纸铺好,分别标记。将种子表面水分吸干,置于直径为12cm的培养皿中,每培养皿50 粒种子。每培养皿中加入10 mL蒸馏水或150 mmol·L-1NaCl溶液,置于人工气候培养室,昼/夜温度为28℃/25℃,湿度为 60%,光照/黑暗时间为 12 h/12 h。种子自培养每天统计发芽数,在第10天测定叶长、根长,每培养皿测定3株,再取平均值。发芽以种子胚根达种子1/2为标准[8]。
1.2.2 苗期材料筛选 将筛选出的30份材料置于25℃恒温培养箱中进行催芽,将发芽基本一致的种子种于装有相同质量沙土的花盆中,每盆播种10粒,设置三次重复,加入150 mmol·L-1NaCl溶液浇灌,以等量浇水为对照,调查盐水处理和对照幼苗成活率[8]。
1.3 试验测试指标
(1)种子萌发阶段测试指标
第3 d统计发芽势,第6 d 统计发芽率、发芽指数及相对盐害率[9-11]。
发芽势=3 d后发芽种子数/种子总数×100%
发芽率=6 d后发芽种子数/种子总数×100%
相对发芽势=处理发芽势/对照发芽势×100%
相对发芽率=处理发芽率/对照发芽率×100%
第15 d用直尺测定根长、芽长。
相对盐害率=[(对照出苗数值-盐处理出苗数值)/对照出苗数值]×100%。
(2)苗期试验测试指标
分别于第7、10、13、15、27天统计出苗情况。
相对生长速率(cm·d-1)=处理第15天株高-处理第5天株高/10。
枯萎数=高粱品种在同一盐浓度处理下第15天的平均枯萎数
1.4 分析软件和分析方法
用 Excel 2003和DPS对数据进行描述性统计分析,并进行相关性分析、主成分分析和聚类分析。
2 结果与分析
2.1 不同高粱材料对萌发期盐胁迫的响应
发芽势反映种子发芽的快慢和整齐度,发芽率反映种子发芽的数量[12]。150 mmol·L-1NaCl 胁迫下,50份高粱亲本材料萌发期生长指标几乎都小于对照,不同品种降低幅度不同。相对发芽率的数值范围为 0.27%~93.4%,相对发芽势数值范围为15.15%~97.4%,根长数值范围在 0.3~4.5 cm,叶长数值范围为 0.4~2.8cm;盐害系数数值范围0.026~0.794。根据表2可知:材料09305R、67B、07221三尺三、L16(白)、辽宁黑高粱后代、3438、 ESB19B 、B 吉、20550-30、红粒变、L矮-2、东北5R 、BV4、07221、泸晋5·7系、B 3001 、B 11486 、B 700萌发期表现出较好的耐盐性,3560R、10337B、忻52、吉16、93943·157、363C、B 泸45、B 11506、高赖组合、吉26、铁10612、SPP1表现出盐敏性。从以上材料中筛选出30份材料进行下一步苗期试验。
2.2 盐胁迫对高粱苗期生长的影响
2.2.1 盐胁迫对高粱苗期生长速率的影响 将筛选出的30份材料进行苗期试验。由图1可知,于苗期播种后第7、10、13、15、17d统计高粱苗高度,盐胁迫下50份高粱亲本材料生长情况有明显区别,特别是在播种15d后。材料09305R、67B、07221三尺三、L16(白)、3438表现出较好的耐盐性,3560R、10337B、SPP1表现出盐敏性。
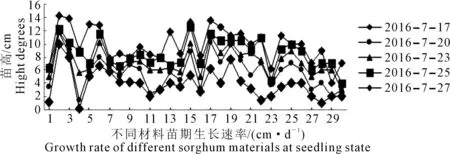
图1 不同高粱材料盐胁迫下苗期生长情况Fig.1 Growth of different sorghum materials under salt stress at seedling stage
2.2.2 盐胁迫对高粱苗期耐盐指标的影响 将筛选出的30份材料进行苗期试验,由表3可知,生长速率范围在0.65~1.25之间,枯萎数在0.68~4.88之间,确定苗期耐盐程度分为敏感、中敏、耐盐和高耐四个级别。其中09305R、67B、3438和07221等表现出高耐盐性状,3560R、吉16、10337B等表现出盐敏感性状。
2.3 盐胁迫下高粱品种各性状相对值的相关性分析
选用芽长、根长、苗高、发芽势、发芽率、发芽率盐害系数、发芽势盐害系数、生长速率、枯萎数等9个耐盐指数进行隶属函数值分析。多数性状间的相关性都达到了显著或极显著水平,结果见表4。叶鲜重与叶干重、发芽率盐害系数与发芽率、发芽势呈极显著的正相关,相关系数分别为 0.98**。根长与发芽势之间的相关性也较高,相关系数分别为 0.86**。
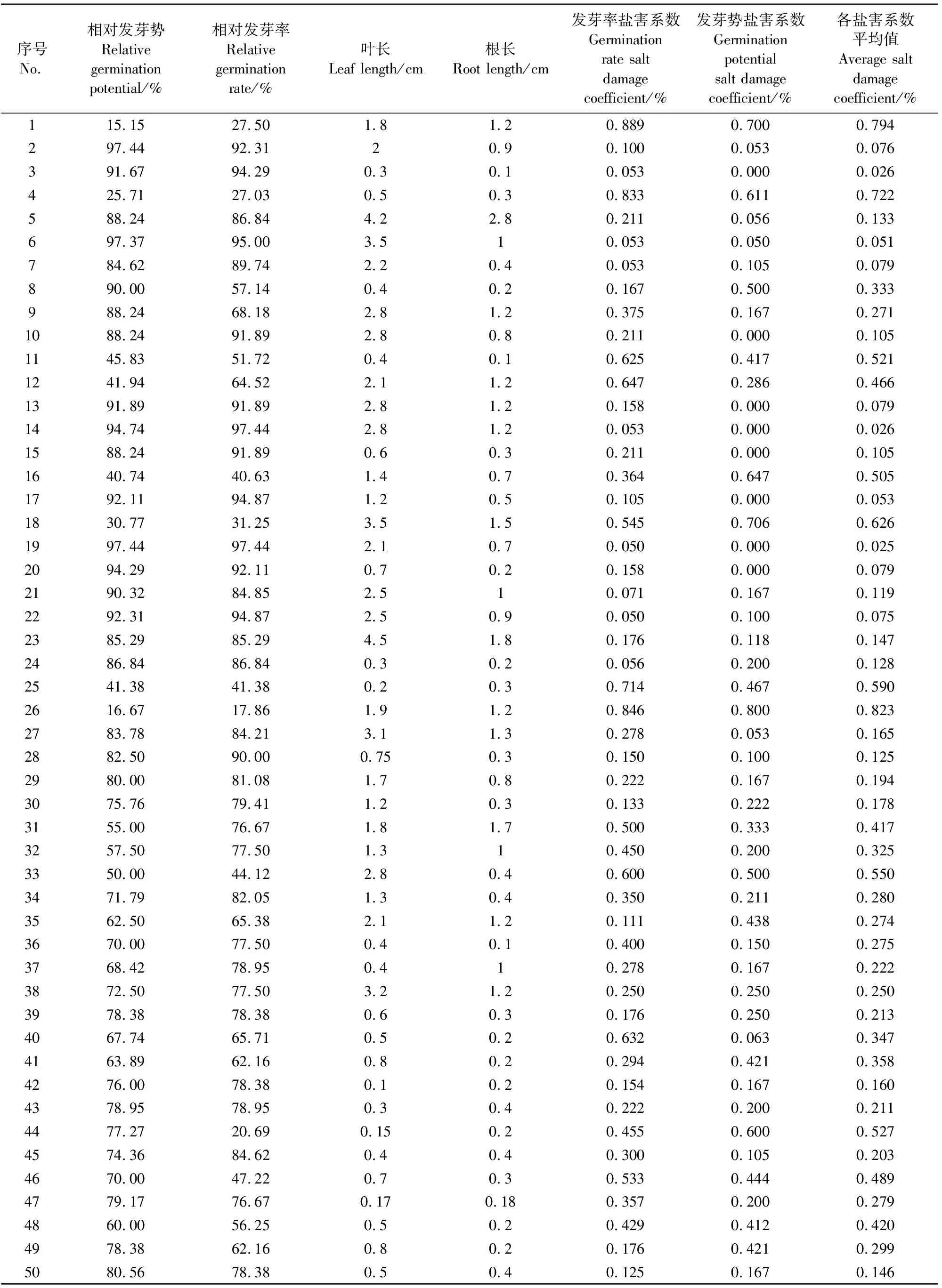
表2 NaCl处理对高粱萌发期生长的影响

表3 盐胁迫对高粱苗期生长速率的影响
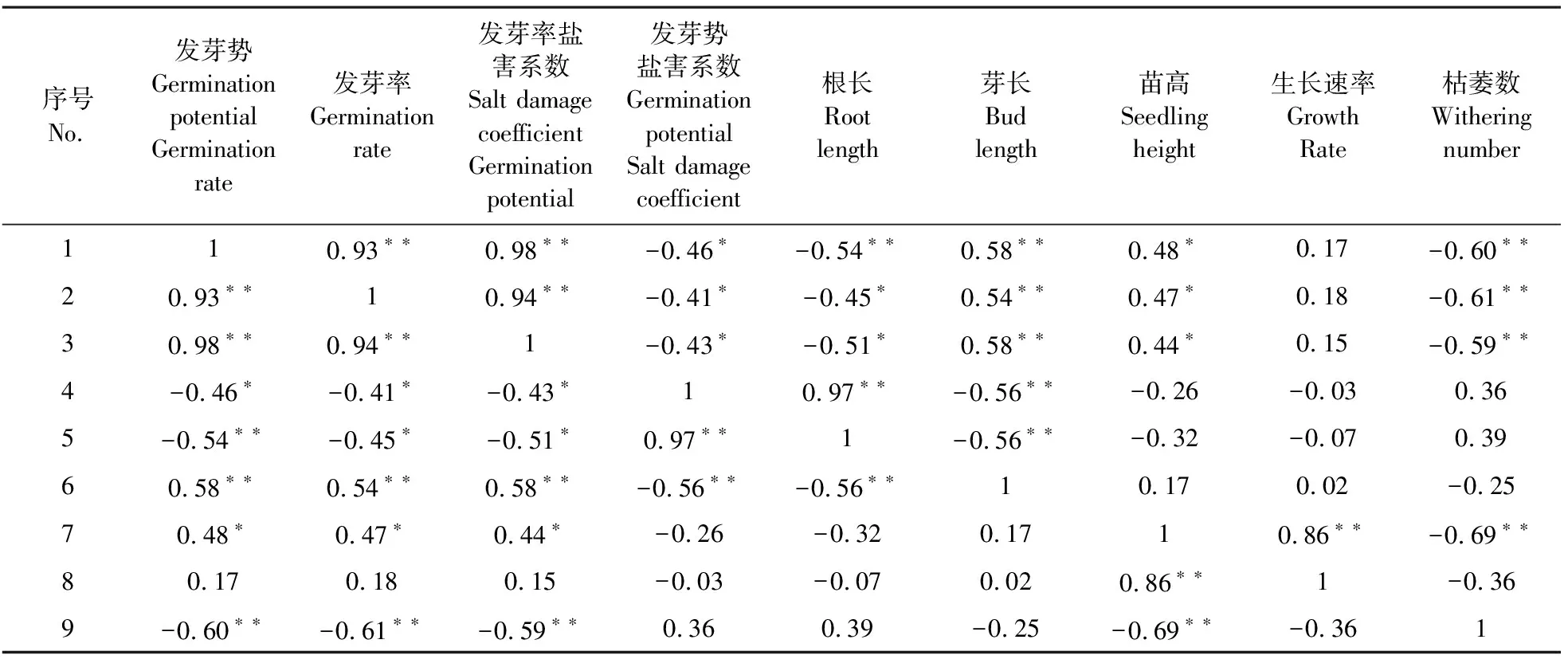
表4 盐胁迫下高粱品系各性状耐盐指数与平均隶属函数值的相关性分析
注:*表示显著(p<0.05),**表示差异极显著(p<0.01)。
Note: * indicates significant difference (p<0.05), ** indicates extremely significant difference (p<0.01).
2.4 盐胁迫对高粱各性状影响情况的主成分分析
利用化学计量学中的主成分分析和模糊聚类方法进行分析,可以把不同高粱材料对盐胁迫的萌发特性和生长特性的响应离散的数据标准化处理,以便对样品的相似性进行明确的评价[13-14]。各特征值的累计百分率代表各综合指标对遗传方差贡献的百分率,特征向量表示在各综合指标中供试品种各性状对综合指标贡献的大小。
根据相关系数列出相关矩阵,求出特征根及其相应的特征向量,为排除作用较小而干扰较大的因素,提高分析精确率,从10个特征根中选取 3 个较大的特征根及相应的 3 个特征向量[15-16]。如表5 所示,第Ⅰ主成分的贡献率为 70.29%,第Ⅰ主成分中发芽率、发芽势和发芽率盐害系数正值较高,主要反映的种子萌发生长状况,可称其为萌发生长因子;第Ⅱ主成分的贡献率为 13.01%,第Ⅱ主成分中苗长、生长速率正值较高,主要反映高粱的生长状况;第Ⅲ主成分的贡献率为 9.67%,第Ⅲ主成分与各指标的因子荷载中,以盐害系数负荷量最大,主要反映高粱耐盐能力。由表6可知,前3个主成分的累计贡献率达 92.97%,可见前 3 个主成分足以说明该数据的变化趋势,完全符合主成分分析的要求,故取前 3 个主成分作为数据分析的有效成分。这 3 个主成分与 10 个耐盐性状的相关系数(即因子负荷量)反映了它们之间的相关性[17]。
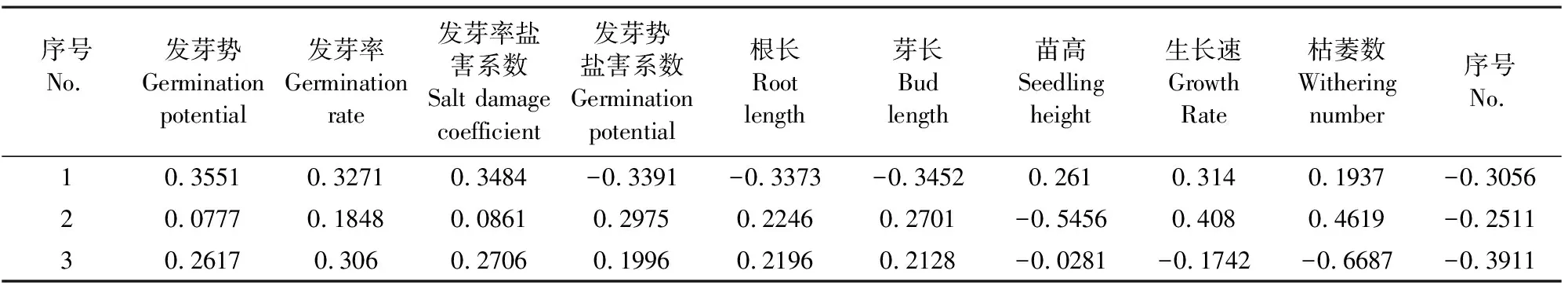
表6 各因子载荷矩阵
2.5 聚类分析
隶属函数值法能避免单一指标的片面性[18-19],可较为全面、准确地反映高粱品系苗期的耐盐性。本实验采用聚类分析将30个高粱品系的9个耐盐指标的隶属函数值进行标准化处理。由图2看出,耐盐级别分为五大类。第 1 类群,包括3560R、10337B、铁10612,共计3个品系,该类群各指标的相对值均较低,属于高度盐敏感品系。第 2 类群,包括吉16、363C等共计5个品系,这些品系的各性状指标相对值相对较小,属于盐敏感品系。第 3 类群,包括07221、BV4等共10个品系,该类群各项指标相对值居中,属于中等耐盐品系。第 4类群,包括辽宁黑高粱后代、L16(白)等共10个品系,该类群各项指标相对值较大,可认定为耐盐品系。第 5类群,包括09305R、67B等,共2个品系,占供试材料的20%。这 4个品系各项指标的相对值均大,可认定为高耐盐品系[20]。
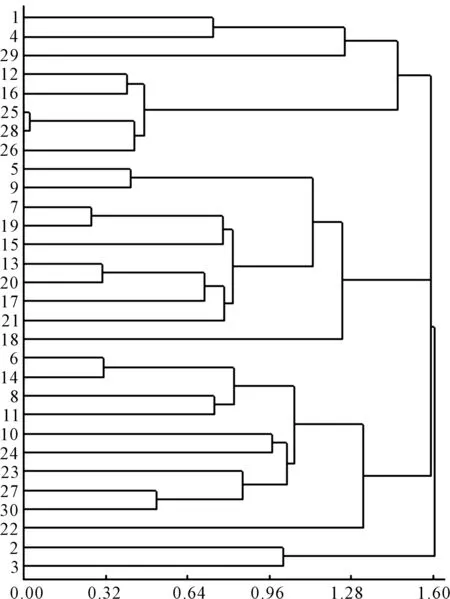
图2 30个高粱品系聚类图Figure 2 Dendrogram of 30 sorghum lines
3 结果与讨论
1)盐胁迫能通过渗透胁迫、离子毒害和离子失衡来抑制植物生长。作物在种子萌发阶段对盐分最敏感, 过量盐分影响高粱发芽和芽苗生长。高粱耐盐性是一个多因素的综合结果, 在高粱生长发育的不同阶段表现出的耐盐特性也不同。萌发期是高粱群体数量建成的关键时期,萌发期极易受盐胁迫环境的影响, 所以在萌发期筛选出具有耐盐能力的品种对于农业生产有重要意义。将以上筛选出30份材料进行苗期试验。于苗期播种后第7、10、13、15、17天统计高粱苗高度,盐胁迫下50份高粱亲本材料生长情况有明显区别,特别是在播种后15d后。材料09305R、67B、07221三尺三、L16(白)、3438表现出较好的耐盐性,3560R、10337B、SPP1表现出盐敏性。
2)本试验选用高粱发芽率、发芽时、根长、苗高、生长速率和枯萎指数等9个相关指标作为高粱耐盐的重要指标。
3)本实验主成分分析表明:萌发生长因子、生长因子、盐害系数反映了高粱耐盐的特性。利用聚类分析法把30份亲本材料分成高度耐盐型、耐盐型、中等耐盐型、盐敏感型和高度盐敏感型品种 5大类。
参考文献:
[1] 赵可夫, 李法曾. 中国盐生植物[M]. 北京: 科学出版社, 1999: 1-6.
[2] 孙璐, 周宇飞.高粱品种萌发期耐盐性筛选与鉴定,中国农业科学,2012,45(9):1714-1722.
[3] 倪先林,赵甘霖,刘天朋,等.SSR分子标记在粒用高粱种质资源遗传多样性分析中的应用[J].江苏农业学报,2015,31(1):16-22.
[4] Wang H, Lin X, Cao S,et al. Alkali tolerance in rice (OryzasativaL): growth,photosynthesis,nitrogen metabolism and ion homeostasis[J]. PHOTOSYNTHETICA,2015,53(1): 55-65.
[5] Wang H L,Chen G L,Zhang H W,et al. Identification of QTLs for salt tolerance at germination and seedling stage ofSorghumbicolorL. Moench [J].Euphytica,2014,196(1):117-127.
[6] 李丰先,周宇飞,王艺陶,等.高粱品种萌发期耐碱性筛选与综合鉴定[J].中国农业科学 ,2013,46(9):1762-1771.
[7] 范娜,白文斌,彭之东,等.盐胁迫对高粱种子萌发及芽期生长的影响,农学学报,2016(9):21-26.
[8] 孙璐,周宇飞,汪澈,等.高粱品种萌发期耐盐性筛选与鉴定[J].中国农业科学 ,2012,45(9):1714-1722.
[9] 何磊,陆兆华,管博,等.盐碱胁迫对甜高粱种子萌发及幼苗生长的影响[J].东北林业大学学报,2012,40(3):67-71.
[10] Kausar A,Ashraf M Y,Ali I,et al.Evaluation of sorghum varieties/lines for salt tolerance using physiological indices as screening tool[J].Pakistan J Bot,2012,44(1): 47-52.
[11] Khalil R M. Molecular and biochemical markers associated with salt tolerance in some sorghum genotypes[J].World Appl Sci J,2013(22):459-469.
[12] Hefny M M,Metwali E M,RMohamed A I.Assessment of genetic diversity of sorghum (SorghumbicolorL. Moench) genotypes under saline irrigation water based on some selection indices[J]. Austr J Crop Sci,2013,7(12): 1935.
[13] 高建明, 夏卜贤, 袁庆华. 高粱种质材料幼苗期耐盐碱性评价,应用生态学报,2012,23(5): 1303-1310.
[14] Sheng M,Tang M,Zhang F, et al. Influence of arbuscular mycorrhiza on organic solutes in maize leaves under salt stress. Mycorrhiza, 2011, 21(5): 423-430.
[15] 孙璐,,周宇飞,汪澈.高粱品种萌发期耐盐性筛选与鉴定, 中国农业科学,2012,45(9):1714-1722.
[16] 张士超, 袁芳, 郭建荣, 利用隶属函数值法对甜高粱苗期耐盐性的综合评价,植物生理学报,2015, 51 (6): 893-902.
[17] 田伯红,王素英,李雅静,等.谷子地方品种发芽期和苗期对NaCl胁迫的反应和耐盐品种筛选.作物学报, 2008, 34(12): 2218-2222.
[18] Zörb C, Schmitt S, Mühling K H. Proteomic changes in maize roots after short-term adjustment to saline growth conditions[J]. Proteomics, 2010, 10(24): 4441-4449.
[19] Sheng M, Tang M, Zhang F, et al. Influence of arbuscular mycorrhiza on organic solutes in maize leaves under salt stress. Mycorrhiza,2011,21(5): 423-430.
[20] Zhu J, Meinzer F C. Efficiency of C-4 photosynthesis in Atriplex lentiformis under salinity stress[J]. Australian Journal of Plant Physiology,1999,26:79-86.

