pH响应的二氧化硅纳米粒子载运阿霉素进行癌症化疗
杨薇,朱圆芳
(安徽化工学校化学工艺教研室,安徽安庆246000)
肿瘤是一种多发性的复杂疾病,主要是在外界致瘤因素影响下,人体内局部组织中的细胞发生异常增生,形成病变的组织肿块[1]。世界卫生组织(WHO)预计,未来二十年里,肿瘤将成为最主要的致死性疾病[2]。为了应对肿瘤带来的巨大威胁,世界各国为此付出了巨大努力,取得了一系列令人欣喜的成果。目前,主要的肿瘤临床治疗方法有手术治疗、放射治疗和化学药物治疗(也称化疗)等[3-5]。相较于前两种治疗方式,化疗这种全身性给药的治疗方法侵入性小,给药方式灵活以及对转移肿瘤有一定疗效,是当前肿瘤治疗的主要方法之一[6]。然而,损伤人体免疫力、诱发心血管疾病以及肝肾功能损伤等都是化疗过程中不可避免的毒副作用。纳米技术的发展,为克服上述化疗过程中的挑战带来了新的机遇。2012年,Jia课题组研制了一种孔径可调的介孔二氧化硅纳米粒子(MS NPs),并利用这种MS NPs载运化疗药物紫杉醇(PTX)构建了实时型载药系统,并在体外抗肿瘤实验中获得了良好的效果[7]。但这种实时型载药系统无法避免药物突释,不能实现体内长时循环和周期给药,因而其进一步的临床应用受到了限制。近年来,基于肿瘤部位pH微环境响应的刺激,响应型载药系统吸引了大量研究人员的关注。这种pH敏感的载药系统能够智能识别肿瘤部位的微酸性环境(pH=6.5),并在此条件下释放出所载运的化疗药物,使肿瘤部位的局部药物长时间维持在较高的浓度范围,从而更加精准地对肿瘤进行化疗[8]。这一独特的优势使得刺激响应型的MSNPs成为当前的研究热点之一。
1 实验部分
1.1 实验原料
聚乙烯吡咯烷酮(PVP)、氨水(NH3·H2O,32 wt.%)、正硅酸乙酯(TEOS)、盐酸(36.0wt.%~38.0wt.%)、磷酸盐缓冲液(PBS)购自国药集团;碘化丙啶(PI)、Hoechst 33342、链霉素、盐酸阿霉素(Dox)、胰酶溶液(25 wt.%)、青霉素、高糖培养基(DMEM)、胎牛血清(FBS)及 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)由上海生工公司提供。
1.2 主要实验仪器
恒温磁力搅拌器、超声波清洗器、电热恒温鼓风干燥箱、真空冷冻干燥机、电子天平、高速离心机、紫外可见分光光度计等。
1.3 MS NPs的制备
按文献方法制备MSNPs并进行下述各项实验[9]。
1.4 药物负载及释放
(1)Dox的负载:取20 mg所制备的MS NPs加入到浓度为100 μg·mL-1的Dox溶液中。超声分散30 min后,于室温下搅拌24 h。所得负载了药物的MSNPs-Dox悬浮液在8000r·min-1离心10 min,用水洗涤3次以除去表面未负载的药物。
(2)Dox的释放:取10 mg的MSNPs-Dox分别加入到10 mL不同pH值(7.4、6.5和5.5)的PBS缓冲液中,37℃下持续振荡。在0~72 h内于不同时间点移去部分溶液离心,测定上清液的紫外可见光谱并绘制释放曲线。
1.5 细胞MTT实验
将Hela细胞以5×103个/孔的密度接种到数个96孔板,并放于含有5%CO2的培养箱(37℃)中培养24 h。然后移去培养基,加入含有不同浓度的MS NPs和MS NPs-Dox的培养基溶液(包含空白对照组),放入培养箱中继续培养24 h。然后用PBS洗涤除去培养基,加入20μLMTT检测液,继续孵化4 h。接着去除上层液,加入100μLDMSO溶液,振荡溶解后使用酶联免疫检测仪检测490 nm处的OD值。由以下公式计算得出细胞存活率值:
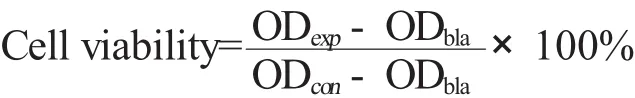
其中,ODbla、ODcon和 ODexp分别为空白组、实验组和对照组的平均吸光值。
2 结果与讨论

图1 (a)Dox负载于MS NPs前后溶液的紫外可见光谱图;(b)不同pH条件下MS NPs-Dox复合物的释药曲线
为了研究所制备的MSNPs载运Dox的性能,分别绘制了Dox被MS NPs负载前后溶液的紫外可见光谱,如图1(a)所示。图中深色曲线为Dox溶液的紫外可见光谱,可以看出,在248 nm有属于Dox的特征吸收峰,由Dox分子中的π-π*跃迁引起,而在490 nm处的次级吸收峰则是由于其中的n-π*跃迁导致的。从图中的浅色曲线可知,在490 nm处出现了与Dox溶液相同的次级吸收峰,表明MS NPs成功地负载了Dox。经计算,MS NPs-Dox复合物中Dox的负载量约为30μg·mg-1,说明所制备的MSNPs是一种容量较大的药物载体。图1(b)则是MSNPs-Dox复合物在不同pH的PBS中的药物释放曲线,其中pH为7.4、6.5和5.5分别模拟了正常生理环境、肿瘤局部微环境和细胞溶酶体内环境的pH条件。从图中可以发现,在pH=7.4时的MSNPs-Dox分散液中,Dox释放速率非常缓慢,24 h后仅释放了约总负载量的8%,而72h后Dox的释放总量约为10%。在pH=6.5时,可以明显看出,Dox释放速率有所增加,24 h后释放了约总负载量的27%,且72 h后Dox的释放总量达到了38%左右。这一结果表明,MSNPs-Dox具有典型的pH响应性,能够在模拟的肿瘤局部微环境中发生pH诱导的药物释放,从而将药物载运至肿瘤部位,实现精准的化疗目的。此外,在pH=5.5的条件下,Dox的释放速率非常迅速,24h后已达到了总负载量的60%左右,并且在72h左右时几乎完全释放出了所负载的Dox。该实验结果充分说明所制备的MS NPs-Dox复合物在进入细胞溶酶体环境后,能够快速地将所负载的化疗药物完全释放出来,从而在短时间内促使肿瘤细胞内部的药物浓度迅速增加,进而导致肿瘤细胞的死亡。因此,所制备的MSNPs是一种性能优异的药物载体,不仅具有较大的药物负载量,还能够对肿瘤部位微环境的pH发生响应,实现pH控制的药物释放过程。
从图2(a)的不同浓度MS NPs与HeLa细胞共培养24 h后的MTT实验结果可知,各浓度下的HeLa细胞存活率均超过90%。该结果表明,所制备的MS NPs具有良好的生物相容性,不影响HeLa细胞的正常生长,因而适合作为药物载体应用于肿瘤治疗领域。为了研究载运Dox后的MSNPs-Dox复合物对HeLa细胞的治疗作用,我们还进行了MS NPs-Dox复合物与HeLa细胞共培养后不同时间点的MTT实验,如图2(b)所示。由图中的结果可知,未加入MS NPs-Dox复合物的HeLa细胞生长状态良好,存活率高达92%左右。加入MS NPs-Dox复合物后,随着培养时间的增加(12、24、36 和 48 h),HeLa细胞的存活率分别下降至约60%、51%、29%和18%。导致这一结果的主要原因是由于HeLa细胞吞噬了大量的MS NPs-Dox复合物,并随着时间的推移,MS NPs-Dox复合物在细胞溶酶体中释放出大量的Dox,进而诱发了HeLa细胞的大范围死亡。因此,所制备的MS NPs是一种性能优异的药物载体,能够在肿瘤细胞内部发生pH响应的药物释放,从而实现对肿瘤细胞的精准治疗。
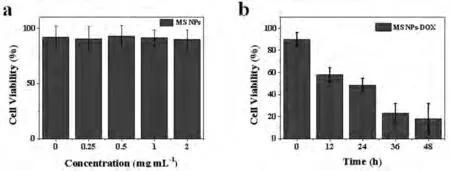
图2 (a)不同浓度的MS NPs与HeLa细胞共培养24 h后的细胞存活率(b)0.5 mg·mL-1的MS NPs-Dox复合物在不同时间点对HeLa细胞的治疗作用
3 结论
综上所述,我们所制备的这种新型的MS NPs具有优异的载药性能,Dox的负载量可高达30μg·mg-1,具有较大的药物载运能力,并且,这种MS NPs还具有pH刺激响应的药物释放能力,在模拟的生理环境、肿瘤部位微环境和肿瘤细胞溶酶体环境中,72 h药物释放总量分别约为10%、38%和99.7%,能够实现对肿瘤细胞的精准治疗。体外抗肿瘤实验的结果证明,0.5mg·mL-1的MS NPs-Dox复合物与HeLa细胞共培养72 h后,可杀死约82%的HeLa细胞,具有非常良好的抗肿瘤作用。
[1]韩志伟.良性肿瘤、恶性肿瘤、类癌、癌前病变息肉[J].中国社区医师,1993(2):3.
[2]Wicki A,Witzigmann D,Balasubramanian V,et al.Nanomedicine in Cancer Therapy:Challenges, Opportunities, and Clinical Applications [J].Journal of Controlled Release,2015,200:138-157.
[3]许百男,周定标.颅内后循环动脉瘤的手术治疗(附17例报告)[J].中华神经外科杂志,2002,18(3):142-144.
[4]王明智.用放射线治疗肿瘤有什么优缺点 [J].抗癌之窗,2012(1):45.
[5]Kaufmann S H,Earnshaw W C.Induction of Apoptosis by Cancer Chemotherapy [J].Experimental Cell Research,2000,256(1):42-49.
[6]张卫,王维利,章新琼.化疗期消化道癌症患者症状群及影响因素研究[J].中国全科医学,2016(1):18.
[7]Jia L,Shen J,Li Z,et al.Successfully Tailoring the Pore Size of Mesoporous Silica Nanoparticles:Exploitation of Delivery Systems for Poorly Water-soluble Drugs [J].International Journal of Pharmaceutics,2012,439(1-2):81-91.
[8]Meng H,Xue M,Xia T,et al.Autonomous in Vitro Anticancer Drug Release from Mesoporous Silica Nanoparticles by pH-sensitive Nanovalves [J].Journal of the American Chemical Society,2010,132(36):12690-12697.
[9]杨薇,朱圆芳.PVP调控制备单分散性的二氧化硅纳米粒子[J].安徽化工,2018(2):72-74.

