利拉鲁肽对肥胖相关性肾病的作用以及与自噬通路的关系
李 娜,郭晶晶,霍琴琴,潘天荣,钟 兴
肥胖相关性肾病(obesity-related glomerulopathy,ORG)是由于肥胖引起机体一系列代谢问题,并由此导致的肾脏病变。利拉鲁肽为胰高血糖素样肽-1(glucagon-like peptide 1,GLP-1)类似物,与天然的GLP-1有97%的同源性,具备GLP-1全部生理作用[1]。研究[2]显示GLP-1能保护肾脏、减轻糖尿病肾病患者蛋白尿症状,延缓糖尿病肾病的进展,但是对于ORG的作用,目前尚不明确。自噬是真核细胞内的蛋白质大分子、细胞器等在自噬溶酶体的作用下被降解的过程。通过研究特异性足细胞Atg5基因敲除小鼠显示,自噬可以保护肾脏并且减少蛋白尿的产生[3]。该研究通过观察ORG小鼠模型的肾脏病理学、血清学指标和尿微量白蛋白,评价利拉鲁肽对ORG的作用及可能机制。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级C57BL/6J雄性小鼠34只,(19.04±0.37)g,购自南京大学-南京生物医药研究所。随机分为正常对照组12只,高脂组22只。
1.1.2主要药物、器材与试剂 利拉鲁肽(商品名诺和力)购自丹麦诺和诺德公司(批号:FP51752-2);ELISA测定试剂盒购自上海源叶生物科技有限公司;Western blot试剂盒购自上海碧云天生物技术有限公司;ADVIA 2400全自动生化分析仪购自德国西门子公司。
1.2实验方法
1.2.1动物模型的建立 小鼠适应性喂养10 d后,随机分为正常对照组12只,高脂组22只,正常对照组予以普通饲料喂养,高脂组予以高脂饲料喂养,高脂饲料配方为猪油6%,胆固醇2%,蛋黄粉10%,胆盐0.2%,基础饲料81.1%,购自江苏省协同生物工程有限责任公司。高脂喂养12周后,在高脂组及正常对照组随机各选取2只小鼠处死,肾脏病理提示高脂组造模成功,将高脂组随机分为利拉鲁肽组10只及肥胖组10只,并继续予以高脂饮食,利拉鲁肽组予以皮下注射利拉鲁肽0.6 mg/(kg·d),肥胖组予以生理盐水0.6 mg/(kg·d),每周测量小鼠体质量,根据体质量变化调整药物剂量,干预12周,期间正常对照组一直予以普通饲料喂养,各组小鼠自由进食水,标准鼠笼饲养,每笼4~5只,温度在20~25 ℃,12/12 h光照黑暗循环(光照时间7:00-19:00)。
1.2.2标本采集 使用小鼠代谢笼收集小鼠24 h尿液,记尿量,离心后取上清液测小鼠24 h尿微量白蛋白。干预至12周末,称取小鼠体质量,内眦取血,离心后取上清液,将小鼠断头处死,迅速取出双侧肾脏,观察双肾大小形态,称取右肾湿重后,切取部分组织用10%的中性福尔马林固定,行石蜡包埋切片,用于HE等染色,余肾脏组织放置-80 ℃冰箱,用于Western blot实验。
1.2.3指标测定 采用HE、PAS染色观察肾脏病理变化;采用ELISA测定小鼠尿微量白蛋白;采用全自动生化分析仪测定小鼠血脂,包括胆固醇(cholesterol,CHO)、三酰甘油(triglyceride,TG)、低密度脂蛋白(low densith lipoprotein,LDL);采用Western blot法测定小鼠肾脏组织的自噬通路相关因子沉默信息调节因子1(silent information regulator 2,SIRT-1)和AMP依赖的蛋白激酶(adenosine 5'-monophosphate (AMP)-activated protein kinase,AMPK)、微管相关蛋白1轻链3(microtubule associated protein1 light chain 3, LC3),以及自噬活性标志物泛素结合蛋白P62的表达。

2 结果
2.1小鼠体质量、右肾湿重及24h尿微量白蛋白变化与正常对照组相比,肥胖组小鼠体质量明显增加,而在利拉鲁肽干预12周后,小鼠体质量较肥胖组明显下降,差异有统计学意义(P<0.05)。与正常对照组相比,肥胖组小鼠尿微量白蛋白明显升高,利拉鲁肽干预12周后尿微量白蛋白较肥胖组明显降低,差异有统计学意义(P<0.05)。见表1。
2.2各组小鼠血TG、CHO和LDL的变化肥胖组TG、CHO、LDL较正常对照组明显升高,差异有统计学意义(P<0.05);利拉鲁肽干预12周后,TG、CHO、LDL较肥胖组明显下降,差异有统计学意义(P<0.05),见表2。
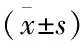
表1 各组小鼠24 h尿白蛋白、体质量及右肾湿重的变化
与正常对照组比较:*P<0.05,与肥胖组比较:#P<0.05
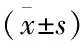
表2 各组小鼠血清TG、CHO、LDL变化
与正常对照组比较:*P<0.05,与肥胖组比较:#P<0.05
2.3各组小鼠肾脏组织病理变化小鼠肾脏HE及PAS染色显示,与正常对照组小鼠相比,肥胖组小鼠肾脏肾小球肥大、系膜基质增多显著,伴有局灶节段性硬化,而在利拉鲁肽干预12周后,肾小球肥大、局灶节段性硬化及系膜基质增多明显改善,见图1。
2.4各组小鼠肾脏自噬通路相关因子SIRT-1、P-AMPK、LC3B、P62蛋白含量比较Western blot法检测结果显示,与正常对照组相比,肥胖组SIRT-1、P-AMPK/AMPK、LC3B含量明显下降,P62含量明显升高,差异有统计学意义(P<0.05);与肥胖组相比,利拉鲁肽组SIRT-1、P-AMPK、LC3B含量明显上升,而P62含量下降,差异有统计学意义(P<0.05),见图2。
3 讨论
随着经济水平的快速发展和生活方式的改变,肥胖的发病率日益增加,肥胖可对包括肾脏在内的多个重要器官造成病理损害[4]。Bonnet et al[5]报道了162例IgA肾病患者20年随访,肾活检时发现在BMI≥25kg/m2的患者中,肾病理改变及肾功能恶化更明显。肥胖的流行导致ORG流行性大幅度增加,ORG早期表现为肾小球滤过率增加及微量白蛋白尿,随着病情进展可出现不同程度蛋白尿,最终可发展为肾功能不全。ORG主要的组织学特点包括肾小球肥大伴或不伴肾小球局灶节段性硬化,系膜基质增加及系膜细胞增殖等[6]。
2001年首次公开利拉鲁肽的动物实验结果,显示给肥胖大鼠模型注射利拉鲁肽可有效减轻肥胖个体的体质量[7]。研究[8]表明,在利拉鲁肽干预治疗4周后,大鼠血清TG、CHO水平明显下降。与上述研究结果一致,本研究也显示,在肥胖组中,小鼠体质量、右肾湿重及血清TG、CHO、LD指标均明显升高,利拉鲁肽干预12周后,小鼠体质量、右肾湿重及血脂水平较肥胖组均显著下降。一项564例肥胖患者的双盲、随机对照研究[9]表明,利拉鲁肽能显著降低肥胖患者的体质量。
动物模型研究[10]显示,GLP-1受体激动剂可有效改善糖尿病大鼠的肾小球肥大,系膜增生及肾小球硬化。本研究在ORG小鼠模型中也观察到,在肥胖组小鼠中,肾脏出现明显的肾小球肥大,伴有局灶节段性硬化,系膜基质增多,肥胖组小鼠24 h尿微量白蛋白明显升高,而在利拉鲁肽干预12周后,小鼠肾脏病理变化及24 h尿微量白蛋白均明显改善。提示利拉鲁肽对ORG有显著的改善。

图1 各组小鼠肾脏组织病理变化 ×400

图2 各组小鼠肾脏组织自噬相关蛋白变化
A:P-AMPK/AMPK ;B:LC3B;C:P62;D:SIRT-1;1:正常对照组;2:肥胖组;3:利拉鲁肽组;与正常对照组比较:*P<0.05;与肥胖组比较:#P<0.05
自噬在清除废物,结构重建,细胞生长发育,蛋白代谢平衡维持和细胞内环境稳定中有重要作用[11]。自噬可受营养感受信号如SIRT-1、mTOR和AMPK的调节。目前有多项研究[12]显示,SIRT-1与AMPK关系密切,白藜芦醇通过SIRT-1刺激AMPK,改善线粒体功能,SIRT-1/AMPK是自噬的经典通路。AMPK是自噬的上游调节因子,AMPK的丧失导致自噬缺陷[13];微管相关蛋白轻链3(LC3)是一种自噬相关蛋白,有LC3I和LC3II(LC3B)两个亚型;与LC3I相比,LC3II定位于自噬泡膜上,对于评价自噬活性更为敏感。P62是自噬的另一种相关蛋白,当自噬低或缺乏时,会发生P62聚集的积累[14]。肾小球足细胞在生理状态下就有较高水平的自噬,自噬抑制剂或敲除自噬相关基因的足细胞的滤过功能降低[15]。相关研究[16]显示在高脂诱导的小鼠肝脏中,GLP-1受体激动剂艾塞那肽通过上调SIRT-1和AMPK磷酸化而改善脂肪肝,在肾脏组织中,GLP-1受体激动剂发挥作用是否与SIRT-1/AMPK通路有关尚不清楚。本研究显示,与正常对照组相比,肥胖小鼠的肾脏中自噬通路蛋白SIRT-1、P-AMPK以及LC3B蛋白明显下降,而P62蛋白的累积明显增多,提示在肥胖小鼠中,自噬活性明显降低;而在利拉鲁肽干预12周后,肾脏自噬通路蛋白SIRT-1、P-AMPK以及LC3B明显升高,P62的累积明显下降,提示利拉鲁肽保护ORG的肾脏,机制可能与改善肾脏的自噬活性有关。
综上所述,从血清学、尿液学检查、肾脏病理学检查及Western blot检测得出,GLP-1受体激动剂利拉鲁肽能够改善ORG微量蛋白尿和肾脏病理改变,可能与诱导ORG小鼠的自噬活性增加有关,利拉鲁肽有可能成为治疗ORG患者的新型药物。
[1] Wajcberg E, Amarah A. Liraglutide in the management of type 2 diabetes[J]. Drug Des Devel Ther, 2010, 4: 279-90.
[2] Schernthaner G, Mogensen C E, Schernthaner G H. The effects of GLP-1 analogues, DPP-4 inhibitors and SGLT2 inhibitors on the renal system[J]. Diab Vasc Dis Res, 2014, 11(5): 306-23.
[3] Hartleben B, Godel M, Meyer-Schwesinger C, et al. Autophagy influences glomerular disease susceptibility and maintains podocyte homeostasis in aging mice[J]. J Clin Invest, 2010, 120(4): 1084-96.
[4] Morandi A, Maffeis C. Urogenital complications of obesity[J]. Best Pract Res Clin Endocrinol Metab, 2013, 27(2): 209-18.
[5] Bonnet F, Deprele C, Sassolas A, et al. Excessive body weight as a new independent risk factor for clinical and pathological progression in primary IgA nephritis[J]. Am J Kidney Dis, 2001, 37(4): 720-7.
[6] Tefft K M, Shaw D H, Ihle S L, et al. Association between excess body weight and urine protein concentration in healthy dogs[J]. Vet Clin Path, 2014,43(2):255-60.
[7] Larsen P J, Fledelius C, Knudsen L B, et al. Systemic administration of the long-acting GLP-1 derivative NN2211 induces lasting and reversible weight loss in both normal and obese rats[J]. Diabetes, 2001, 50(11): 2530-9.
[8] Astrup A, Rossner S, Van Gaal L, et al. Effects of liraglutide in the treatment of obesity: a randomised, double-blind, placebo-controlled study[J]. Lancet, 2009, 374(9701): 1606-16.
[9] Szczepaniak L S, Babcock E E, Schick F, et al. Measurement of intracellular triglyceride stores by H spectroscopy: validationinvivo[J]. Am J Physiol, 1999, 276(5 Pt 1): E977-89.
[10] Zhou S J, Bai L, Lv L, et al. Liraglutide ameliorates renal injury in streptozotocininduced diabetic rats by activating endothelial nitric oxide synthase activityviathe downregulation of the nuclear factor kappaB pathway[J]. Mol Med Rep, 2014, 10(5): 2587-94.
[11] Zhang Z, Shao Z, Xiong L, et al. Expression of Beclin1 in osteosarcoma and the effects of down-regulation of autophagy on the chemotherapeutic sensitivity[J]. J Huazhong Univ Sci Technolog Med Sci, 2009, 29(6): 737-40.
[12] Price N L, Gomes A P, Ling A J, et al. SIRT1 is required for AMPK activation and the beneficial effects of resveratrol on mitochondrial function[J]. Cell Metab, 2012, 15(5): 675-90.
[13] Egan D F, Shackelford D B, Mihaylova M M, et al. Phosphorylation of ULK1 (hATG1) by AMP-activated protein kinase connects energy sensing to mitophagy[J]. Science, 2011, 331(6016): 456-61.
[14] Komatsu M, Waguri S, Koike M, et al. Homeostatic levels of p62 control cytoplasmic inclusion body formation in autophagy-deficient mice[J]. Cell, 2007, 131(6): 1149-63.
[15] Fang L, Zhou Y, Cao H, et al. Autophagy attenuates diabetic glomerular damage through protection of hyperglycemia-induced podocyte injury[J]. PLoS One, 2013, 8(4): e60546.
[16] Xu F, Li Z, Zheng X, et al. SIRT1 mediates the effect of GLP-1 receptor agonist exenatide on ameliorating hepatic steatosis[J]. Diabetes, 2014, 63(11): 3637-46.

