敲减EEF1D的人卵巢癌细胞的构建及其药物敏感性研究
汪慎燚,徐 恰,阮 昕,席 浩,王 鹏,陈 曦,秦宜德
卵巢癌居妇科恶性肿瘤死亡原因的首位,近年来卵巢癌的发病率有明显上升和年轻化趋势,由于其发病隐匿,缺乏普查和有效的早期诊断方法,70%以上的患者就诊时已属于晚期,治疗及预后极差[1]。目前根治卵巢癌的主要方法仍是早期手术切除,而晚期患者主要以顺铂(cis-dichlorodiamineplatinum,DDP)化疗为主,患者易对其产生耐药性,但卵巢癌是高频转移的恶性肿瘤,术后极易复发,所以,控制复发和转移是当今卵巢肿瘤治疗的最大难题之一[2]。生物活性肽在肿瘤治疗中有增敏、增效和减毒的作用,其逆转肿瘤细胞耐药的研究已取得一定的成果[3-6]。从牛酪蛋白酶产物中分离出的六肽(Pro-Gly-Pro-Ile-Pro-Asn,PGPIPN)是具有免疫功能的免疫调节肽[7]。已有报道[8],真核生物翻译延长因子1δ(eukaryotic translation elongation factor 1 delta,EEF1D)可能是PGPIPN的结合靶点,EEF1D的活性高低可能直接影响细胞的耐药性,通过有效的RNA干扰诱导细胞内与其序列同源的靶基因mRNA降解而引起的转录后基因沉默,已成为逆转肿瘤耐药的新策略。该研究旨在通过干扰EEF1D基因表达,探讨DDP/PGPIPN联合用药是否可增强抑制人卵巢癌耐药细胞SKOV3/DDP的生长,观察人卵巢癌耐药细胞DDP、PGPIPN敏感性的影响,为寻求新的卵巢癌治疗方法提供参考。
1 材料与方法
1.1材料
1.1.1细胞株、菌株与载体 人卵巢癌细胞SKOV3、人卵巢癌耐药细胞SKOV3/DDP购自中国医学科学院北京肿瘤研究所;293T细胞由安徽医科大学生物化学与分子生物学实验室保存;慢病毒载体系统pLJM1、Δ8.91、pVSVG由南京医科大学李建民教授惠赠。
1.1.2抗体及主要试剂 相应蛋白的辣根酶标记二抗均购自北京中杉金桥生物技术有限公司;限制性内切酶EcoR Ⅰ、BamH Ⅰ和T4连接酶购自上海生工生物工程股份有限公司;质粒DNA提取试剂盒购自北京索莱宝科技有限公司;Lipofectamine3000购自美国Invitrogen公司;PCR试剂盒购自美国Thermo Fisher公司;引物由上海生工生物工程股份有限公司合成;DMED培养基购自美国GIBCO公司;新生小牛血清购自杭州四季青生物工程材料有限公司;ECL-增强化学发光检测试剂购自上海碧云天生物技术有限公司。
1.2方法
1.2.1细胞培养 SKOV3、SKOV3/DDP细胞采用含10%胎牛血清的DMEM/高糖培养基培养。293T细胞用含10%胎牛血清DMEM/高糖培养基培养。37 ℃、5% CO2饱和湿度的培养环境中培养。当细胞在对数生长期,状态良好并且密度达到约85%时,使用0.4%的胰酶消化后,进行传代、冻存或其他实验。
1.2.2EEF1D的siRNA的设计和筛选 针对人EEF1D基因设计三条siRNA,以Scrambled siRNA为对照,由上海生工生物工程股份有限公司合成。见表1。将合成的siRNA用脂质体(Lipofectamine 3 000)瞬时转染至SKOV3和SKOV3/DDP,用RT-PCR筛选出下调EEF1D效果最佳的siRNA。
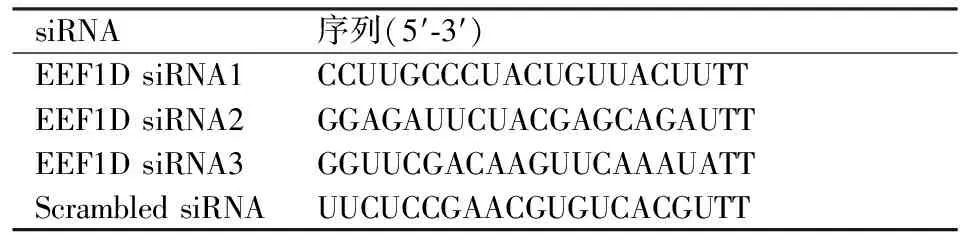
表1 人EEF1D mRNA靶点序列及阴性对照序列
1.2.3慢病毒干涉载体构建及包装 根据筛选出的siRNA设计并合成能表达其发卡结构的shRNA序列。见表2。在其序列末端同时设计有EcoRⅠ和BamHⅠ酶切识别位点。由上海生工生物工程股份有限公司合成。合成的寡链核苷酸模板退火,与双酶切后回收的慢病毒载体pLJM1-shRNA连接。转化DH5α大肠杆菌、挑阳性克隆、提取质粒,由上海生工生物工程股份有限公司测序验证。
取成功构建的重组慢病毒载体pLJM1-shRNA-EEF1D及慢病毒包装辅助质粒(Δ8.91、pVSVG)共转染293T细胞。转染前2 h将细胞培养基更换为Opti-MEM ⅠReduced Serum Medium。转染后培养6 h更换为含血清的完全培养基培养。转染48 h后收集含病毒的上清液,3 000 r/min离心15 min,0.45 μm的滤器过滤去除沉淀,-80 ℃保存备用。
1.2.4孔稀释法测定病毒滴度 测定前1天将对数期状态良好的293T细胞消化稀释至1.0×105/ml,加入96孔板,100 μl/孔,每个病毒6个孔。感染当日将含有病毒的上清液,在EP管中做连续6个10倍梯度稀释。弃去96孔板中原有的培养基,将稀释好的病毒液100 μl/孔加到细胞孔中,继续培养24 h后,每孔加入100 μl新鲜培养液。72 h后观察荧光并计数最大稀释倍数孔中的带有荧光的细胞个数。病毒滴度(TU/ml=荧光细胞个数)×稀释倍数/病毒体积。
1.2.5慢病毒感染目的细胞及稳定筛选 接种状态良好的SKOV3、SKOV3/DDP细胞至6孔板,待细胞融合度达到70%时开始感染病毒。同时向培养基中加入终浓度为6 μg/ml的Polybrene。6 h后更换完全培养基。次日重复感染1次,72 h在显微镜下观察感染情况,加入嘌呤霉素2 μg/ml培养筛选培养2周,直至单克隆细胞群形成。
1.2.6细胞总RNA提取、逆转录和RT-PCR 使用TRIzol总RNA抽提试剂盒提取细胞总RNA,NanoDrop 2 000 C超微量分光光度计测定其浓度和光密度(optical density,OD)OD260/OD280比值,并采用1.5%琼脂糖凝胶电泳对RNA质量进行快速分析。取1 μg总RNA,使用RevertAidTMFirst Strand cDNA Synthesis Kit对RNA进行反转录成总cDNA,并稀释10倍作为RT-PCR模板。利用Premix TaqTM(TaKaRa TaqTMVersion 2.0 plus dye)进行RT-PCR检测,EEF1D上游引物:5′-GTATCTCCCATGCGCCAAGT-3′;下游引物:5′-ATCCAGCAGGATGGAGGACT-3′;扩增长度210 bp。 β-actin上游引物:5′-ATCCAGGCTGTGCTATCCCT-3′;下游引物:5′-TTGCCAATGGTGATGACCTG-3′;扩增长度350 bp。反应体系50 μl,每组样品设置3个重复;PCR反应条件:95 ℃预变性10 min、94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸30 s共30个循环,72 ℃ 10 min。采用2%琼脂糖凝胶电泳分析。
1.2.7细胞总蛋白提取和Western blot 收集细胞前PBS洗2次,加入300 μl RIPA裂解液在冰上裂解30 min,每隔10 min颠倒混匀1次,4 ℃、12 000 r/min离心15 min。取上清加入上样缓冲液100 ℃水浴10 min,用BCA法进行蛋白定量。采用12.5%的SDS-PAGE分离胶电泳分离细胞总蛋白,电转移法将蛋白转移至PVDF膜上。用5%的脱脂牛奶封闭2 h后,与按要求稀释的一抗中4 ℃孵育过夜。次日将TBST洗脱后的PVDF膜置于按要求稀释的二抗中,室温孵育1 h后,TBST洗脱ECL显色。Quantity One软件测定结果,采用β-actin作为内参照,分别以相应蛋白与β-actin光密度比值表示该蛋白质相对表达水平。

表2 筛选的单链及shScrambled DNA序列
1.2.8MTT检测 用0.4%胰蛋白酶消化并收集对数生长期细胞,调整细胞密度,接种至96孔板中,每孔100 μl。次日加入按要求配置的DDP、PGPIPN、PIPIPN/DDP浓度,每一浓度设6个复孔,空白对照加入等体积的培养基,继续培养48 h。每孔加入MTT液(5.0 mg/ml)20 μl,继续培养4 h,弃培养液,每孔加入DMSO 100 μl,振荡混匀5 min。在酶标仪上于490 nm波长处检测每孔OD值,上述实验重复3次。增值抑制率IR(%)=(1-给药组平均OD值/对照组平均OD值)×100%。

2 结果
2.1瞬时转染后EEF1DmRNA表达水平通过Quantity One进行灰度分析,以EEF1D基因与内参照β-actin的灰度值比值作为目的基因的mRNA相对表达量,结果显示与非特异性转染组Scrambled siRNA相比,siRNA3处理后EEF1D mRNA转录明显减少(P<0.05)。见图1。
2.2成功构建pLJM1-shRNA-EEF1D慢病毒载体经双酶切的pLJM1-shRNA与退火后的shRNA连接重组形成慢病毒载体。由DH5α大肠杆菌感受态细胞转化,将转化成功的单个菌落接种于相应的含有氨苄青霉素抗生素的LB培养基,长出克隆后提取质粒,由上海生工生物工程股份有限公司测序证实插入序列正确,说明成功构建载体。见图2、3。
2.3慢病毒包装和滴度测定并感染目的细胞重组慢病毒载体和Negative control表达载体分别和包装辅助质粒共转染293T细胞。采用孔稀释法测定慢病毒滴度为3.08×107TU/ml,见图4。将收集的慢病毒连续2次感染目的细胞,通过puromycin反复筛选得到稳定转染pLJM1-shRNA-EEF1D的SKOV3/DDP细胞株。同样方法获得稳定转染pLJM1-shRNA-Negative control的对照组SKOV3/DDP细胞株。
2.4目的细胞中RNA干扰效果的检测提取非特异性转染组SKOV3 shScrambled、非特异性转染组SKOV3/DDP shScrambled、特异性转染组SKOV3 shEEF1D、特异性转染组SKOV3/DDP shEEF1D、对照组SKOV3与对照组SKOV3/DDP的总RNA和总蛋白,RT-PCR和Western blot分析结果显示SKOV3 shEEF1D与SKOV3/DDP shEEF1D中EEF1D的表达均受到干扰。在mRNA水平上,与SKOV3 shScrambled、SKOV3/DDP shScrambled相比SKOV3 shEEF1D、SKOV3/DDP shEEF1D明显敲减EEF1D mRNA的表达(F=95.94,P<0.05),见图5。在蛋白水平上,SKOV3 shEEF1D、SKOV3/DDP shEEF1D组EEF1D表达量降低(F=133.96,P<0.05),见图6。因此获得稳定敲减EEF1D基因的SKOV3/DDP、SKOV3细胞株用于下一步细胞实验分析。
图1 3条siRNA瞬时转染后对EEF1D mRNA表达的影响
A:瞬时转染后各组β-actin的表达;B:瞬时转染后各组EEF1D 的表达;C:RT-PCR灰度值分析瞬时转染效果;1:EEF1D siRNA1;2:EEF1D siRNA2;3:EEF1D siRNA3;4:Scrambled siRNA;M: Marker;与非特异性转染组Scrambled siRNA相比较:*P<0.05

图2 慢病毒载体构建
A:慢病毒载体质粒双酶切;B:线性化质粒回收;C:空载体与重组载体电泳;M:Marker
2.5MTT检测EEF1D基因敲减前后细胞增殖的影响MTT结果显示通过敲减EEF1D基因,DDP和DDP+PGPIPN对细胞均增强增殖抑制作用,DDP联合PGPIPN具有协同/相加作用,与SKOV3 shScrambled、SKOV3/DDP shScrambled及对照组相比较差异均有统计学意义(P<0.05),且通过敲减EEF1D基因的SKOV3/DDP对DDP的敏感性更高。见图7。
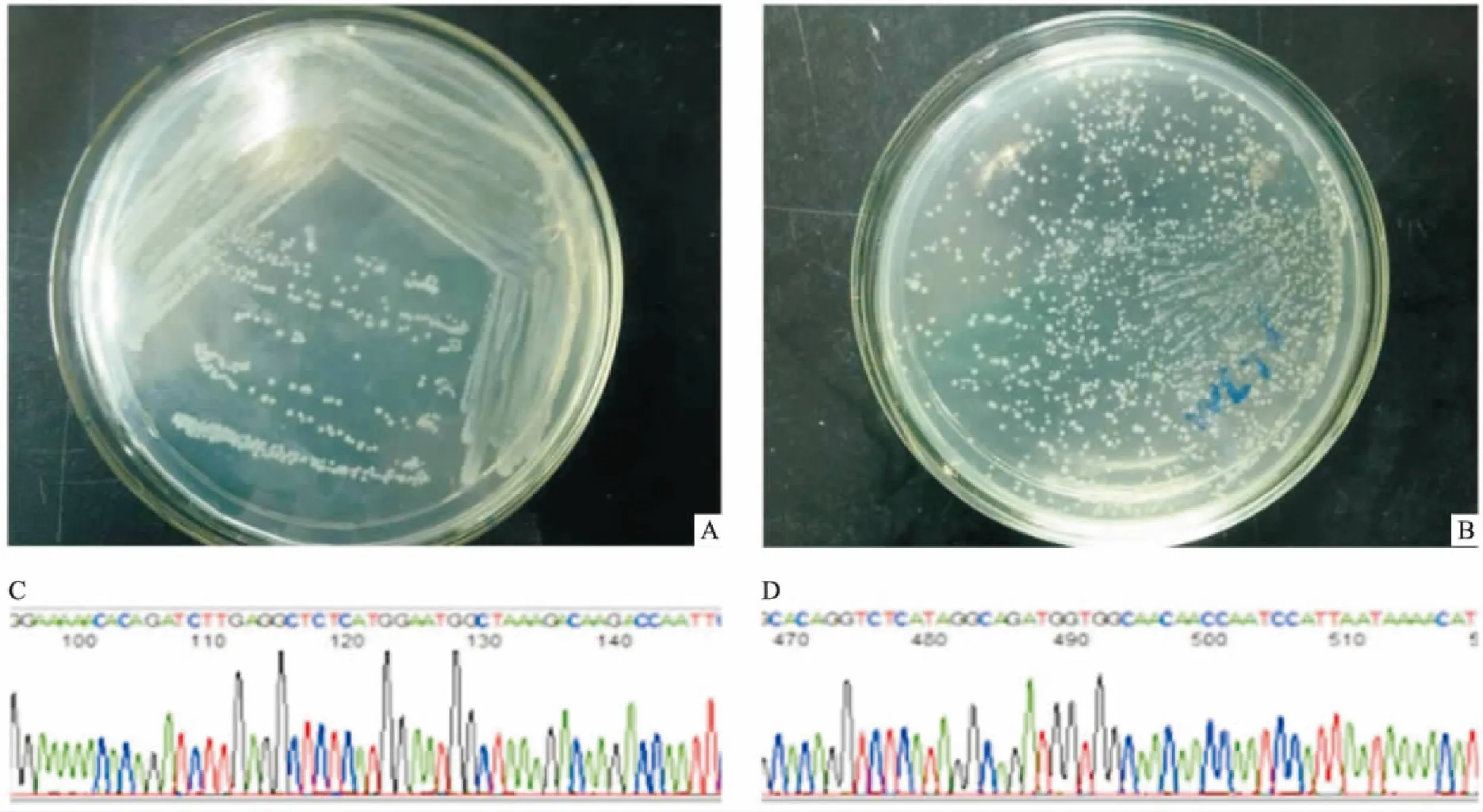
图3 感受态细胞转化与阳性克隆测序鉴定

图4 GFP阳性细胞数测定慢病毒滴度
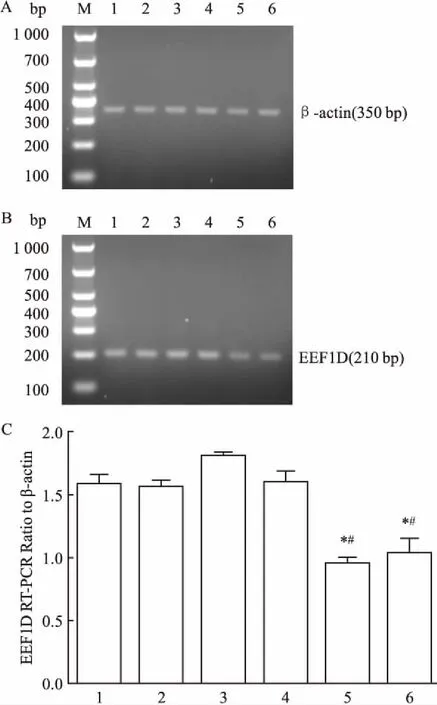
图5 RT-PCR检测RNA干扰前后对细胞内EEF1D基因表达的影响
A:稳定转染后各组β-actin的表达;B:稳定转染后各组EEF1D 的表达;C:RT-PCR灰度值分析稳定转染效果;1:对照组SKOV3;2:对照组SKOV3/DDP;3:非特异性转染组SKOV3 shScrambled;4:非特异性转染组SKOV3/DDP shScrambled;5:特异性转染组SKOV3 shEEF1D;6:特异性转染组SKOV3/DDP shEEF1D;M: Maker;与非特异性转染组相比较:*P<0.05;与对照组比较:#P<0.05
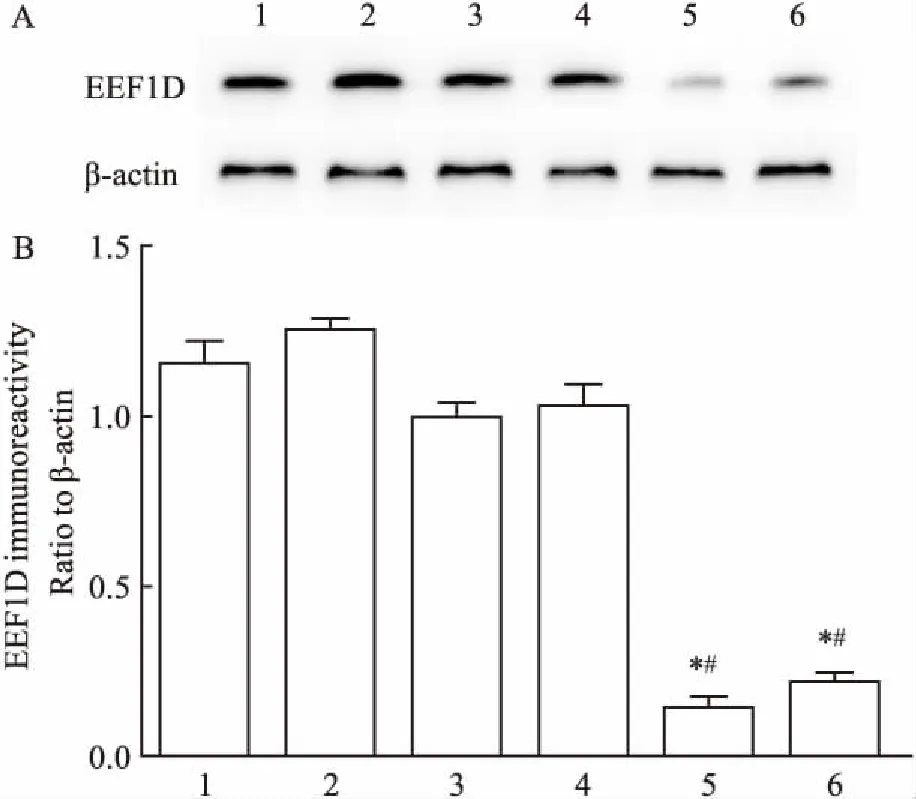
图6 Western blot检测RNA干扰前后对细胞内EEF1D蛋白表达的影响
A:稳定转染后细胞EEF1D和β-actin的蛋白表达;B:Western blot灰度值分析稳定转染效果;1:对照组SKOV3;2:对照组SKOV3/DDP;3:非特异性转染组SKOV3 shScrambled;4:非特异性转染组SKOV3/DDP shScrambled;5:特异性转染组SKOV3 shEEF1D;6:特异性转染组SKOV3/DDP shEEF1D;与非特异性转染组相比较:*P<0.05;与对照组相比较:#P<0.05
3 讨论
EEF1D复合物由非核糖体蛋白酶因子组成,在其GTP结合形式中,通过将氨酰基tRNA分子募集到核糖体来介导蛋白质的合成[9]。有研究[10]表明,EEF1家族的δ可能在癌症中发挥作用。卵巢癌中EEF1D基因过度表达,同时体现在乳腺癌,肝癌,食管癌等其他恶性肿瘤中。Flores et al[11]发现,EEF1D在口腔鳞状细胞癌(OSCC)中过表达,并显示EEF1D和蛋白质相互作用促进激活细胞周期蛋白D1和波形蛋白,通过敲减EEF1D基因的表达,明显抑制OSCC增殖。另一方面,研究[12]通过EEF1D敲减使SNAIL1,ZEB1和ZEB2的表达下调直接激活上皮细胞-间充质转化(EMT)过程增强肿瘤细胞的迁移和侵袭,这说明通过下调EEF1D的表达可以缓解肿瘤的发生。提示着EEF1D在肿瘤的发生和发展中扮演了重要的角色,但是在卵巢癌细胞中,下调EEF1D对卵巢癌细胞的增殖和迁移是否起到抑制作用,国内尚未见报道。
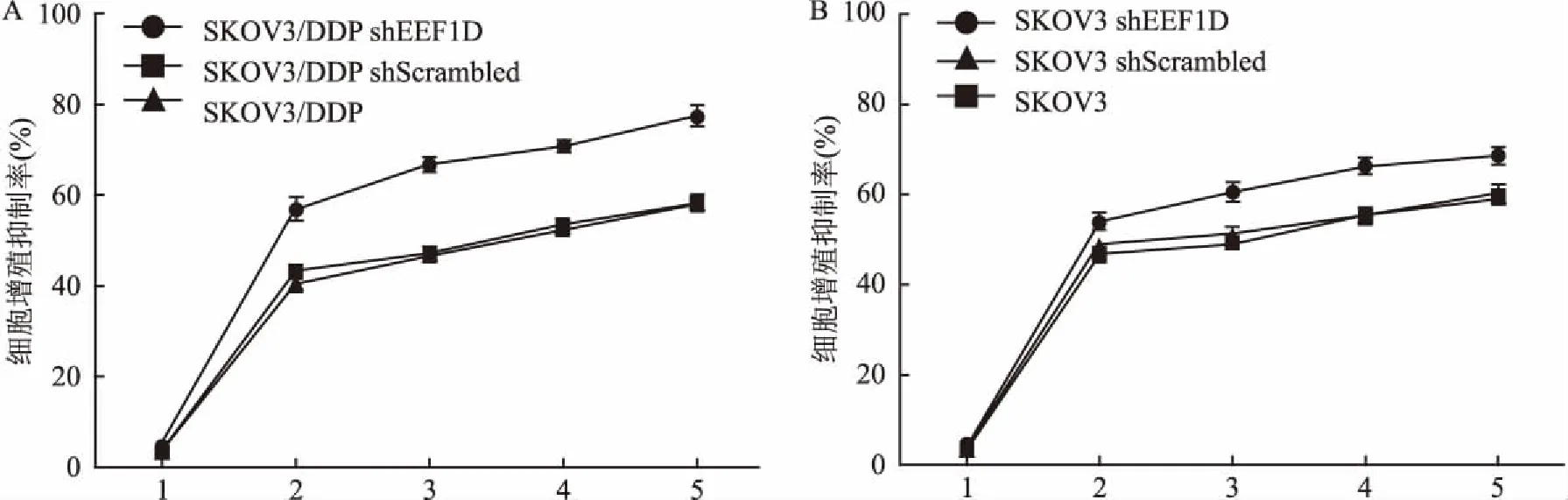
图7 MTT检测EEF1D基因敲减前后细胞增殖的影响
1:PGPIPN;2:DDP;3:DDP+低PGPIPN;4:DDP+中PGPIPN;5:DDP+高PGPIPN;A:各组对卵巢癌耐药细胞株SKOV3/DDP增殖的影响;B:各组对卵巢癌细胞株SKOV3增殖的影响
卵巢癌的化疗耐药是制约卵巢癌治愈率提高的关键因素,卵巢癌化疗耐药是多基因调控的过程,其逆转机制较为复杂,目前研究尚处于探索阶段。有研究认为通过抑制多耐药基因1(MDR1)的功能,可以逆转耐药。已有研究[13]显示一些生物活性肽能够逆转卵巢癌细胞的多药耐药性。乳源六肽PGPIPN是一种生物活性肽,已有研究证明PGPIPN具有提高机体免疫功能、诱导免疫细胞分泌细胞活性因子和诱导肿瘤细胞凋亡等途径而具有抗卵巢癌功能。其机制可能是EEF1D是PGPIPN的结合靶点,间接沉默了EEF1D基因通过激活小G蛋(Ras)而激活MAPK和/或PI3K/Akt信号转导通路,减弱了细胞修复和抗凋亡能力,进而减弱卵巢癌细胞的耐药性[14]。因此结合下调EEF1D的表达,PGPIPN联合抗肿瘤药物用药是否使卵巢癌细胞增殖受到明显的抑制尚不清楚。
本研究通过特异性强、效率高的RNA干扰技术提供了一个逆向研究EEF1D基因在卵巢癌化疗耐药中作用的方法,而设计和构建敲减EEF1D基因的shRNA慢病毒表达载体是本实验的关键[15]。本研究成功构建的重组慢病毒表达载体,经过实验证明明显下调SKOV3/DDP、SKOV3细胞中EEF1D表达,经过嘌呤霉素筛选后获得稳定敲减EEF1D基因的SKOV3/DDP、SKOV3细胞模型。本研究显示对EEF1D敲减后,与对照组相比DDP增强了对细胞增殖抑制率,DDP+高浓度的PGPIPN联合用药明显增强了药物作用,细胞增殖抑制率明显增高,其机制可能是RNA干扰的直接沉默与PGPIPN结合EEF1D靶点间接沉默的叠加结果。与SKOV3细胞相比,通过敲减EEF1D基因的SKOV3/DDP对DDP的敏感性更高,阐述了EEF1D能够在卵巢癌细胞耐药中起调节作用。该研究为进一步探索EEF1D在卵巢癌的化疗耐药中的作用奠定了基础。为乳源生物活性肽抗癌及其逆转癌细胞耐药性带来了新的曙光。
[1] 杨念念,严亚琼,郑荣寿,等. 中国2009年卵巢癌发病与死亡分析[J].中国肿瘤,2013,22(8):617-21.
[2] Avril N,Gourtsoyianni S,Reznek R.Gynecological cancers[J].Methods Mol Biol,2011,727:171-89.
[3] Pelà M,Saxena P,Luciani R,et al.Optimization of peptides that target human thymidylate synthase to inhibit ovarian cancer cell growth[J].J Med Chem,2014,57(4):1355-67.
[4] Sen Z,Zhan X K,Jing J,et al.Chemosensitizing activities of cyclotides from Clitoria ternatea in paclitaxel-resistant lung cancer cells[J].Oncol Lett,2013,5(2):641-4.
[5] Foy K C,Miller M J,Moldovan N,et al.Immunotherapy with HER-2 and VEGF peptide mimics plus metronomic paclitaxel causes superior antineoplastic effects in transplantable and transgenic mouse models of human breast cancer[J].Oncoimmunology,2012,1(7):1004-16.
[6] Radulescu R T. From the RB tumor suppressor to MCR peptides[J].Protein Pept Lett,2014,21(6):589-92.
[7] Català-Clariana S,Benavente F,Giménez E,et al.Identification of bioactive peptides in hypoallergenic infant milk formulas by capillary electrophoresis-mass spectrometry[J].Anal Chim Acta,2010,683(1):119-25.
[8] 魏 彩,秦宜德,桂 丽,等.乳源免疫调节肽体外抑制人卵巢癌细胞侵袭和转移[J].中国药理学报,2013,29(1):42-8.
[9] Dever T E,Green R.The elongation, termination, and recycling phases of translation in eukaryotes[J].Cold Spring Harb Perspect Biol,2012,4(7):a013706.
[10] De Bortoli M,Castellino R C,Lu X Y,et al.Medulloblastoma outcome is adversely associated with overexpression of EEF1D, RPL30, and RPS20 on the long arm of chromosome 8 [J]. BMC Cancer,2006,6:223.
[11] Flores I L,Kawahara R,Miguel MC,et al.EEF1D modulates proliferation and epithelial-mesenchymal transition in oral squamous cell carcinoma[J].Clin Sci (Lond),2016,130(10):785-99.
[12] Shirakihara T,Saitoh M,Miyazono K,et al.Differential regulation of epithelial and mesenchymal markers by deltaEF1 proteins in epithelial mesenchymal transition induced by TGF-beta[J].Mol Biol Cell,2007,18(9):3533-44.
[13] Yan B X,Ma J X,Zhang J,et al.PSP94 contributes to chemoresistance and its peptide derivative PCK3145 represses tumor growth in ovarian cancer[J].Oncogene,2014,33(45):5288-94.
[14] Cullis J,Meiri D,Sandi M J,et al.The RhoGEF GEF-H1 is required for oncogenic RAS signalingviaKSR-1[J].Cancer Cell,2014,25(2):181-95.
[15] Morris K V,Rossi J J.Lentiviral-mediated delivery of siRNAs for antiviral therapy[J].Gene Ther,2006,13(6):553-8.

