腮腺阻塞性萎缩动物模型细胞凋亡及再生的研究
魏月端 左金华 唐学敏 王晶 朱玉红 王丽芳 丁长玲 毛玉龙
涎腺萎缩以腺泡萎缩最为明显,造成唾液腺分泌功能障碍,可引起口腔粘膜炎症,影响语音、吞咽、味觉等,严重时可发生龋病、牙周病等[1]器质性损伤。如何促进萎缩的腺体组织恢复,是目前口腔医学研究的重点之一。本文就结扎腮腺主导管后实现再通,诱导腮腺组织萎缩后再生的大鼠腮腺模型,探究腺体萎缩后腮腺实质细胞再生的机制。
1 材料与方法
1.1 主要试剂和仪器
一抗:PCNA单克隆抗体(ab92552)、P53多克隆抗体(ab131442)(Abcam公司,英国);HE染色试剂盒(上海诺伦生物医药技术有限公司);一步法Tunel细胞凋亡检测试剂盒(绿色FITC标记荧光检测法,通用型,江苏凯基生物技术股份有限公司);Fluorescent Mounting Medium with DAPI(北京中杉金桥生物技术有限公司);激光共聚焦显微镜(Leica,SP5Ⅱ,德国)。
1.2 建立动物模型
成年雄性Wistar大鼠204只,体重约(200±20)g(济南朋悦实验动物繁育有限公司),随机分实验组(198)、对照组(6只)。结扎实验组大鼠右侧腮腺主导管,于结扎7 d(A组)、14 d(B组)、21 d(C组)后(n=66),实现腮腺导管再通,并分别于再通后第0、1、3、5、7、10、14、21、28、60、90 天处死大鼠(n=6),获取新鲜腮腺组织,标本于4%多聚甲醛溶液中固定后制备石蜡块;对照组只解剖分离出腮腺主导管,然后关闭创口。
1.3 HE 染色
制备4μm厚石蜡切片,按照HE染色试剂盒要求进行操作,其中苏木素染色6 min,1%盐酸酒精分化12 s,返蓝15 min,尹红染色30 s,封片后置于显微镜下观察、拍照。
1.4 免疫组化染色
制备4μm厚石蜡切片,按照两步法免疫组化说明书操作,一抗浓度稀释1∶100,4℃过夜,DAB显色,阴性对照片采用一抗稀释液PBS。封片后,显微镜下观察染色结果,每张片子选取5个不重叠视野拍照,计算PCNA、P53平均灰度值。
1.5 Tunel细胞凋亡检测
制备4μm厚石蜡切片,按照一步法TUNEL细胞凋亡检测试剂盒要求脱蜡、脱水,TdT酶反应液、荧光标记液现用现配,37℃避光反应。含DAPI防荧光淬灭封片剂封片后使用激光共聚焦显微镜观察、拍照。
1.6 统计分析
实验数据采用SPSS 13.0统计分析,所有数值均被表达为珋x±s。各组组内差异的比较采用LSD法单因素方差分析,组间比较采用独立样本t检验。P<0.05认为有统计学意义。
2 结果
2.1 组织学观察结果
腮腺主导管结扎7 d后(A组),腺泡萎缩、导管扩张,腺泡/导管比例、腺小叶体积较正常组织降低,再通后第3天,腺泡数量明显增多,主要由未成熟的腺泡和剩余腺泡组成,再通后第10天,腺泡/导管比例几乎与正常组织无差别,再通14 d后,腮腺组织基本完全恢复正常;腮腺主导管结扎14 d时(B组),以大量扩张的导管结构为主,腺泡结构明显减少,再通第5天,扩张的导管明显缩小,腺泡细胞大量增殖,再通第14天,腺泡细胞填满闰管和纹状管之间的间隙,但是腺泡细之间的连接较为疏松,再通第21天时,腺泡与导管比例合适,腺小叶结构较紧密,与正常腺体组织基本相似;腮腺主导管结扎21 d时(C组),导管增殖、扩张更加明显,腺泡细胞很少,仅在腺小叶边缘可见剩余腺泡,随着再通时间延长,未出现上诉A、B两组腮腺组织明显逐渐恢复的现象,部分组腮腺组织甚至逐渐被脂肪等结缔组织取代(图1)。
2.2 免疫组化学观察结果
PCNA及P53蛋白在腮腺内的表达见图 2~3(PCNA蛋白主要表达于腮腺腺泡细胞核,P53蛋白主要表达于腮腺腺泡细胞质)。腮腺主导管结扎7 d后,导管扩张增殖,腺泡细胞萎缩凋亡,PCNA及P53阳性表达率较低,再通后第3天,腺泡细胞大量增生,可见腺泡细胞核内大量阳性表达的PCNA,导管凋亡逐渐增多,P53阳性表达,再通第10天,PCNA、P53趋于稳定,再通第14天,免疫指标与正常对照组无异;腮腺主导管结扎14 d后,导管及腺泡均可见P53阳性表达,PCNA阳性表达主要在导管细胞,再通后第5天,未成熟腺泡及剩余腺泡大量增殖,PCNA高表达,导管细胞凋亡为主,P53阳性表达,再通后第14天,PCNA、P53表达趋于稳定,再通后第21天,PCNA、P53表达指标与正常对照组无差别;腮腺主导管结扎21 d后,PCNA在导管细胞高表达,导管之间的纤维结缔组织可见P53阳性表达,随再通时间延长,PCNA、P53表达量无明显的曲线规律变化,且观察至再通后90 d,未发现萎缩的腮腺恢复至正常。
2.3 细胞凋亡率
正常腮腺中,凋亡细胞(绿色荧光信号标记)较少,导管结扎后,凋亡细胞明显增多,主要表达在腺泡区域,且随导管结扎延长,凋亡的细胞相应的增多(P<0.01),导管再通后,凋亡细胞比例逐渐降低,A组再通第14天、B组再通第21天的凋亡细胞数量与正常组织接近,随着再通时间继续增加,凋亡细胞数量未见明显的波动。C组凋亡细胞随再通时间延长,数量变化高低不稳定,整体呈下降趋势,但是再通第28~90 d,凋亡细胞数量始终未达到正常对照组水平(图4)。
3 讨论
慢性阻塞性涎腺疾病是一种较为常见的涎腺慢性炎症,常见病因有导管结石、导管狭窄、肿瘤压迫等。由于唾液排出障碍及口腔内致病菌逆行感染等,腺体常常反复肿胀、流脓。针对较为严重的慢性阻塞性涎腺疾病的治疗,目前普遍倾向于手术摘除腺体。但是,摘除腺体后所带来的口干等并发症严重影响患者日常生活。当下还没有一种被广泛认可的治疗方式逆转腺体损伤,不能从根本上治愈该疾病。

图1 组织学观察 (HE,×400)Fig 1 Histological observation (HE,×400)

图2 PCNA表达 (IHC,×400)Fig 2 PCNA expression (IHC,×400)
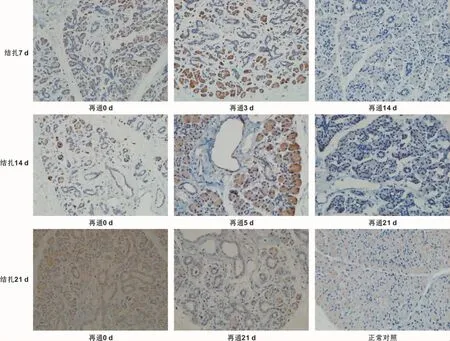
图3 P53表达 (IHC,×400)Fig 3 P53 expression (IHC,×400)

图4 细胞凋亡率Fig 4 Cell apoptosis(Tunel fluorescence detection)
正常腮腺细胞是分支形态、高分化的终末细胞,虽然分化能力较低,但是因腮腺内含有成体干细胞[2](salivary gland adult stem cell,SGASC),赋予腮腺组织自我修复的潜能。SGASC主要分布于较大的排泄管[3],其分布的不均匀性决定了腮腺组织损伤后恢复的速度和程度。正常情况下,腮腺组织保持凋亡与增殖的平衡,干细胞处于相对静止状态,只有当损伤发生时,机体内信号分子才广泛活跃,激活干细胞参与修复机体损伤。PCNA是一种仅在增殖细胞中合成和表达的核蛋白,分为可溶性和不溶性2种,其中不溶性PCNA表达量的变化与DNA合成一致。大鼠肝部分切除诱导肝再生实验已证实,PCNA可作为分析细胞增殖测试的精确指标,是一个分析组织再生的有效参数[4]。随着分子医学的进展,PCNA有可能成为癌症患者随访、预后、治疗等的分子靶点。Xiang等[5]的研究证实,颌下腺经放射损伤后,去氧肾上腺素活化α1受体,可有效提高提高细胞增殖,抑制细胞凋亡。该研究为治疗唾液腺疾病提供另一个新的靶点。
凋亡存在于很多生物学现象,并起到非常重要的作用,与有丝分裂增殖互补相对,共同调节细胞群。P53和Fasl过表达是凋亡活跃性的标志[6]。(murine double minute gene 2,MDM2)通过结合P53基因启动子,抑制P53转录,MDM2表达下调,P53表达增加;前列腺素E2(prostaglandin E2,PGE2)通过增加P53基因转录活性和表达Fasl诱导细胞凋亡;P53也可以诱导Fasl表达激活外源性凋亡途径刺激凋亡;P53表达增加,可上调Bax的表达水平,下调Bcl-2的表达共同完成促进细胞凋亡作用。
本研究观察到:腮腺主导管结扎可诱导腮腺萎缩,此点在高红等[7]的研究已报道过,腺体萎缩从腺小叶中心开始,逐渐向周围延展,并且随着结扎时间延长,P53表达量越高,诱导腺体萎缩越严重。可能是由于腮腺主导管结扎后,导管内压力持续性增大所致。再通后,腺体萎缩可在一定时间内逆转。腮腺主导管结扎7 d组与14 d组再通后,可明显观察到腺体逐渐恢复现象,表现为腺泡内PCNA表达量逐渐升高,促进腺泡细胞增殖,扩张的导管逐渐减少并恢复正常,腺小叶排列由紊乱恢复正常,腺泡/导管比例逐渐接近对照组,且主导管结扎7 d组比14 d组恢复时间短,速度快;腮腺主导管结扎21 d组再通后,腺泡细胞数量非常少,扩张的导管几乎占据全部腺小叶,随着再通时间延长,未出现明显的、规律性的腺小叶恢复情况,甚至有的分组观察到涎腺组织结构被脂肪组织、纤维结缔组织替代。潘光华等[8]诱导颌下腺损伤后再生的模型实验结果显示:涎腺增殖部位的细胞具有干细胞/祖细胞特性。针对本实验,A、B组可实现腮腺再生,而C组失败,可能是由于A、B组结扎时间较短,腮腺内有足够的干细胞分化、增殖,弥补因凋亡引起的细胞损失,但是,C组结扎时间较久,腺体内大多数甚至全部的干细胞遭到破坏,无法分化形成新的细胞,导致腺体萎缩。总之,腮腺主导管结扎后,P53表达水平增高,可促进腺体的萎缩;导管再通后,PCNA表达水平增高,促进萎缩的腺泡细胞再生。PCNA、P53可作为评价慢性萎缩性腮腺炎治疗时机的分子依据,并有可能作为评价腮腺再生手术可行性及效果的观测指标。Takahashi等[9]的研究也证实:腺体萎缩后,导管细胞增殖分化形成新的细胞弥补因凋亡消失的腺泡。腮腺萎缩后再生的速率较快,除干细胞的分化作用外,还有剩余腺泡细胞的自身增殖分裂补充。另外,研究显示,动物腮腺再生的模型与唾液腺胚胎发育的进程相似[10],特别是分泌蛋白,在两者中的表达几乎无差别。动物腮腺组织经试验诱导凋亡后可以恢复的能力,给人类治疗腮腺损伤提供希望。
综上,大鼠腮腺主导管结扎后在一定时间内腮腺组织有再生的能力,这段期间腮腺组织的再通机制研究为临床治疗腮腺萎缩性疾病提供理论基础,未来有可能发展为组织再生研究的重点。但是,腮腺主导管结扎时间超过组织干细胞分化的最低时限,则组织不能再生,需要考虑其他治疗方式,如干细胞移植[11]、组织工程技术[12]等。
[1] Ozdemir T,Fowler EW,Hao Y,et al.Biomaterials-based strategies for salivary gland tissue regeneration[J].Biomater Sci,2016,4(4):592 -604.
[2] Neumann Y,David R,Stiubea-Cohen R,et al.Long-term cryopreservation model of rat salivary gland stem cells for future therapy in irradiated head and neck cancer patients[J].Tissue Eng Part C Methods,2012,18(9):710 -718.
[3] 李志华,易炜,牛道立.涎腺干细胞在放射性口干症中的应用及研究进展[J].国际医学放射学杂志,2015,38(1):25-29.
[4] Sobral FA,Daga H,Rasera HN,et al.Tranexamic acid action on liver regeneration after partial hepatectomy:Experimental model in rats[J].Arq Bras Cir Dig,2016,29(2):102-104.
[5] Xiang B,Li XX,Zhang FY.Underlying protective mechanism ofα1-adrenoceptor activation against irradiation-induced damage in rat submandibular gland[J].Arch Oral Biol,2013,58(9):1238 -1245.
[6] Wang J,Li C,Cao Y,et al.Mechanism of QSYQ on antiapoptosis mediated by different subtypes of cyclooxygenase in AMI induced heart failure rats[J].BMCComplement Altern Med,2015,15:352.
[7] 高红,左金华,王丽芳,等.Bcl-2及Bax在大鼠腺体萎缩过程中的表达及临床意义[J].实用口腔医学杂志,2016,32(6):758-762.
[8] 潘光华,陈伟,张霓霓,等.SD大鼠下颌下腺主导管结扎损伤及再通后的组织学观察[J].实用口腔医学杂志,2012,28(5):570-573.
[9] Takahashi S,Shinzato K,Nakamura S,et al.Cell death and cell proliferation in the regeneration of atrophied rat submandibular glands after duct ligation[J].J Oral Pathol Med,2004,33(1):23-29.
[10] Carpenter GH,Cotroneo E.Salivary gland regeneration[J].Front Oral Biol,2010,14:107 -128.
[11] Ono H,Obana A,Usami Y,et al.Regenerating salivary glands in the microenvironment of induced pluripotent stem cells[J].Biomed Res Int,2015,2015:293570.
[12] Ogawa M,Tsuji T.Functional salivary gland regeneration as the next generation of organ replacement regenerative therapy[J].Odontology,2015,103(3):248 -257.

