自固化磷酸钙复合材料辅助即刻种植的实验研究
李万韬 王天珏 李元 吴迪 张述寅 莫静珍 胡开进 周宏志
拔牙后即刻植入种植体可保存牙槽嵴高度和宽度,减少手术次数,早期恢复咀嚼功能及美观[1]。大量研究已证实即刻种植的可靠性[2],但即刻种植体与牙槽窝壁之间的空隙对其初期稳定性或后期愈合的可能影响仍是困扰临床实践的主要问题[3-5]。骨移植可有效解决这些问题,使用人工合成骨替代材料则可以避免自体骨移植引起的供区创伤,目前骨替代材料的成骨效率和使用标准仍有争议[6-7],有必要利用组织工程技术在材料的形态结构、力学性质、和生物活性构建等方面作出更多的尝试和研究[8]。
自固化磷酸钙(calcium phosphate cement,CPC)粉体与水混合后的浆体(糊体)具有可塑性乃至可注射性,便于充填不规则骨腔;可在人体温湿度环境中自行固化,形成较好的负载强度;固化反应产生类似骨无机质的羟磷灰石等结晶,具有良好生物相容性和骨引导能力[9];可混入生物活性分子制备具有骨诱导能力的复合材料[10]。基于这些特性,本研究探讨利用一种新型CPC复合材料辅助即刻种植,材料中加入P物质 (Substance P,SP)使具备骨诱导活性,加入胶原海绵以增强孔隙结构[11],通过体内实验测量观察CPC复合材料对即刻种植体初期稳定和后期骨愈合的作用。
1 材料与方法
1.1 CPC复合材料的构建
CPC(商品名:瑞邦骨泰)【国食药监械(准)字2013第3460199号,上海瑞邦生物材料有限公司】,为Ca4[PO4]2O和CaHPO4等摩尔混合物;合成 SP(上海生工公司),氨基酸序列RPKPQQFFGLM-NH2(纯度>98%);制备3%(W/V)鼠尾I型胶原溶液,-20℃真空冻干得到1 mm厚胶原海绵,剪为1 mm×1 mm×1 mm颗粒。将SP以10-3mol/L浓度溶于双蒸水,按照2/1的粉/液比将CPC粉与SP溶液混合调拌制备浆体,将胶原海绵颗粒以30%体积比混入,固化后获得CPC复合材料;对照组材料采用CPC与双蒸纯水调拌制备;扫描电镜(卡尔莱司公司,德国)观察材料断面超微结构。
1.2 CPC复合材料辅助固定种植体的稳定性体外测试
自凝树脂制备上颌尖牙牙槽窝模型,填入CPC复合材料或对照单纯CPC材料(n=5),再将牙种植体(10 mm×3.5 mm,Camlog公司,德国)植入材料中央部分,37℃/100%湿度条件下自固化24 h;采用种植体稳定性测量仪 (ISQ,Osstell公司,瑞典)测量种植体ISQ值;采用万能材料试验机 (岛津公司,日本),通过拔出试验测量牙种植体脱位最大阻力,拔出加载速度1 mm/min,拔出距离2 mm。
1.3 CPC复合材料包被种植体的骨愈合能力观察
采用健康成年雄性新西兰白兔(6~8月龄,3.5~4 kg体重,第四军医大学实验动物中心提供),全麻下无菌手术制备股骨骺拔牙窝模型:左股骨下端区域切开皮肤和软组织直至骨面,剥离附着肌肉肌腱暴露骨骺,用圆筒形钻头以160~180圈/s速度制备直径8 mm/深度6 mm种植窝;采用直径4 mm/长度6 mm纯钛实验种植体(西安邦钛生物材料有限公司),包裹CPC复合材料或单纯CPC材料,植入预备好的种植窝(图1),分层缝合伤口;围手术期每日肌注青霉素4 WU/kg共7 d,观察记录动物恢复情况。
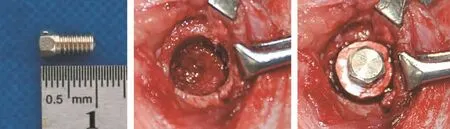
图1 体内植入(CPC)材料包被的种植体Fig 1 In vivo placement of CPC material packed experimental implant
术后4、8周分批处死取材左股骨骨骺,10%中性缓冲福尔马林液固定48 h,PBS冲洗,70%乙醇保存;使用高分辨率Micro-CT(Inveon,德国西门子公司)扫描、以实验种植体中轴为中心三维重建8 mm×6 mm圆柱体,精度40μm,观察种植体周围材料降解与新骨再生情况。标本脱水,树脂包埋,硬组织切片,VG染色,观察种植体骨结合情况。
1.4 统计方法
采用 SPSS 17.0统计软件行方差分析,P<0.05时认为差异有统计学意义。
2 结果
2.1 复合材料内部结构
SEM显示,单纯CPC材料微孔隙多为数微米直径,无超过50μm孔隙;CPC复合材料中胶原海绵基本保持原有形态,从而在CPC内部构建出大孔隙(约300μm)结构。同时,混入SP没有改变CPC的微晶体结构(图2)。
2.2 体外测试种植体稳定性
CPC复合材料易于填充入模型牙槽窝不规则的空腔中,材料固化后可将种植体固定在牙槽窝内。X线片示材料可紧密填充种植体周围间隙,与种植体螺纹及牙槽窝壁贴合良好(图3)。

图2 CPC对照组(A)和CPC复合材料(B)SEM图像(×300)Fig 2 SEM images of CPCcontrol(A)and CPC-composite(B)(×300)
种植体ISQ值测量对照组为74.5±2.8,实验组68.8±1.9(P <0.05)。种植体拔出试验中,由单纯CPC组的种植体的拔出阻力峰值为(96.9±3.3)N,CPC复合材料组的种植体为(74.1±3.6)N(P<0.05)。研究采用小于牙槽窝的牙科种植体,未预备种植孔,完全由实验材料充填固定,因此,牙槽窝模型的材料性质对2种力学测试不构成影响,且初期稳定性均较高。
2.3 体外观察种植体骨愈合
Micro-CT影像显示,术后4周对照组CPC材料基本保持其原有轮廓,术后8周有少量降解,但未见到明确的新骨长入材料降解区表现;实验组CPC复合材料术后4周即有显著降解,并可见骨小梁长入材料降解的空间,术后8周材料已被新骨取代,可见大量骨小梁附着于种植体表面(图4)。
硬组织切片证实,实验组CPC复合材料包被的种植体术后8周实现骨结合,可见结构成熟的新生骨小梁直接接触种植体,而对照组有大量CPC材料位于种植体周围,材料与骨组织之间界限明显,无活跃骨再生表现(图5)。

图3 体外测试CPC材料包埋种植体的初期稳定性Fig 3 In vitro measurement of primary stability of CPC material packed dental implant
3 讨论
理想的骨替代生物材料应满足4项基本要求:能够植入不规则骨腔隙,能够与骨面和种植体表面形成密切接触,能够承受一定负载,能够促进新骨再生。单种材料难以满足这些要求,为此,需要利用再生医学技术构建复合材料,使其不仅具备良好的物理化学性质,还要具备良好的生物相容性、骨引导/诱导活性以及材料内部孔隙结构等关键要素。

图4 Micro-CT图像Fig 4 Micro-CT images

A:CPC对照组;B:CPC复合材料组图5 硬组织切片染色显示组织学特征 (×10)A:CPC control;B:CPC CompositesFig 5 Histology of hard tissue slices (×10)
单纯CPC材料能够基本满足上述4项要求中的前3项,可用于对骨再生速度要求不高的腔状骨缺损的替代修复。但在即刻种植条件下,对于材料降解和新骨长入的同步性有很高的要求,以保证骨愈合过程中种植体有持续的稳定性。神经递质P物质 (SP)可以动员骨髓间充质干细胞,诱导新骨生成和血管生成[12]。本实验采用SP活化CPC,以构建更强的骨再生诱导能力[11],并且将胶原海绵混入CPC浆体固化构成多孔复合材料,以改善CPC孔隙结构,增强SP缓释。体外测试表明,CPC复合材料充填固定的种植体拔出阻力低于对照组,但仍达到74 N左右,拔出牙种植体时施加的力通过种植体螺纹传递并转化为对充填固定材料的剪切力和压缩力。近似于牙种植体咀嚼活动中充填材料受力的性质,其数值大于咀嚼花生时的牙根受力(57.7+/35.7 N),ISQ测试值也接近常规延期种植的种植体ISQ值,保证较高的初期稳定性[13]。体内实验表明,CPC复合材料的降解吸收和新骨长入以较快的速度同时发生,种植体可保持持续的稳定性,并在8周内实现骨结合。本研究中,种植体由自固化材料充填 (或包被)固定于牙槽窝或实验性拔牙窝内,其初期稳定性和后期愈合能力得到初步证实,但其后期的稳定性还有待下一步实验的证实。
综上所述,自固化磷酸钙复合材料辅助即刻种植,可以简化拔牙后种植体植入过程,并避免级差钻孔可能引起的高温骨损伤或压迫性骨损伤,在许多复杂病例中,如根尖区骨缺损、或牙槽窝底贴近下颌神经管/上颌窦等,无法采用常规预备种植孔洞,这种将种植体直接植入原有牙槽窝、通过填充材料固定的方法可能具有更为独特的优势[14-15]。
[1] 宋应亮,邱小倩.下颌后牙残根即刻种植的选择与临床技术[J].实用口腔医学杂志,2013,29(2):295-298.
[2] Truninger TC,Philipp AO,Siegenthaler DW,et al.A prospective,controlled clinical trial evaluating the clinical and radiological outcome after 3 years of immediately placed implants in sockets exhibiting periapical pathology[J].Clin O-ral Implants Res,2011,22(1):20-27.
[3] Ebenezer V,Balakrishnan K,Asir RV,et al.Immediate placement of endosseous implants into the extraction sockets[J].J Pharm Bioallied Sci,2015,7(Suppl 1):S234 -237.
[4] Block MS.Dental extractions and preservation of space for implant placement in molar sites[J].Oral Maxillofac Surg Clin North Am,2015,27(3):353-362.
[5] Lin MH,Mau LP,Cochran DL,et al.Risk assessment of inferior alveolar nerve injury for immediate implant placement in the posterior mandible:A virtual implant placement study[J].J Dent,2014,42(3):263 -270.
[6] Masaki C,Nakamoto T,Mukaibo T,et al.Strategies for alveolar ridge reconstruction and preservation for implant therapy[J].J Prosthodont Res,2015,59(4):220 -228.
[7] Soltan M,Smiler DG,Soltan C,et al.Theoretical model for bone graft success[J].Implant Dent,2012,21(4):295 -301.
[8] Hasturk H,Kantarci A,Ghattas M,et al.The use of light/chemically hardened polymethylmethacrylate,polyhydroxyethylmethacrylate,and calcium hydroxide graft material in combination with polyanhydride around implants in minipigs:Part I:Immediate stability and function[J].J Periodontol,2011,82(9):1339-1352.
[9] 李善昌,苗渡,魏良富.磷酸钙骨水泥与骨形成蛋白复合修复即刻种植牙骨缺损的实验研究[J].口腔医学研究,2003,19(4):255-257.
[10] Zhang J,Liu W,Schnitzler V,et al.Calcium phosphate cements for bone substitution:chemistry,handling and mechanical properties[J].Acta Biomater,2014,10(3):1035-1049.
[11] Wang T,Wu D,Li Y,et al.Substance P incorporation in calcium phosphate cement for dental alveolar bone defect restoration[J].Mater Sci Eng C Mater Biol Appl,2016,69:546-553.
[12] Denry I,Kuhn LT.Design and characterization of calcium phosphate ceramic scaffolds for bone tissue engineering[J].Dent Mater,2016,32(1):43 -53.
[13] Hong HS,Lee J,Lee E,et al.A new role of substance P as an injury-inducible messenger for mobilization of CD29(+)stromal-like cells[J].Nat Med,2009,15(4):425-435.
[14] 徐刚,耿威,林润台,等.自固化磷酸钙骨水泥修复牙种植体周围骨缺损实验研究[J].实用口腔医学杂志,2006,22(4):353-356.
[15] Sutradhar A,Park J,Carrau D,et al.Experimental validation of 3D printed patient-specific implants using digital image correlation and finite element analysis[J].Comput Biol Med,2014,52:8-17.

