血清胱抑素C和肾小管损伤标志物对急性肾损伤诊断价值的研究
伍伟飞
急性肾损伤(AKI)是临床疾病的严重并发症之一,超过50%的患者需收住在ICU治疗[1-2]。因此需尽早识别有发生AKI风险的患者,以实施肾脏保护策略。但是AKI是异质综合征,属于多因素作用导致的临床症状,目前研究发现单一生物标志物的灵敏度和特异度不足,许多新型生物标志物已经用于危重患者的诊治,并发现的几种标志物[IL-18、肾损伤因子-1、中性粒细胞明胶酶相关载脂蛋白、血清胱抑素C(sCysC)]血清肌酐(sCr)升高之前已经发生AKI,但是还没有被应用在临床实践中[3-4]。有研究发现,功能性生物标志物和肾小管损伤生物标志物的组合可以更加准确的预测AKI[5-6]。因此本研究拟评估sCysC、尿N-乙酰-β-D-氨基葡萄糖苷酶(uNAG)和尿白蛋白/肌酐比值(uACR)这些新的生物标志物及其组合在预测危重患者发生AKI的价值。
1 对象和方法
1.1 对象 选择2015年7月至2017年7月我院ICU收治的211例危重患者。纳入标准:(1)门急诊就诊6h内收治到ICU的患者;(2)年龄≥18岁;(3)签署知情同意书。排除标准:(1)入院时伴有终末期肾病;(2)既往行肾切除术,肾移植以及入院前已经使用透析治疗的患者;(3)ICU停留时间<48h。排除50例患者,具体原因:年龄<18岁12例,既往行肾切除术3例,肾移植术后1例,终末期肾病11例,入院前接受过肾脏替代治疗(RRT)13例,拒绝签署知情同意书10例。最终纳入135例患者,男70例(51.9%),女65例(48.1%),平均年龄(59.4±7.0)岁,其中 58例(43.0%)发生 AKI,其余纳入非AKI组。所有患者均由家属签署知情同意书并通过医院伦理委员会审查。
1.2 方法 患者入院后收集性别、年龄、BMI,入院诊断,合并症,APACHEⅡ评分,器官衰竭评估(SOFA)评分,sCr水平,并记录RRT的比例,ICU停留时间和28d删失率(治疗28d内死亡及中途拒绝治疗出院的患者视为删失)。
收治ICU后监测24h液体出入量,保证液体平衡并记录出入量数据。患者收治ICU后1h内同时收集血液和尿样,抽取患者肘静脉血液5ml,在4℃离心10min后,将1ml的血清和血浆等分试样在-80℃立即冷冻,同时收集患者的中段尿,并在收集后24h内测定sCysC、uNAG、uACR水平,入院后每天测定sCr水平。使用 UniCel DxC 800 Synchron系统(Beckman Coulter,Brea,CA,USA)测量 sCysC 和 sCr,尿肌酐,uNAG 和尿白蛋白水平。
脓毒症诊断依据:有明确的感染部位及感染症状,全身多脏器功能的SOFA评分≥2分。AKI的诊断标准由改善全球肾脏疾病预后(KDIGO)分类的肌酐标准定义[7-8],有AKI患者,记录入院时AKI分期,以及收治ICU后48h内AKI的最大分期,sCr和尿量不符合时按照最大分期处理(详见表1)。将以前6个月内sCr浓度最低值作为基线。如果基线sCr不可用,通过使用肾脏疾病改善(MDRD)公式反向计算,估计肾小球滤过率(eGFR)为75ml/(min·1.73m2)[8]。如果患者存在慢性肾脏疾病(CKD),但是以前的sCr结果不可用,再次使用MDRD公式对CKD的相关阶段进行反向计算基线sCr。

表1 AKI的KDIGO分期
1.3 统计学处理 应用SPSS 23.0统计软件,计量资料用±s表示,组间比较采用t检验;计数资料组间比较采用χ2检验,采用方差分析比较AKI不同分期间各生物标志物的差异,使用Spearman相关性检验分析变量之间的相关性,使用逻辑回归模型各标志物与AKI发生率之间的联系。以灵敏度为纵坐标,1-特异度为横坐标绘制ROC曲线来评估不同生物标志物对AKI的诊断价值,对于联合诊断根据多重逻辑回归模型生成的预测概率最佳截止值。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般临床资料的比较 两组患者性别、年龄、入院类型的比较均无统计学差异(均P>0.05);AKI患者中合并有肾功能不全和脓毒症的比例明显高于非AKI患者(均P<0.05)。共有45例(33.3%)入院时并发脓毒症,在AKI组中有31例(53.4%)存在脓毒症。此外,AKI组患者在入院时sCr浓度、APACHE II评分、SOFA评分、乳酸、胆红素等指标均高于无AKI组,差异均有统计学意义(均P<0.05)。AKI组的ICU停留时间和使用肾脏替代疗法均明显高于非AKI组(均P<0.01),两组之间28d删失率无明显统计学差异(P>0.43),详见表 2。
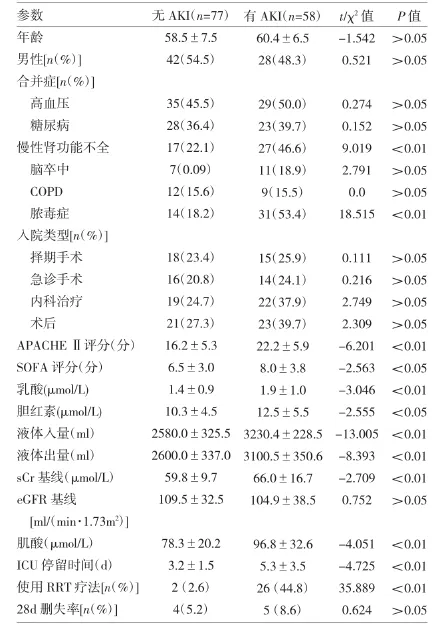
表2 两组患者一般临床资料的比较
在所有发生AKI的58例患者中,入院评估AKI第1期有11例(18.9%);AKI第2期13例(22.4%);AKI第3期有16例(27.6%),其中10例(17.2%)需肾脏替代治疗。收治ICU后24h再次评估,之前无AKI的18例(31%)患者均发生不同程度的肾损伤,此时无AKI患者比例与入院时比较差异有统计学意义(P<0.01)。需肾脏替代治疗的患者26例(44.8%)较入院时明显增多(P<0.01),详见表 3。
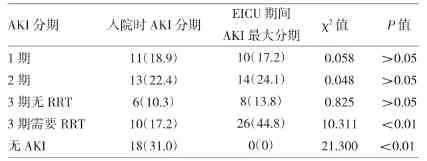
表3 入住ICU后24h内有AKI患者分期情况[例(%)]
2.2 两组及不同AKI分期间3种生物标志物水平的比较 两组患者3种生物标志物均有统计学差异(均P<0.01),详见表 4。uNAG 和 uACR 在第 1、2、3期之间差异均有统计学意义(均P<0.01),但在第1期和第2期之间两者差异均无统计学意义(均P>0.05),并且在第3期是否需RRT治疗之间差异均无统计学意义(均P>0.05),详见表5。

表4 两组患者3种生物标志物的比较
2.3 sCysC、uNAG和uACR相关性分析结果 3种生物标志物之间均呈正相关,sCysC与uNAG(r=0.731,P<0.01),sCysC 与 uACR(r=0.70,P<0.01),uNAG 与uACR(r=0.651,P<0.01),详见图1-3。
2.4 各生物标志物ROC曲线分析结果 为了提高这些生物标志物在AKI检测中的表现,本研究选择了3种生物标志物的组合(sCysC+uNAG,uNAG+uACR,sCysC+uACR)。单独检测的ROC曲线分析中,sCysC的AUC值高于uNAG和uACR(P<0.01)。sCysC具有高特异度(0.99),但灵敏度有限(0.55)。uNAG具有相对较高的灵敏度(0.84),但特异度较低(0.60)。uACR灵敏度为0.54,特异度为0.76。在联合检测中,根据多重逻辑回归模型生成的预测概率最佳截止值。sCysC+uNAG组的AUC值为0.973,均高于单个生物标志物和其他两个联合组(P<0.01)。sCysC+uNAG组比单个生物标志物或其他两个组显示出更高的特异度和灵敏度(分别为0.99和0.82),见表 6 和图4。
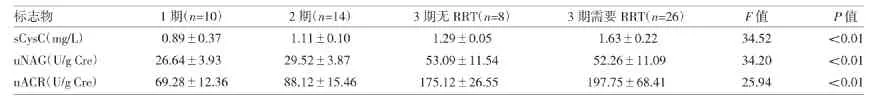
表5 AKI不同分期患者生物标志物的比较

图1 sCysC与uNAG散点图
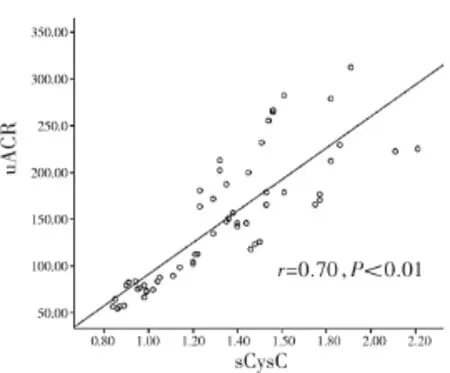
图2 sCysC与uACR散点图
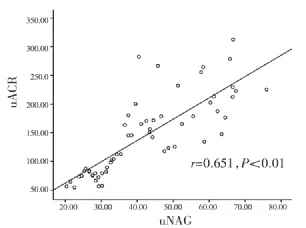
图3 uNAG与uACR散点图

表6 不同标志物之间以及联合检测的ROC分析结果
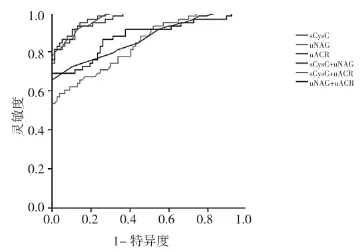
图4 各生物标志物的ROC曲线分析
3 讨论
KDIGO指南中提供了最新AKI的诊断和分期标准,对存在高危因素的患者进行早期诊断,确诊后根据sCr或尿量的动态变化进行临床分期[7-8]。但是sCr和尿量作为诊断或分期指标,依旧存在很多缺陷,不能及时准确地反映肾功能因此,寻找新的早期、敏感、可靠的肾脏损伤标志物是未来的发展方向。近年的研究结果表明,IL-18、肾损伤因子-1、中性粒细胞明胶酶相关载脂蛋白、sCysC等生物学标志物的升高早于sCr、尿素氮改变或尿量变化,并能够动态监测,有望提高AKI诊断的敏感性[9-10]。但由于AKI的复杂性和异质性,临床上多种病理生理机制相互作用,单一指标诊断AKI的效能及价值存在一定的局限性。因此,本研究目的是探讨在危重患者中使用不同生物标志物的组合(sCysC+uNAG,uNAG+uACR,sCysC+uACR)预测AKI发生的价值。
SCysC是肾小球功能标志,在所有有核细胞中产生的SCysC在肾小球中自由滤过并完全吸收,通过近端肾小管细胞分解代谢,并且不被小管分泌到尿液中。因此,SCysC被认为是比sCr更好的肾小球滤过率标志物,可以预测AKI和不良预后[11]。本研究中,sCysC的AUC值显著高于uNAG或uACR。此外,sCysC对预测AKI的特异度远远大于uNAG或uACR,而其灵敏度有限。此外国内外研究认为来自近端和远端肾小管细胞和非肾细胞的uNAG在肾小管损伤后释放到尿液中。由于其分子较大不能通过肾小球滤过,因此是反映肾小管损伤的敏感标志物,同样可以作为预测AKI的生物标志物[12-13]。尽管NAG对反映肾小管损伤敏感,但其对AKI的特异性有限。此外,其对AKI和结果的预测能力也不尽相同[13]。在本研究中,uNAG显示检测AKI的低于中度AUC值。并且对AKI检测的灵敏度高于其特异度(0.84和0.60)。既往研究中有关uACR预测AKI的能力在不同研究中仍存在分歧[14-15],尿白蛋白是肾功能的另一功能生物标志物,研究认为尿白蛋白少量可以通过滤过屏障,被近端小管正常吸收,因为尿白蛋白增加反映了肾小球损伤基底膜的渗透性增加,表明肾小球结构和功能改变[14]。本研究中,uACR预测AKI提示为低到中度AUC值,uNAG可以作为AKI的早期损伤生物标志物也可以预测不良结局。
本研究ROC曲线分析结果表明,sCysC作为AKI检测和预后预测具有高特异度的功能生物标志物,uNAG作为肾小管损伤生物标志物,具有比其更好的特异度和灵敏度。sCysC+uNAG组与单独的生物标志物或其他两组在比较AKI检测时表现出更高的特异度和灵敏度,在检测AKI和预测不良结果方面具有较高的诊断价值,这与其他研究相似[16]。该组合的优势是由于具有高特异度的功能生物标志物和具有高灵敏度的肾小管损伤生物标志物组成的组合反映了肾单位的不同损伤机制。该组的标本包括血清和尿样。尿生物标志物可能对内在组织学损伤更敏感,生物标志物的血清水平可能对清除率的变化更为敏感。本研究表明,在复杂的临床环境中,不同特征和来源的(血清和尿液)标本组合可能为预测AKI发生提供更好的临床策略。这些研究结果与以前的研究结果一致,既往研究表明由功能性生物标志物(血浆CysC)加肾小管损伤生物标志物(尿NGAL)的组合改善了心脏术后患者AKI离散特征的预测能力[17]。本研究发现具有不同灵敏度和特异性的生物标志物的组合改善了诊断性能。此外,uNAG+uACR组和sCysC+uACR组在本研究中没有显著改善诊断性能。可能是由于uNAG+uACR组包含相同的标本来源,sCysC+uACR组包括两个聚集在一起的功能生物标志物,均代表肾小球功能并且享有相同的机制。
本研究的局限性在于,首先测量时间及患者经济情况限制,只进行了一次生物标志物的检测,未能记录sCr、sCysC、肾小管损伤标志物发生变化的早晚时间。其次,本研究为单中心研究,在样本量上有所受限,还需进一步研究证实本研究的结论。本研究的最终结果显示,sCysC与AKI的最坏分期和需要RRT治疗之间具有最强的独立相关性,并且sCysC和uNAG组合对预测AKI的发生具有较高诊断价值。
[1]Meersch M,Volmering S,Zarbock A,et al.Prevention of acute kidney injury[J].Best Pract Res Clin Anaesthesiol,2017,31(3):361-370.doi:10.1016/j.bpa.2017.08.002.
[2]Hoste EA,Bagshaw SM,Bellomo R,et al.Epidemiology of acute kidney injury in critically ill patients:the multinational AKI-EPI study[J].Intensive Care Med, 2015,41 (8):1411-1423. doi:10.1007/s00134-015-3934-7.
[3]Ostermann M,Joannidis M.Acute kidney injury in 2016:diagnosis and diagnostic workup [J].Crit Care,2016,20 (1):299.doi: 10.1186/s13054-016-1478-z.
[4]Xu J,Jiang W,Shen B,et al.Acute Kidney Injury in Cardiac Surgery[J].Contrib Nephrol,2018,193(3):127-136.doi:10.1159/000484969.
[5]Thiengo Dda A,Lugon JR,Graciano ML,et al.Troponin I serum levels predict the need of dialysis in incident sepsis patients with acute kidney injury in the intensive care unit[J].J Bras Nefrol,2015,37(4):433-438.doi:10.5935/0101-2800.20150069.
[6]Buonafine M,Martinez-Martinez E,Jaisser F,et al.More than a simple biomarker:the role of NGAL in cardiovascular and renal diseases[J]. Clin Sci (Lond), 2018,132 (9):909-923. doi: 10.1042/CS20171592.
[7]Kudose S,Hoshi M,Jain S,et al.Renal Histopathologic Findings Associated With Severity of Clinical Acute Kidney Injury[J].Am J Surg Pathol,2018,42(5):625-635.doi:10.1097/PAS.000000000 0001028.
[8]Teles F,de Mendon a Uch a JV,et al.Acute kidney injury in leptospirosis:the Kidney Disease Improving Global Outcomes(KDIGO)criteria and mortality[J].Clin Nephrol,2016,86(12):303-309.doi:10.5414/CN108865.
[9]Vysakh A,Raji NR,Suma D,et al.Role of antioxidant defence,renal toxicity markers and inflammatory cascade in disease progression of acute pyelonephritis in experimental rat model[J].Microb Pathog,2017,109(12):189-194.doi:10.1016/j.micpath.2017.05.047.
[10]Matsuura R,Komaru Y,Miyamoto Y,et al.Response to different furosemide doses predicts AKI progression in ICU patients with elevated plasma NGAL levels[J].Ann Intensive Care,2018,8(1):8.doi:10.1186/s13613-018-0355-0.
[11]Hu Y,Liu H,Du L,et al.Serum Cystatin C Predicts AKI and the Prognosis of Patients in Coronary Care Unit:a Prospective,Observational Study[J].Kidney Blood Press Res,2017,42(6):961-973.doi:10.1159/000485341.
[12]Fujigaki Y,Tamura Y,Nagura M,et al.Unique proximal tubular cell injury and the development of acute kidney injury in adult patients with minimal change nephrotic syndrome[J].BMC Nephrol,2017,18(1):339.doi:10.1186/s12882-017-0756-6.
[13]Lannemyr L,Lundin E,Reinsfelt B,et al.Renal tubular injury during cardiopulmonary bypass as assessed by urinary release of N-acetyl-β-D-glucosaminidase[J].Acta Anaesthesiol Scand,2017,61(9):1075-1083.doi:10.1111/aas.12946.
[14]Wang C,Ma S,Deng B,et al.The predictive value of the product of contrast medium volume and urinary albumin/creatinine ratio in contrast-induced acute kidney injury[J].Ren Fail,2017,39(1):555-560.doi:10.1080/0886022X.2017.
[15]Yang X,Chen C,Tian J,et al.Urinary Angiotensinogen Level Predicts AKIin Acute Decompensated Heart Failure:A Prospective,Two-Stage Study[J].J Am Soc Nephrol,2015,26(8):2032-2041.doi:10.1681/ASN.2014040408.
[16]Deng Y,Chi R,Chen S,et al.Evaluation of clinically available renal biomarkers in critically ill adults:a prospective multicenter observational study[J].Crit Care,2017,21(1):46.doi:10.1186/s13054-017-1626-0.
[17]Basu RK,Wong HR,Krawczeski CD,et al.Combining functional and tubular damage biomarkers improves diagnostic precision for acute kidney injury after cardiac surgery[J].J Am Coll Cardiol,2014,64(25):2753-2762.doi:10.1016/j.jacc.2014.09.066.

