丁苯酞联合阿替普酶对急性缺血性脑卒中患者神经保护作用及血清炎性标志物的影响
曹国军 张行丰 郑科达
近年来随着我国老龄化程度的加重,急性缺血性脑卒中的发病率也逐渐上升[1]。急性缺血性脑卒中的发病机制比较复杂,研究发现,过度失调的炎症反应可能是重要的发病机制之一[2-3]。目前,治疗该病主要采用抗血小板、保护神经细胞、抗凝及溶栓等方法。阿替普酶是新型重组组织型纤溶酶原激活剂,对纤溶酶原的亲和力较强,具有特异性局部溶栓作用[4]。丁苯酞是我国第一个拥有自主知识产权的国家Ⅰ类化学新药,可以有效抑制缺血性脑卒中所致脑损伤的多个病理生理环节,改善脑组织的能量代谢及缺血部位脑组织微循环和血液供应[5]。本研究观察丁苯酞联合阿替普酶治疗急性缺血性脑卒中的疗效,并进一步探讨两药对患者神经的保护作用和血清中相关炎症因子水平的影响,现将结果报道如下。
1 对象和方法
1.1 对象 选择我院神经内科2015年1月至2016年12月收治的分别采用丁苯酞、阿替普酶及两药联合应用的急性缺血性脑卒中患者57、54和49例,所有患者的诊断标准均符合2014中国急性缺血性脑卒中诊治指南的脑血管病标准[6];急性缺血性脑卒中均经过头颅CT或MRI检查证实;年龄18~80岁;发病至入院时间≤4.5h;脑功能损害>1h;病情较为典型。排除CT检查显示有颅内出血及有出血病史者;合并严重脏器功能障碍及基础疾病者;观察期间死亡、失联及临床资料不完整者;有精神疾病、妊娠哺乳期患者。本研究经医院伦理委员会批准,所有患者或授权家属均签署知情同意书。3组患者的基线资料比较,差异均无统计学意义(均P>0.05),见表1。

表1 3组患者基线资料比较
1.2 方法 所有患者均按照近年指南给予常规治疗,主要包括生命体征监测、改善微循环、抗血小板、血糖、血压及并发症控制等常规处理[6]。3组患者均给予阿司匹林片(商品名:欧意,石药集团欧意药业有限公司,批准文号:H13023636,规格:50mg/片),连续使用 90d,根据出血风险及耐受性适当调整剂量及应用时机,推荐剂量:100mg/d,口服或鼻饲管给药。在常规治疗基础上,丁苯酞组应用丁苯酞注射液(商品名:恩必普,中国恩必普药业有限公司,批准文号:H20050299,规格:100ml,含丁苯酞 25mg)100ml,静脉滴注,输液时间>50min,2次/d,连续使用2周,并在24h内开始使用阿司匹林。阿替普酶组给予阿替普酶注射液(商品名:爱通立,德国勃林格殷格翰药业有限公司,批准文号:S20110052,规格:50mg/支),总量为0.9mg/kg,其中10%静脉推注,剩余的90%在1h内静脉滴入,最大剂量<90mg,使用阿替普酶者待溶栓治疗24h后给予阿司匹林。联合组采用丁苯酞联合阿替普酶治疗,在阿替普酶溶栓治疗后间隔6 h给予丁苯酞注射液,给药方案同丁苯酞组和阿替普酶组。
1.3 观察指标 在治疗前,治疗开始后7、14、30和90d,评估患者神经功能评分、测量脑梗死病灶体积、检测血清炎性因子及记录治疗期间不良反应。(1)评估神经功能评分:采用美国国立卫生院神经功能缺损评分(NIHSS)及改良型Rankin量表(mRS)进行评测。(2)测量脑梗死病灶体积:对所有入选患者行头颅CT或颅脑MRI检查,按照Pullicino公式计算,脑梗体积 T(cm3)=π/6×L(最大长轴)×S(短轴)×Slice(层面厚度)。(3)检测血清炎性因子:抽取清晨空腹静脉血5ml,离心、分离血清,采用酶联免疫吸附法(ELISA)检测IL-6和TNF-α,采用免疫投射比浊法检测超敏C反应蛋白(hs-CRP),试剂盒购自浙江汉氏生物科技有限公司,操作严格按照试剂盒的要求进行。同时,观察比较3组患者治疗期间的药物不良反应、出血事件及其它不良事件。所有患者均在出院后随访3个月。
1.4 统计学处理 采用SPSS21.0统计软件,计量资料以±s表示,多组间比较采用方差分析,两两比较采用SNK-q检验;计数资料以百分率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组患者治疗前后NIHSS评分比较见表2。

表2 3组患者治疗前后的NIHSS评分比较(分)
由表2可见,治疗后,联合组各时点的NIHSS评分明显低于丁苯酞组和阿替普酶组,差异均有统计学意义(均P<0.05)。丁苯酞组与阿替普酶组各时点NIHSS评分比较,差异均无统计学意义(均P>0.05)。治疗前,3组患者的NIHSS评分差异无统计学意义(P>0.05)。治疗后 7、14、30、90 d 时,3 组患者的 NIHSS 评分逐渐下降,与治疗前比较,差异均有统计学意义(均P<0.05)。
2.2 3组患者治疗前后mRS评分比较见表3。

表3 3组患者治疗前后的mRS评分比较(分)
由表3可见,治疗后,联合组各时点的mRS评分低于丁苯酞组和阿替普酶组,差异均有统计学意义(均P<0.05)。丁苯酞组与阿替普酶组各时点mRS评分比较,差异均无统计学意义(均P>0.05)。治疗前,3组患者的mRS评分差异无统计学意义(P>0.05)。治疗后7、14、30、90 d 时,3 组患者的 mRS 评分均逐渐下降,与治疗前比较,差异均有统计学意义(均P<0.05)。
2.3 3组患者治疗前后脑梗死体积比较见表4。

表4 3组患者治疗前后的脑梗死体积比较(cm3)
由表4可见,治疗后,联合组各时点的脑梗死体积明显低于丁苯酞组和阿替普酶组,差异均有统计学意义(均P<0.05)。丁苯酞组与阿替普酶组各时点mRS评分比较,差异均无统计学意义(均P>0.05)。治疗前,3组患者的脑梗死体积差异均无统计学意义(均P>0.05)。治疗后7、14、30、90 d时,3组患者的脑梗死体积逐渐下降,与治疗前比较,差异均有统计学意义(均P<0.05)。
2.4 3组患者治疗前后血清炎性因子水平比较见表5。
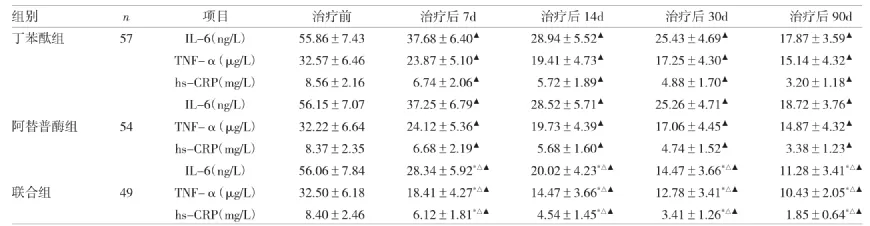
表5 3组患者治疗前后的血清炎性因子水平比较
由表5可见,联合组治疗后各时点血清IL-6、TNF-α和hs-CRP水平均明显低于丁苯酞组和阿替普酶组,差异均有统计学意义(均P<0.05)。丁苯酞组与阿替普酶组血清IL-6、TNF-α和hs-CRP水平比较,差异均无统计学意义(均P>0.05)。治疗前,3组患者的血清IL-6、TNF-α和hs-CRP水平差异无统计学意义(P>0.05)。3 组治疗后 7、14、30、90d,IL-6、TNF-α 和 hs-CRP 水平均逐渐下降,与治疗前比较,差异均有统计学意义(均P<0.05)。
2.5 不良反应 3组患者在治疗过程中均未见严重的药物不良反应发生。丁苯酞组轻微皮疹1例(1.75%),阿替普酶组出现牙龈出血3例(5.56%),联合组患者牙龈出血2例(4.08%)。症状均较轻微,采用对症处理或继续观察后好转,无中断治疗。3组不良反应发生率差异均无统计学意义(均P>0.05)。
3 讨论
缺血性脑卒中又称脑梗死,发病率、致残率均较高,是世界上三大主要的致死疾病之一[7]。近年来关于神经保护剂的作用机制是神经内科一个研究热点,其治疗机制在于阻断脑缺血瀑布反应的不同环节,保护仍存在活力的神经细胞,延长脑细胞缺血耐受时间,增加溶栓治疗时间窗,逆转缺血半暗带,从而挽救残存神经细胞功能[7-8]。丁苯酞是人工合成的消旋正丁基苯酞,可通过提高脑血管内皮NO和PGI2水平,抑制谷氨酸的释放,提高抗氧化酶的活性,抑制血小板的聚集,抑制细胞凋亡,改善脑组织循环和能量代谢,起到治疗脑梗死的作用[9]。阿替普酶是组织纤溶酶原激活物,可有效改善患者的血液黏稠度和凝固特性,抑制血小板的聚集,减少侧支循环的阻力,改善局部微循环,促进缺血损伤的脑组织半暗带的细胞功能[10-11]。
神经功能缺损程度是评估脑卒中治疗效果重要参考指标,NIHSS评分项目多操作相对繁琐,但侧重客观指标评估,可较为准确的评估病情及预后,mRS评分简单易操作,适合快速评估康复效果。本组研究联合应用丁苯酞和阿替普酶治疗急性缺血性脑卒中,结果显示,治疗后3组患者的NIHSS评分、mRS评分均较治疗前均有明显下降,且联合组各时点的NIHSS评分、mRS评分明显低于丁苯酞组和阿替普酶组,差异均有统计学意义。在治疗后各个时点,联合组患者神经功能缺损程度和脑梗死体积改善情况均优于单用阿替普酶和丁苯酞组,提示阿替普酶和丁苯酞联合应用可有效保护患者的神经功能,这与文献报道较一致[12]。有观点认为,阿替普酶和丁苯酞的药理作用机制不同,联合应用可协同增强血管扩张及神经元保护作用,进一步抑制氧自由基释放及损害作用,两者联用可明显促进脑梗死面积缩小[13]。但是,对于存在高出血风险、近期有重大头颅脑外伤史、多叶脑梗死等情况者,属于阿替普酶应用的禁忌证,且在不同时间窗内,阿替普酶的适应症及禁忌证略有差异,临床治疗中应评估风险与受益后决定是否给予溶栓治疗[6]。
急性缺血性脑卒中发生后,脑组织缺血、缺氧、坏死,可激活具有迁移、分化、吞噬和分泌作用的小胶质细胞/巨噬细胞,促进炎性因子分泌,导致炎性反应发生,IL-6、TNF-α和hs-CRP是机体内主要的炎症介质。研究表明,IL-6、TNF-α和hs-CRP等炎性因子与缺血性脑卒中的预后有密切关系[14-15]。黄松等[16]研究显示,阿替酶联合丁苯酞治疗急性脑梗死可明显减少基质金属蛋白酶-9(MMP-9)的水平,调节血管内皮细胞因子水平,有效保护脑细胞功能,改善神经功能。赵晶等[13]研究结果显示,阿替普酶联合丁苯酞治疗急性缺血性脑卒中患者2周后,患者IL-6、IL-8、IL-10及CRP水平均低于单用丁苯酞治疗。本研究结果也显示,3组患者治疗后血清炎性因子均有所下降,且联合组患者治疗后各时点血清IL-6、TNF-α和hs-CRP水平均明显低于阿替普酶和丁苯酞组。这也提示联合应用可有效降低血清炎症因子水平,减轻脑损伤,疗效明显优于单用阿替普酶和丁苯酞治疗。丁苯酞联合阿替普酶治疗急性缺血性脑卒中的可能机制之一是调节IL-6、TNF-α和hs-CRP的水平,但具体机制尚有待更多的基础实验证实[17]。阿替普酶治疗主要的不良反应之一是发生出血,本研究结果显示,治疗期间3组患者不良反应发生率比较均差异无统计学意义,提示评估好出血风险前提下,丁苯酞联合阿替酶治疗急性脑梗死的出血风险可控,具有较好安全性。
综上所述,丁苯酞联合阿替普酶治疗急性缺血性脑卒中的临床疗效更优,可有效降低机体炎症反应,保护神经功能,安全性较好,推荐临床联合应用。然而,本研究仅对获得随访及完整研究资料的患者进行了分析,属于非随机的病例对照研究,且样本量较小,远期影响尚未观察到,需要在大样本、多中心的前瞻性随机对照研究中进一步探索。
[1]万长明.丁苯酞治疗急性脑梗死老年患者的疗效及对血清中S100B、Hcy和ANG-1的影响[J].东南大学学报(医学版),2015,34(1):79-82.doi:10.3969/j.issn.1671-6264.2015.01.018.
[2]Lehmann MF,Kallaur AP,Oliveira SR,et al.Inflammatory and metabolic markers and short-time outcome in patients with acute ischemic stroke in relation to TOAST subtypes[J].Metab Brain Dis,2015,30(6):1417-1428.doi:10.1007/s11011-015-9731-8.
[3]Fullerton HJ,deVeber GA,Hills NK,et al.Inflammatory Biomarkers in Childhood Arterial Ischemic Stroke:Correlates of Stroke Cause and Recurrence [J]. Stroke, 2016, 47 (9):2221-2228. doi:10.1161/STROKEAHA.116.013719.
[4]钟建斌,沈庆煜,陈炽邦,等.超高龄脑梗死患者超早期应用阿替普酶静脉溶栓治疗的效果及安全性[J].实用医学杂志,2016,32(7):1058-1060.doi:10.3969/j.issn.1006-5725.2016.07.007.
[5]郑峥,陈兴泳,程琼,等.丁苯酞注射液治疗进展性脑卒中的疗效及安全性研究[J].中国全科医学,2016,19(3):322-325.doi:10.3969/j.issn.1007-9572.2016.03.017.
[6]中华医学会神经病学分会.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015,48(4):246-257.doi:10.3760/cma.j.issn.1006-7876.2015.04.002.
[7]王妍,张力,刘青志.强化他汀在脑血管疾病中的神经保护作用探讨[J].重庆医学,2015(22):3164-3165.doi:10.3969/j.issn.1671-8348.2015.22.058.
[8]Kanazawa M,Takahashi T,Nishizawa M,et al.Therapeutic Strategies to Attenuate Hemorrhagic Transformation After Tissue Plasminogen Activator Treatment for Acute Ischemic Stroke[J].J Atheroscler Thromb,2017,24(3):240-253.doi:10.5551/jat.RV16006.
[9]张丽娜,安中平.丁苯酞注射液对急性缺血性脑卒中患者认知功能的影响[J].山东医药,2015,55(4):51-52.doi:10.3969/j.issn.1002-266X.2015.04.020.
[10]Bhardwaj A,Sharma G,Raina SK,et al.Advanced Age and Higher National Institutes of Health Stroke Scale Score as Predictors of Poor Outcome in Ischemic Stroke Patients Treated with Alteplase:A Study from a Tertiary Care Centre in Rural North-west India[J].J Neurosci Rural Pract,2017,8(2):236-240.doi:10.4103/jnrp.jnrp_431_16.
[11]戚纪胜,符玲萍.rt-PA动脉溶栓结合丁苯酞治疗急性脑梗死的有效性及安全性 [J].中国老年学杂志,2014,34(13):3642-3644.doi:10.3969/j.issn.1005-9202.2014.13.061.
[12]程超婵,涂汉明,应爱娟,等.阿替普酶联合丁苯酞对急性脑梗死的临床疗效及作用机制研究 [J].中国临床药理学杂志,2015,31(23):2293-2295.doi:10.13699/j.cnki.1001-6821.2015.23.005.
[13]赵晶,赵辉,孔文基,等.阿替普酶联合丁苯酞治疗急性缺血性脑卒中的临床观察[J].中国药房,2016,27(35):4962-4965.doi:10.6039/j.issn.1001-0408.2016.35.21.
[14]Russek NS,Jensen MB.Histological quantification of brain tissue inflammatory cell infiltration after focal cerebral infarction:a systematic review [J].IntJ Neurosci,2014,124 (3):160-165.doi:10.3109/00207454.2013.833509.
[15]Kim JY,Park J,Chang JY,et al.Inflammation after Ischemic Stroke:The Role of Leukocytes and Glial Cells[J].Exp Neurobiol,2016,25(5):241-251.doi:10.5607/en.2016.25.5.241
[16]黄松.阿替普酶联合丁苯酞对脑梗死的疗效和炎性因子的影响[J].基因组学与应用生物学,2017,36(1):18-22.doi:10.13417/j.gab.036.000018.
[17]Zhao Y,Lee JH,Chen D,et al.DL-3-n-butylphthalide induced neuroprotection,regenerative repair,functional recovery and psychological benefits following traumatic brain injury in mice[J].Neurochem Int,2017,111(1):82-92.doi:10.1016/j.neuint.2017.03.017.

