两种组合显色系统用于分枝杆菌快速药物敏感性试验的性能研究
孙战强
结核病是全球范围内重大传染病之一[1]。随着耐多药结核病和广泛耐药结核病疫情的快速上升,简单、快速和高效的结核分枝杆菌药物敏感性试验(简称“药敏试验”)技术成为迫切需求。基于耐药突变基因的分子生物学方法因结核分枝杆菌耐药机制的复杂性,仍不能完全满足临床需求[2]。而细菌学药敏试验和最低抑菌浓度(minimum inhibitory concentration,MIC)的测定成为抗结核新药筛选[3]和个体化精准治疗的重要手段。近年来,基于氧化还原代谢原理并广泛应用于细胞培养、细菌增殖的方法,如阿尔玛蓝法、刃天青法、四唑盐法等显色方法,因简单、快速、价廉等优势在结核分枝杆菌的快速药敏试验中得到广泛应用[4-7]。其中,四唑盐法,尤其是新一代的水溶性四唑盐3,3′-[1-(苯氨酰基)-3,4-四氮唑]-二(4-甲氧基-6-硝基)苯磺酸钠(XTT)因其背景值低、显色快、试剂组合多变、价格低廉等特点使其更具有抗结核药物高通量筛选和快速进行药敏试验的潜能。通常,XTT通过细胞跨膜电子传递系统发生带颜色变化的还原反应,但XTT带有较高的负电荷难以接近或透过细胞膜,显色速度缓慢,一旦加入合适的中间电子受体进行介导则可提高反应速度[8-9]。前期研究中,笔者发现XTT/1-甲氧基-5-甲基酚嗪硫酸甲酯(mPMS)组合显色系统(简称“XTT/mPMS”)可用于抗结核药物高通量筛选[10]。在此基础上,笔者进一步深入检测XTT/mPMS及其对照XTT/2-甲基-1,4-萘醌(mNQ)组合显色系统(简称“XTT/mNQ”)用于分枝杆菌快速药敏试验的性能,并对XTT/mPMS用于结核分枝杆菌临床分离株快速药敏测定的性能进行评估。
材料和方法
1.材料:结核分枝杆菌 H37Ra(ATCC 27294)和牛分枝杆菌BCG(ATCC 35745)由河南省胸科医院提供,耻垢分枝杆菌mc2155为本实验室保存菌株。XTT、mPMS(1-methoxy-PMS)、mNQ(2-methyl-1,4-NQ)、刃天青、利福平(RFP)、异烟肼(INH)、乙胺丁醇(EMB)、链霉素(Sm)、左氧氟沙星(Lfx)等试剂购自美国Sigma公司;米氏7H9(Middlebrook 7H9)培养基和营养添加剂[油酸-白蛋白-右旋糖-过氧化氢酶(OADC)]购自美国BD公司;罗氏培养基购自上海成海公司;中国细菌浊度标准由中国药品生物制品检定所提供(批号为2009-1)。DH6000AB型恒温培养箱(天津市泰斯特仪器厂)、AM-9602A型酶标仪(美国AMIS Medical公司)。
2.菌液制备:参考文献[10],比浊法配制1麦式浓度(约1.5×108CFU/ml)的菌液。即:结核分枝杆菌H37Ra、牛分枝杆菌、耻垢分枝杆菌活化后,挑取单菌落转移至含0.05% Tween-80的7H9-S(7H9+OADC)液体培养基中继续培养。待分枝杆菌生长到对数期后吸取菌液,用2~4 mm的玻璃珠漩涡振荡2~5 min磨菌,比浊法调整菌液浓度至1麦式浓度。
3.试剂制备:XTT、刃天青溶于1×磷酸盐缓冲液(PBS),mPMS溶于双蒸水,mNQ溶于二甲基亚砜,XTT、mPMS和mNQ分别配制成0.2~48.0 mmol/L、0.2~12.8 mmol/L和0.2~12.8 mmol/L浓度。所有试剂用0.22 μm滤膜过滤除菌,4 ℃保存(XTT于-20 ℃保存)备用。使用时各取10 μl单独加样或直接混合后再加样。
4.XTT微量显色检测:将培养好的菌株用7H9培养基稀释并调节浓度。在96孔培养板中每孔加入菌悬液180 μl,分别加入中间电子受体和XTT各10 μl,37 ℃培养2~4 h后采用450 nm酶标仪判读。
5.XTT和中间电子受体(IEAs)浓度优化:正交试验设计,XTT浓度0.0~2.4 mmol/L,mPMS浓度0.00~0.64 mmol/L,mNQ浓度0.0~6.4 mmol/L,培养时间0~8 h,菌悬液浓度(0.0~3.0)×109CFU/ml,每个因子按5个水平分析。根据初步优化结果,采用L25(25)矩阵法进一步优化,将XTT浓度0.00~0.25 mmol/L和IEAs浓度0.00~0.08 mmol/L设置5个水平,进行上述的微量显色检测,最终获得最佳组合浓度,试验重复3次。
6.显色系统稳定性评估:根据上述最佳优化浓度,配制含XTT、mPMS、mNQ、XTT/mPMS和XTT/mNQ的7H9培养基,在96孔板中每孔80 μl,37 ℃培养8 d。将100 μl活化好的耻垢分枝杆菌菌悬液(1.5×108CFU/ml),于每天分别加到上述含显色试剂96孔板的未加过菌悬液的新孔中,再共同培养90 min后于紫外分光光度计判读450 nm 波长处吸光度值(A450值),持续8 d。
分别准备适宜浓度的如下试剂溶液:XTT/mPMS、XTT/mNQ、XTT、mPMS、mNQ,每管40 μl分装到数个500 μl EP管中,于4 ℃和25 ℃不同温度条件储存试剂。每隔5 d取出一管试剂,采用上述的XTT微量显色法进行长时间稳定性检测。
7.药物干扰实验:96微孔板中用7H9液体培养基二倍稀释法将常见抗结核药物RFP、INH、EMB、Sm、Lfx等梯度稀释成一系列的药物浓度(500.00~15.62 μg/ml)。各试验孔再加入20 μl的XTT/mPMS或者XTT/mNQ显色试剂混合物。37 ℃恒温培养15 d,每隔1 d在450 nm波长下检测A450值。各试验孔重复3次。

图a显示XTT/mPMS显色系统,图b显示XTT/mNQ显色系统图1 XTT/IEAs显色系统优化试验
8.细胞毒性试验:在96微孔板中,20 μl XTT/mPMS或XTT/mNQ显色试剂混合物与180 μl耻垢分枝杆菌菌液(1.5×105CFU/ml)37 ℃恒温培养72 h,未加显色试剂的菌液作为阳性对照,每隔6 h取10 μl培养液采用文献[11]方法进行菌落形成单位(CFU)计数。同样的方法在牛分枝杆菌和结核分枝杆菌中共培养18 d,每隔2 d对CFU计数检测1次,每次试验重复3次。
9.XTT/mPMS显色系统临床评估:取药敏试验结果明确(固体培养法)的结核分枝杆菌临床分离株40株[敏感株(S)10株、单耐药(DR)10株、耐多药(MDR)10株、广泛耐药(XDR)10株]。对常见抗结核药物的MIC检测按照文献[4]方法,略有修改。二倍稀释法将抗结核药物用每孔100 μl的 7H9-OADC 液体培养基于96微孔板中进行梯度稀释至如下浓度:128.00~0.25 μg/ml(RFP)、32.00~0.06 μg/ml(INH),生长对照孔不加药物。每孔加入100 μl菌液(0.5麦式浊度,再1∶20稀释),37 ℃恒温培养6~7 d,于第5天每孔加入20 μl的XTT/mPMS显示试剂,再继续培养4 h,显色剂颜色由无色或淡黄色变化为深黄色或棕色,将阻止颜色变化孔所对应的药物浓度判为MIC值。如判读不明显的培养孔继续培养24 h后再判读。刃天青MIC检测方法同上,加入20 μl(浓度为0.1 g/L)显示试剂后培养过夜,再如上述方法判读(蓝色变为紫红色)。药敏折点值设置:RFP为0.5 μg/ml,INH为0.25 μg/ml。
10.统计学分析:采用SPASS 13.0软件进行分析。计算检测效能指标,相关计算公式:敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%。线性判断采用Excel 2007软件中的线性回归分析。
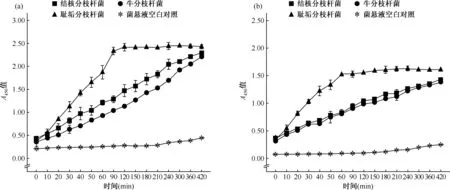
图a显示XTT/mPMS显色系统,图b显示XTT/mNQ显色系统图2 不同菌株在XTT/IEAs显色系统中显色效果与与培养时间的线性关系
结 果
1.显色剂的最优配制比例:根据正交实验分析,多因素与A450值的关系如图1所示。发现在XTT与IEAs共培养中,mPMS的浓度达到0.04 mmol/L后,A450值达到一个平台,而mNQ的浓度达到0.04 mmol/L 后A450值开始降低。 XTT浓度达到0.2 mmol/L后A450值达到2.0,浓度0.25 mmol/L时A450值达到最高。因此,确定两个显色系统的最优浓度为0.2 mmol/L的XTT和0.04 mmol/L的中间电子受体。
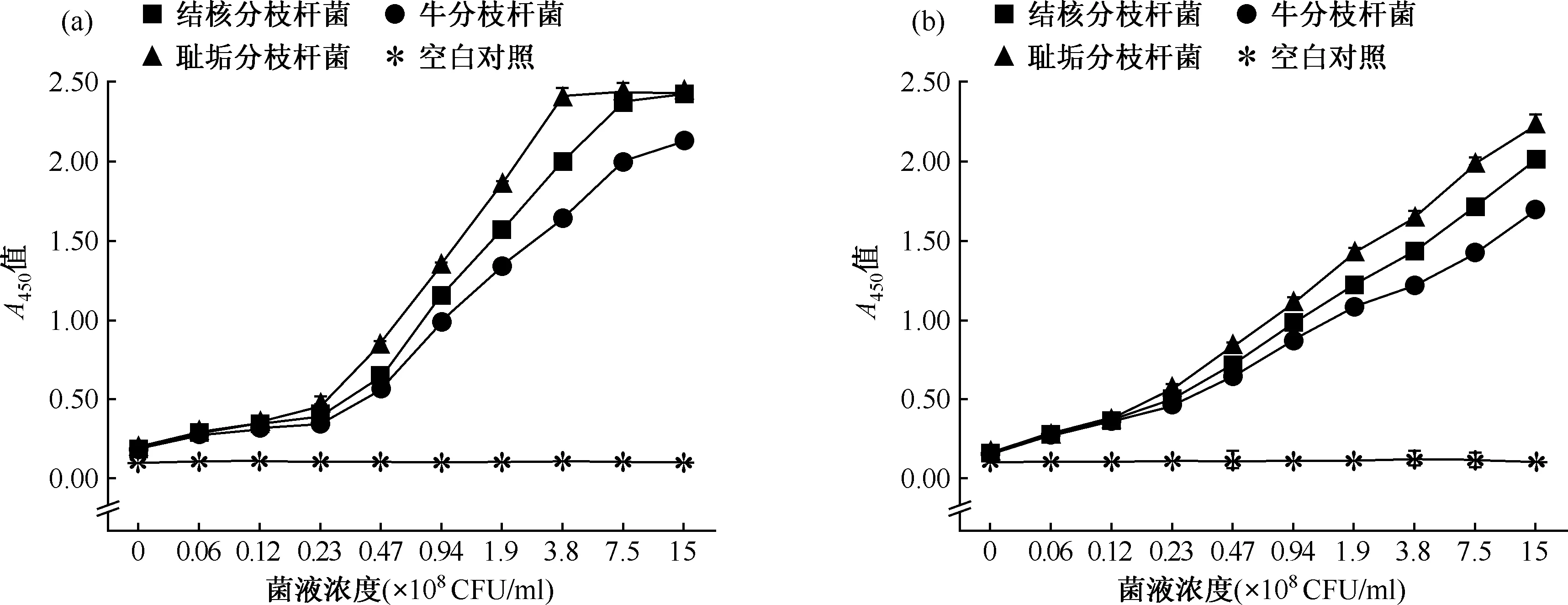
图a显示XTT/mPMS显色系统,图b显示XTT/mNQ显色系统图3 XTT/IEAs显色系统检测限线性范围试验
2.显色系统培养时间:对于耻垢分枝杆菌,XTT/mPMS显色系统的颜色A450值在前90 min内呈线性(图2a),XTT/mNQ显色系统的颜色A450值于60 min就达到平台期(图2b)。对于结核分枝杆菌和牛分枝杆菌,两种显色系统的颜色A450值到420 min仍保持线性(R2值均大于0.9),但XTT/mPMS系统的信噪比更高,其A450值接近0.5(图2)。
3.细胞增殖和敏感度分析:XTT/mPMS 系统的颜色A450值与结核分枝杆菌在2.4×107~7.5×108CFU/ml浓度范围内呈线性关系;对于耻垢分枝杆菌,仅在2.4×107~3.7×108CFU/ml呈线性关系(图3a)。而XTT/mNQ系统具有更宽的线性检测范围(图3b)。 此外,XTT/IEAs的显色反应强度存在种属差异,即生长迅速的耻垢分枝杆菌显色反应强度明显高于其他分枝杆菌(图3)。

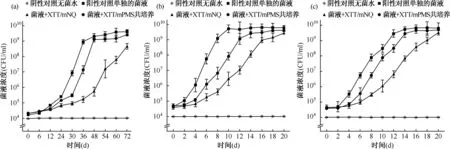
图a、b显示XTT/IEAs显色系统在7H9液体培养基中的稳定性;图a显示XTT/mPMS显色系统,图b显示XTT/mNQ显色系统。图c、d显示XTT/IEAs显色系统在储存条件下的稳定性。图c为显色系统在4 ℃储存1个月, 图d为显色系统在25 ℃储存1个月图4 XTT/IEAs显色系统稳定性试验
4.显色系统稳定性分析:通过不同温度储存条件的试剂稳定性实验发现,XTT/mPMS与7H9培养基共孵育时,其稳定性至少保持7 d(图4a),但同样条件下XTT/mNQ仅能维持2 d(图4b)。导致XTT/mNQ系统稳定性下降的原因是mNQ稳定性差(图4b)。由于在预实验中发现XTT/IEAs热稳定性较低,40 ℃下失效严重,因此未能得到有效的加速破坏实验数据,但得到了25 ℃常温和4 ℃低温储存数据。XTT/mPMS在4 ℃储存条件下,显色性能至少能持续30 d(图4c),而XTT/mNQ系统4 ℃存储5 d后,基本失效(图4c)。与单组分储存方式相比,显色试剂混合物在存储中会发生少量的非细胞还原反应。在25 ℃存储条件下,XTT/mPMS存储10 d后其显色效能开始明显下降,其原因是XTT开始失效(图4d)。而在XTT/mNQ显色系统中,由于mNQ稳定性差,存储到5 d后,其显色性能已明显降低到无法使用(图4d)。
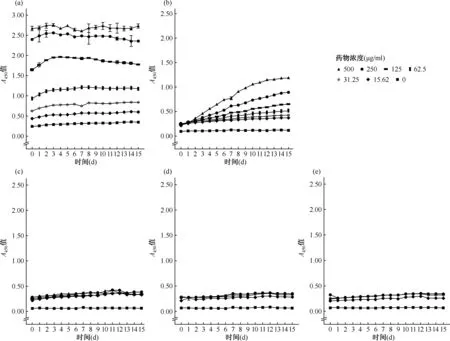
5.显色系统的细胞毒性试验:细胞毒性实验中XTT/mPMS与生长迅速的耻垢分枝杆菌共培养时,可使其到达生长稳定期的时间延后12 h(图5a),但最终到达稳定期的菌落数与对照组接近。在生长缓慢的牛分枝杆菌和结核分枝杆菌中,XTT/mPMS使分枝杆菌到达生长稳定期的时间延后1~2 d,但最终达到稳定期的菌液浓度与对照组接近(图5b,c)。因此XTT/mPMS对分枝杆菌的生长具有较低的细胞毒性。而XTT/mNQ系统与耻垢分枝杆菌、牛分枝杆菌和结核分枝杆菌共培养时,试验组比对照组均出现明显的生长延迟,达到稳定期后,菌液浓度也相对较低(图5)。在3种分枝杆菌中,XTT/mPMS和XTT/mNQ均具有一定的细胞毒性作用,但XTT/mPMS的细胞毒性更低。
图a为耻垢分枝杆菌,图b为牛分枝杆菌,图c为结核分枝杆菌图5 XTT/IEAs 显色系统细胞毒性分析
图a显示RFP干扰,图b显示INH干扰,图c显示Sm干扰,图d显示EMB干扰,图e显示Lfx干扰图6 抗结核药物对XTT/mPMS显色系统的干扰检测
6.XTT/IEAs受抗结核药物干扰检测:显色系统在临床使用中需要和抗结核药物共培养,抗结核药物自身所带颜色可能会干扰显色系统的正常判读;此外,一些抗结核药物可能会与显色系统发生非细胞还原反应。XTT/mPMS系统中,RFP的淡黄色可干扰XTT/mPMS的显色读数,这种干扰具有浓度依赖性,RFP浓度达到62.5 μg/ml以后,本底值已接近1.0,干扰严重(图6a)。在INH中,高浓度的INH与显色系统在共培养7 d以后,吸光度值接近1.0,干扰也比较严重(图6b)。而Sm、EMB、Lfx等抗结核药物均不与XTT/mPMS显色系统发生非细胞还原反应(图6)。
7. XTT/IEAs临床药敏试验检测:选择药敏试验结果已知(固体培养法)的40株结核分枝杆菌临床分离株,同时采用XTT/mPMS和刃天青显色系统进行RFP和INH的MIC检测,结果如表1、2。 XTT/mPMS的药敏试验结果与刃天青一致。在对RFP和INH两种药物的检测中,XTT/mPMS显色法的敏感度和特异度都达到90%以上。阳性预测值和阴性预测值也都比较高。在临床试验中,XTT/mPMS组多在5~6 d获得药敏试验结果,刃天青组多在6~7 d获得药敏试验结果。
讨 论
四唑盐广泛用于动物和微生物的药敏试验、活性、增殖等检测,以及药物筛选。在这些应用中,目前最常用的水溶性四唑盐是XTT,该化合物可产生水溶性甲臢便于后续操作和观察[6, 12]。一般而言,XTT显色系统需搭配IEAs以提高反应速度,作为该显色反应系统核心成分的IEAs,常见的有苯醌、萘醌、蒽醌和吩嗪硫酸甲酯类化合物[8]。前期工作中,笔者通过大量的筛选和测试,发现XTT/mNQ可以用于抗结核药物高通量筛选[10]。因此,笔者预测该显色系统在分枝杆菌快速药敏试验中具有较强的优势。
传统的XTT/mNQ显色系统因其稳定性差,给临床大规模使用造成诸多障碍。首先,XTT/mNQ只能用于分枝杆菌液体培养后的终点加样检测。其次,终点加样步骤增加了实验操作人员的生物安全风险。再次,XTT/mNQ显色系统失效很快,只能是即用型试剂,既难以用于检测试剂盒开发,也给临床实际使用带来巨大浪费。笔者发现,造成XTT/mNQ显色系统失效的主要原因是mNQ的稳定性较差。而XTT/mPMS系统在7H9液体培养基37 ℃ 共培养条件下至少8 d内仍然稳定,表明其具有与分枝杆菌共培养的潜能。即便在25 ℃储存条件,XTT/mPMS仍具有至少保持15 d的稳定性,表明其具有开发成药敏试验试剂盒的潜能。然而遗憾的是,笔者前期研究中已经发现XTT/mPMS会与7H9液体培养基中的营养添加剂OADC发生缓慢的显色反应[10],使其在使用7H9+OADC培养基的分枝杆菌长期共培养快速药敏试验中受限。但这提示,在临床上XTT/mPMS可用于快速生长型非结核分枝杆菌的共培养药敏试验,以及不包含OADC成分的其他液体培养基的长期共培养药敏试验。
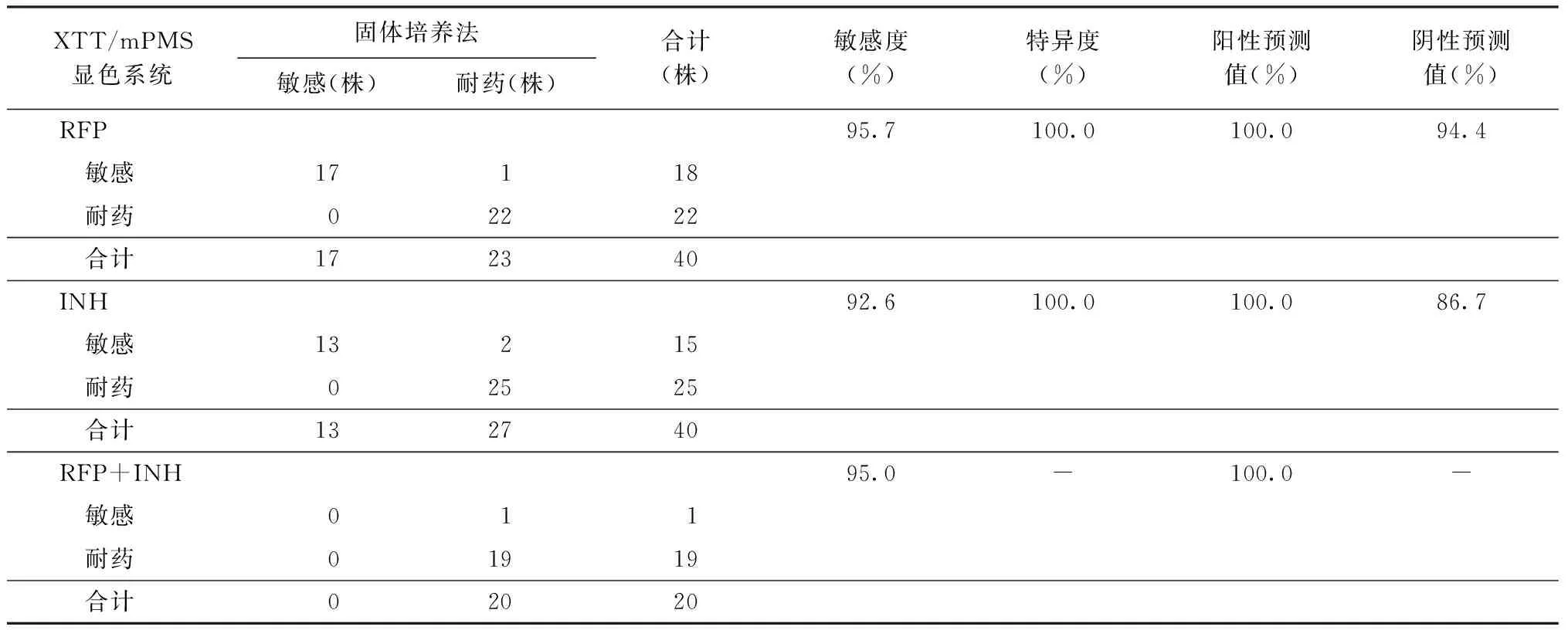
表1 XTT/mPMS显色系统以固体培养法为金标准的耐药检测效能
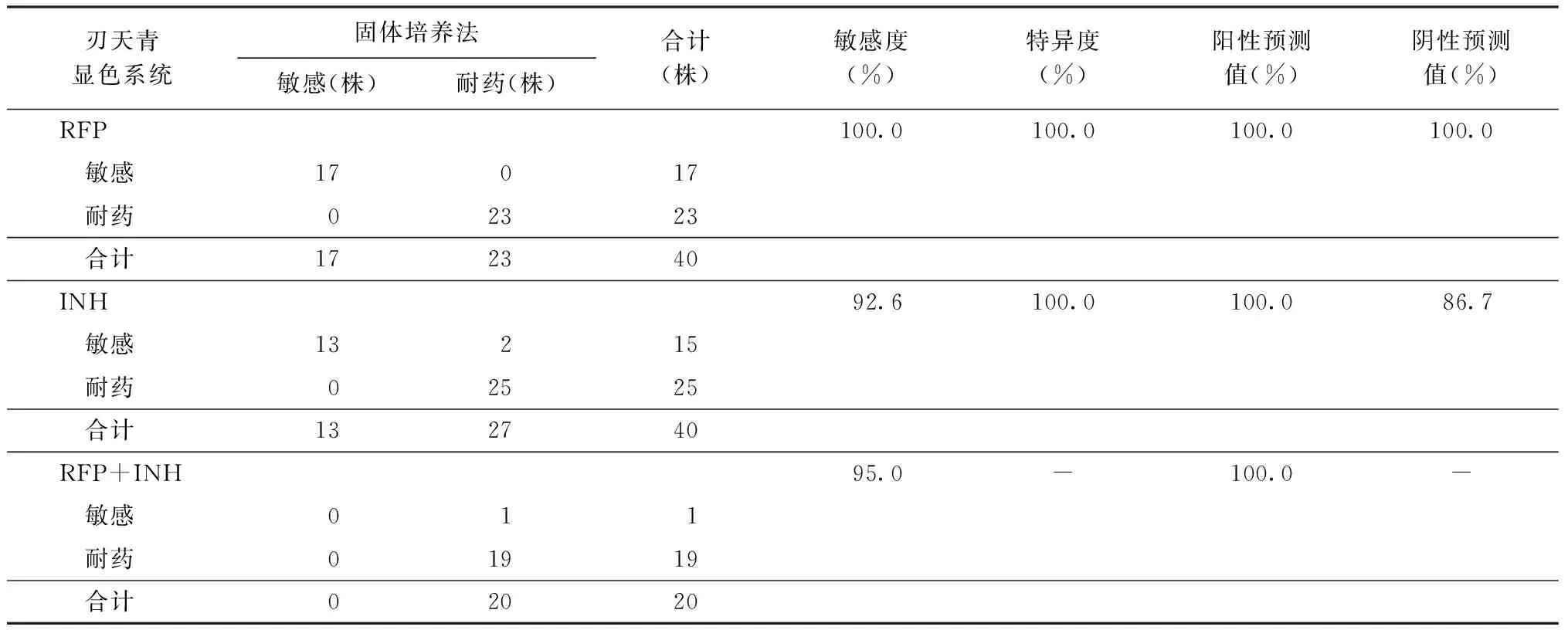
表2 刃天青显色系统以固体培养法为金标准的耐药检测效能
此外,尽管笔者发现高浓度RFP的淡黄色,以及高浓度的INH与XTT/mPMS长时间共培养时可与其发生缓慢的显色反应后的淡黄色,给XTT/mPMS显色判读带来干扰,但实验中的药物测试浓度远高于临床药敏试验的实际使用浓度,因此这一潜在的缺点并不影响临床上的实际使用。
本研究中,XTT的显色反应原理是基于细菌的氧化还原反应,这会依耐于菌株本身的活力。XTT颜色变化时间也高度依赖菌悬液浓度,浓度越高显色越快。一个有趣的现象是,在同样菌液浓度(麦氏1号)下,XTT在耻垢分枝杆菌培养液中颜色A450值达到平台期需要60~90 min,而结核分枝杆菌和牛分枝杆菌中至少需要420 min。这些现象共同表明,分枝杆菌的菌液浓度、种属、细菌活力等因素会影响显色反应的速度和显色强度。因为XTT显色强度具有试剂浓度依耐性,这提示在临床实际使用中可通过适当提高XTT和mPMS试剂的浓度和延长判读时间来弥补以上缺陷。
在临床评估中,笔者发现XTT/mPMS显色系统和刃天青法的药敏试验结果几乎相同。相对于刃天青显色法需要过夜再培养的情况,XTT/mPMS显色系统在加入试剂后2 h即可判读结果,更具有明显的优势。笔者亦发现在MIC肉眼判读时,对于那些颜色反应临界点难以判读的状态,XTT/mPMS的淡黄色比刃天青的蓝色、紫色混合颜色更容易判读(数据未展示)。此外,在临床测试的终点加样中,出现了1例污染,刃天青法因需过夜培养,最终未能准确判读污染样本的MIC值, 而XTT/mPMS终点加样后只需2 h后即可判读结果,规避了终点加样操作引入污染的现象。
综上,笔者对XTT/mPMS在分枝杆菌快速药敏试验的配方优化和性能进行了系统性评估,首次阐明了XTT/mPMS显色系统在分枝杆菌液体培养中的稳定性、细胞毒性、药物干扰反应特性,以及初步的临床药敏检测效能。结果表明,XTT/mPMS显色系统可以用于分枝杆菌快速药敏或MIC检测。本研究为临床上使用简单、廉价、高效的分枝杆菌MIC快速检测、适用于分枝杆菌MIC快速检测共培养试剂的研发,以及基于细菌学的抗分枝杆菌药物高通量筛选技术的运用提供重要参考。
志谢感谢张朝宝同学在研究生阶段参与了预试验和文献检索工作,感谢赵俊伟同学和玄松花同学给予了工作上的协助。感谢武汉医疗救治中心检验科马峻医生及其相关同事对临床实验的支持和帮助。
[1] World Health Organization. Global tuberculosis report 2017. Geneva: World Health Organization, 2017.
[2] Singh JA, Bhan A. The ethics of national tuberculosis programmes in low-income countries not rolling out Xpert®MTB/RIF. Int J Tuberc Lung Dis, 2011, 15(12): 1563.
[3] Khan A, Sarkar D. A simple whole cell based high throughput screening protocol usingMycobacteriumbovisBCG for inhibitors against dormant and active tubercle bacilli. J Microbiol Me-thods, 2008, 73(1): 62-68.
[4] Tan Y, Su B, Zheng H, et al. Prothionamide susceptibility testing ofMycobacteriumtuberculosisusing the resazurin microtitre assay and the BACTECMGIT 960 system. Eur J Clin Microbiol Infect Dis, 2017, 36(5): 779-782.
[5] Singh S, Kumar P, Sharma S, et al. Rapid identification and drug susceptibility testing ofMycobacteriumtuberculosis: Standard operating procedure for non-commercial assays: Part 3: colorimetric redox indicator assay v1.3.12. J Lab Physicians, 2012, 4(2): 120-126.
[6] Singh U, Akhtar S, Mishra A, et al. A novel screening method based on menadione mediated rapid reduction of tetrazolium salt for testing of anti-mycobacterial agents. J Microbiol Methods, 2011, 84(2): 202-207.
[7] 陆宇, 王彬, 郑梅琴, 等. 应用Alamar Blue和MTT测定抗结核药物最低抑菌浓度的研究. 中国防痨杂志, 2007, 29(6): 499-501.
[8] Berridge MV, Herst PM, Tan AS. Tetrazolium dyes as tools in cell biology: new insights into their cellular reduction. Biotechnol Annu Rev, 2005, 11: 127-152.
[9] De Logu A, Uda P, Pellerano ML, et al. Comparison of two rapid colorimetric methods for determining resistance ofMycobacteriumtuberculosisto rifampin, isoniazid, and streptomycin in liquid medium. Eur J Clin Microbiol Infect Dis, 2001, 20(1): 33-39.
[10] 张朝宝, 马峻, 温子禄, 等. XTT/mPMS组合显色系统用于抗分枝杆菌药物筛选的性能评估. 临床检验杂志, 2013, 31(5): 344-348.
[11] Tsukatani T, Suenaga H, Higuchi T, et al. Colorimetric cell proliferation assay for microorganisms in microtiter plate using water-soluble tetrazolium salts. J Microbiol Methods, 2008, 75(1): 109-116.
[12] De Logu A, Borgna R, Uda P, et al. The 2,3-bis(2-methoxy-4-nitro-5-sulfophenyl)-2H-tetrazolium-5-carboxanilide (XTT) assay as rapid colorimetric method for determination of antibio-tic susceptibility of clinicalMycobacteriumtuberculosisisolates in liquid medium. Clin Lab, 2003, 49(7/8): 357-365.

