微波辅助酶法优化怀山药多糖提取工艺的研究
王 珺,李玉伟,江 姜,李桂杰,池浩东,杨占群,徐俊杰,*
(1.吉林医药学院公共卫生学院,吉林吉林 132013; 2.吉林医药学院临床医学院·附属医院,吉林吉林132013; 3.吉林医药学院基础医学院,吉林吉林 132013)
山药,薯蓣科薯蓣属植物[1],其活性成分主要有多糖、皂苷、酚类等[2],其中山药多糖作为一种研究较多的活性成分,具有降血脂、抗氧化、抗肿瘤、增强免疫力、抗突变[3-5]等多种功能,进行山药多糖的产业开发将具有良好的前景,因此进行山药多糖工艺优化研究,有效提高山药多糖的提取率具有重要意义。
目前多糖提取方法主要有水浴浸提法、酶法、微波法、超声辅助法[6]、逐步醇沉法[7]等。常规的浸提法效率低。酶解法可以作用于细胞壁,充分释放多糖,作用条件相对温和,提取效率高,但受实验条件影响较大。微波法原理为热效应破壁[8],该方法简便易操作,提取速度快,效率高。应用微波辅助,水浴浸提山药多糖[9],可提高提取效率。考虑利用微波辅助酶解进行提取可作为一种提取山药多糖的新思路。
根据已有研究,怀山药中多糖含量丰富[10],但怀山药多糖的提取率仍有待提高。本研究以怀山药为原料,采用微波辅助酶解联合作用的方法,以多糖提取率为检测指标,探究浸提温度、浸提时间、料液比、微波功率对怀山药多糖提取率的影响。通过正交实验确定多糖提取的最优条件,Sevage法除蛋白,优化怀山药多糖的提取工艺,为怀山药多糖的进一步研究与工业化生产奠定基础。
1 材料与方法
1.1 材料与仪器
怀山药片(怀山药自然风干制成) 吉林亚泰明星制药有限公司;α-淀粉酶(40000 U/mg)、纤维素酶(11000 U/mg) 长春锦能生物技术有限公司;蒽酮、葡萄糖标准品 国药集团化学试剂有限公司;考马斯亮蓝 中科院新疆化学所生化试剂厂;牛血清蛋白 BBI;氢氧化钠、盐酸、氯仿、正丁醇、硫酸、无水乙醇 皆为国产分析纯试剂。
HH-601型超级恒温水浴锅 金坛市华峰仪器有限公司;PH05型电热恒温干燥箱 上海实验仪器厂;721型可见分光光度计 上海欣茂仪器有限公司;FA1104N型电子天平 上海精密科学仪器有限公司;PJ23C-SC1美的微波炉 广东美的微波炉制造有限公司;JYL-C020型九阳豆浆机 九阳股份有限公司;TDZ5-WS低速多管架自动平衡离心机 长沙湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 山药多糖的提取 取怀山药片,利用豆浆机粉碎制成怀山药粉,精确称取5.0 g干燥山药粉末,加入适量蒸馏水,调节溶液至最适pH,加入0.05 g淀粉酶和0.005 g纤维素酶[8-12],55 ℃热水浴酶解1 h,期间玻璃棒缓慢手动搅拌。取出后于微波炉中进行微波辐射处理1 min[13],之后在热水浴中浸提,再次手动搅拌。浸提完成后,静置冷却离心(3000 r/min,15 min)收集上清液。按照上清液∶无水乙醇=1∶4的体积比,在冷却后的上清液中加入无水乙醇,充分混合后静置过夜,得山药粗多糖。用Sevage试剂洗涤3次,并用考马斯亮蓝法检测蛋白质含量,烘干后得到白色粉末状多糖。
1.2.2 标准曲线的绘制及多糖含量的测定 精密称取葡萄糖标准品0.1023 g于1000 mL容量瓶中,加蒸馏水至刻度(100 mg/L),摇匀,备用。分别吸取葡萄糖对照品溶液0.1、0.2、0.3、0.4、0.5、0.6 mL置于试管中,分别加入蒸馏水至体积为1.0 mL,空白管加入1.0 mL蒸馏水做对照,各管中加入4.0 mL蒽酮试剂,迅速浸于冰水浴中冷却,后摇匀置沸水浴加热10 min,取出置冷却至室温,在紫外分光光度计波长620 nm处测定吸光度。以葡萄糖浓度(ug/mL)为横坐标,吸光度为横坐标绘制标准曲线。得到标准曲线y=0.0012x+0.0049(y为吸光度,x为葡萄糖浓度,mg/mL),R2=0.9998。多糖含量测定:精密称取山药粗多糖0.1037 g加蒸馏水溶于1000 mL量瓶中,精确吸取1 mL置于试管内,按照蒽酮-硫酸法处理后于620 nm处测定其吸光度,代入葡萄糖标准曲线得山药多糖样品含量。多糖提取率计算公式为:
多糖提取率(%)=G1/G2×100
式中:G1为提取的山药多糖质量,g;G2为山药粉质量,g。
1.2.3 单因素实验
1.2.3.1 浸提温度对怀山药多糖提取率的影响 固定料液比为1∶5,浸提时间为3 h,浸提2次,微波功率为750 W,探究不同浸提温度(75、80、85、90、95 ℃)对怀山药多糖提取率的影响。
1.2.3.2 浸提时间对怀山药多糖提取率的影响 固定料液比为1∶5,浸提温度为85℃,浸提2次,微波功率为750 W,探究不同浸提时间(1、2、3、4、5 h)对怀山药多糖提取率的影响。
1.2.3.3 料液比对怀山药多糖提取率的影响 固定浸提温度为85 ℃,浸提时间为3 h,浸提2次,微波功率为750 W,探究不同料液比(1∶4.5、1∶5.0、1∶5.5、1∶6.0、1∶6.5 g/mL)对怀山药多糖提取率的影响。
1.2.3.4 微波功率对怀山药多糖提取率的影响 固定料液比为1∶5,浸提时间为3 h,浸提2次,根据文献[14-15],微波功率过高,多糖提取率下降,故选取不同微波功率(600、675、750、825、900 W),探究其对怀山药多糖提取率的影响。
1.3 正交实验
在单因素实验的基础上选取浸提温度(A)、浸提时间(B)、料液比(C)和微波功率(D)4个因素,设置3个水平,以多糖提取率为考察指标,设计L9(34)正交实验优化山药多糖提取工艺。因素与水平见表1。
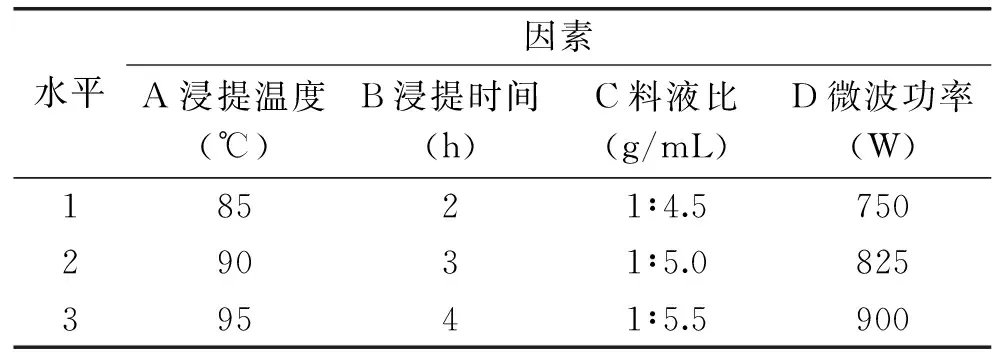
表1 正交实验因素水平表Table 1 Factors and levelsTable of orthogonal experiment
1.4 数据统计分析
应用SPSS 20.0软件分析单因素实验数据的显著性差异。采用单因素方差分析进行各水平间差异的比较,LSD-t检验进行两两比较。结果以Mean±SD表示。
2 结果与分析
2.1 单因素实验
2.1.1 浸提温度对怀山药多糖提取率的影响 由图1可看出,当温度在75~80 ℃时,多糖的提取率随着浸提温度的增高而略有升高,温度在80~85 ℃范围内,多糖提取率随温度上升略有下降,通过对二者两两比较分析得p>0.05,故在此范围内,多糖提取率无显著性差异。当温度达到85~95 ℃范围内,多糖提取率随温度上升而显著升高,原因可能是,由于温度升高,多糖溶解度和扩散率升高,使提取率不断升高,在95 ℃时多糖提取率达到27.04%。基于文献与前期实验[16-17],选取85、90、95 ℃三个水平进行正交实验。
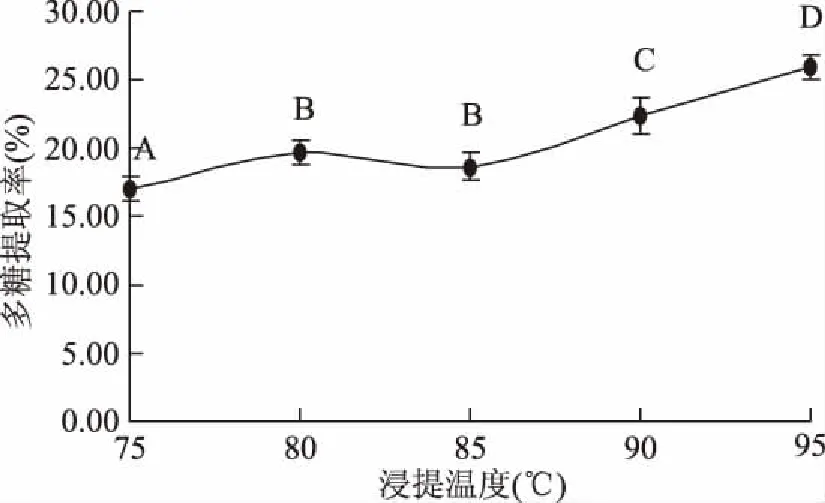
图1 提取温度对山药多糖提取率的影响Fig.1 Effect of temperature on the polysaccharide yield注:字母不同表示有显著差异(p<0.05),图2~图4同。
2.1.2 浸提时间对怀山药多糖提取率的影响 由图2可看出,浸提时间在1~3 h范围内,多糖的提取率随着浸提时间的延长而升高,浸提时间在3~4 h范围内,多糖提取率随浸提时间的延长而略有下降,浸提时间在4~5 h范围内,多糖提取率呈上升趋势,可能是由于时间过长,多糖的结构遭到破坏,导致多糖提取率下降[17-18]。结果表明,3 h时多糖提取率最高,达27.4%,选取2、3、4 h三个水平进行正交实验。

图2 浸提时间对多糖提取率的影响Fig.2 Effect of time on the polysaccharide yield
2.1.3 料液比对怀山药多糖提取率的影响 由图3可看出,当料液比在1∶4.5~1∶5.0范围内,多糖的提取率随料液比增大而显著升高,当料液比在1∶5~1∶6.5范围内,多糖的提取率随料液比增大而下降,原因可能是由于水量增加,溶解的杂质增多,影响多糖的提取[19]。当料液比为1∶5时,多糖提取率达到33.67%,选取1∶4.5、1∶5.0、1∶5.5三个水平进行正交实验。

图3 料液比对多糖提取率的影响Fig.3 Effect of material liquid ratio on the polysaccharide yield
2.1.4 微波功率对怀山药多糖提取率的影响 由图4可看出,怀山药多糖的提取率随微波功率的升高而显著提高。王安良等采用微波辅助法得到多糖提取率为13%[20-21],而本实验在微波功率900 W条件下,得多糖提取率为33.03%,提取率有显著提高,原因可能由于微波功率升高,热效应导致细胞破裂多糖释放,进而进行水浴浸提,多糖充分溶解提取率升高,但温度过高,多糖降解。选取750、825、900 W三个水平进行正交实验。
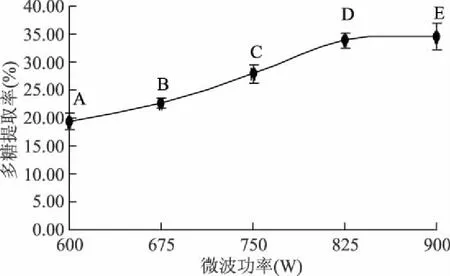
图4 微波功率对多糖提取率的影响Fig.4 Effect of microwave power on the polysaccharide yield
2.2 正交实验
根据单因素实验结果,确定微波辅助提取山药多糖的最佳条件,实验结果见表2。

表2 正交实验结果Table 2 Results of orthogonal experiment
由表2得:各因素对多糖产率的影响为:RC>RD>RA>RB,即料液比>微波功率>浸提温度>浸提时间,山药多糖的最佳提取条件为A1B3C3D2,即提取温度为85 ℃,提取时间为4 h,料液比1∶5.5 (g/mL),微波功率为825 W,此时山药多糖的产率为34.78%±1.19%。
3 结论与讨论
多糖是一种结构复杂用途广泛的物质,可从各种动植物、真菌等物质中提取。提取怀山药多糖的方法主要有水提醇沉法、酶提取法、超声提取法、微波提取法、超高压提取法、膜分离法等[7]。传统的水浴浸提法提取率3.37%[8],微波法为8.35%[14],纤维素酶酶解法山药多糖提取率8%[23],α-淀粉酶酶解法为11.5%[24],酶解法优势在于作用条件温和,保持物质原有活性,微波法具有提取效率高、提取速度快、易操作等优点。本研究考虑综合酶法和微波法的优点,运用微波辅助法通过热效应,使怀山药溶液内部温度升高,加入α-淀粉酶与纤维素酶,可以溶解怀山药表面淀粉颗粒,分解细胞壁,促进怀山药多糖的释出。通过单因素分析及正交实验,建立并优化了微波辅助与酶解联合作用提取怀山药多糖的工艺,确定最佳提取条件为温度85 ℃,提取时间4 h,料液比1∶5.5 (g/mL),微波功率为825 W,在此条件下怀山药多糖的提取率可达34.78%±1.19%,与传统的水浴浸提法[22]及单纯的酶法[23]、微波辅助法[14]相比,本实验提取率有显著提高。此外,根据王莉[25]等在微波辅助提取米糠多糖及张玲玲、赵希艳[25-26]等在研究中进行验证实验,确定了微波辅助与酶解法提取怀山药多糖不改变其理化性质。本实验为怀山药多糖提取工艺优化提供了依据,也为后续研究怀山药多糖的理化性质打下坚实基础。
研究表明,山药多糖有增强免疫力、降血糖降血脂等功效[7],有良好的开发前景。山药作为高糖、无脂肪的天然保健品,在我国的种植开发极为广泛,但山药的开发利用还仅限于制作复合饮料或山药饮片、山药粉的初级阶段,而未能高效利用山药多糖的优质作用。本研究立足于山药多糖开发的巨大潜力,为后续山药多糖的活性研究及产业化开发奠定基础。
[1]聂凌鸿,宁正祥. 广东淮山多糖的纯化及化学结构鉴定研究[J].林产化学与工业,2004,24(S1):101-106.
[2]谢兴源.山药的主要成分及其应用价值[J].现代农业科技,2009(6):76-77.
[3]Hao Hao LX,Zhao XH. Report-Invitroimmune potentials of a water-soluble polysaccharide extract from Dioscorea opposita planted in Henan Province,China[J]. Pak J Pharm Sci,2017,30(4):1383-1388.
[4]孙锋. 鲜山药的生物活性研究[D].无锡:江南大学,2005.
[5]Zhang Z,Wang X,Liu C,et al.The degradation,antioxidant and antimutagenic activity of the mucilage polysaccharide from Dioscorea opposita[J]. Carbohydr Polym,2016,150:227-231.
[6]Zhang L,Wang M. Optimization of deep eutectic solvent-based ultrasound-assisted extraction of polysaccharides from Dioscorea opposita Thunb[J]. Int J Biol Macromol,2017,95:675-681.
[7]Li Q,Li W,Gao Q. Hypoglycemic Effect of Chinese Yam(Dioscorea opposita rhizoma)Polysaccharide in Different Structure and Molecular Weight[J]. Food Sci,2017,82(10):2487-2494.
[8]王洪新,王远辉. 山药多糖研究进展[J]. 食品与生物技术学报,2011,30(3):321-327.
[9]王娜,潘治利,孙晓瑞,等.铁棍山药水溶性粗多糖提取工艺的研究[J]. 江西农业报,2010,22(12):106-109.
[10]Li J J,Ren M L,Wang J,et al. Research on Breeding ofDioscoreaoppositacv. Tiegun[J]. Zhong Yao Cai,2015,38(9):1787-1791.
[11]李培. 纤维素酶酶解法提取怀山药多糖工艺研究[J]. 蚌埠学院学报,2015,4(6):13-16.
[12]董义,沈才洪,曾里,等. 酶解辅助提取山药多糖的研究[J]. 河南工业大学学报:自然科学版,2015,36(3):56-60.
[13]王安良,云霞,杨红. 响应曲面法优化山药中多糖的微波提取工艺[J]. 食品科技,2007(12):86-90.
[14]李建刚,李庆典. 微波提取山药多糖的研究[J]. 中国酿造,2012,31(10):103-105.
[15]王涛,朱晓伟,邵果园,等. 正交设计法优选紫山药多糖的提取工艺[J]. 安徽农业科学,2015,43(34):62-64.
[16]王媛媛,许兰淑,樊玮,等. 山药多糖提取率-活性综合优化提取工艺[J]. 食品安全质量检测学报,2015,6(6):1980-1986.
[17]吉仙枝. 超声波协同α-淀粉酶提取野生山药多糖工艺研究[J]. 三门峡职业技术学院学报,2015(1):140-144.
[18]成娟. 山药多糖提取工艺及质量控制研究[D].成都:西南交通大学,2014.
[19]龙菊,孙翠英,张红霞,等. 正交设计与响应面法优化山药多糖提取工艺[J]. 食品研究与开发,2017,38(4):54-58.
[20]王安良,云霞,杨红. 响应曲面法优化山药中多糖的微波提取工艺[J]. 食品科技,2007(12):86-90.
[21]秦婷,郭金甲,刘井利,等. 山药多糖的研究进展[J]. 中国当代医药,2013,20(13):20-21,25.
[22]董汝晶. 多糖提取方法的研究进展[J]. 农产品加工.学刊,2014(8):46-48,51.
[23]张俊婷. 山药多糖提取工艺优化及其抗菌活性研究[D]. 佳木斯:佳木斯大学,2014.
[24]王莉,陈正行,张潇艳. 微波辅助提取米糠多糖的工艺[J]. 江苏大学学报:自然科学版,2007,28(3):193-196.
[25]张玲玲,黄兮,邱绍兵,等. 微波辅助提取桑葚多糖的工艺研究[J]. 山东化工,2012,41(12):9-12,15.
[26]赵希艳,贾凌杉,马华. 微波辅助提取黑木耳多糖的工艺[J]. 河北科技师范学院学报,2012(1):65-67,71.

