花生蛋白酸法去酰胺条件的优化及其性质表征
芦 鑫,孟雅昆,张丽霞,孙 强,高锦鸿,黄纪念,*
(1.河南省农业科学院农副产品加工研究中心,河南郑州 450002; 2.河南省农产品生物活性物质工程技术研究中心,河南郑州 450002; 3.河南农业大学食品科学技术学院,河南郑州 450002)
花生蛋白是花生的主要组分,约占花生仁重的25%~36%左右,由于花生蛋白的氨基酸组成均衡合理、营养价值高、资源丰富、价格低廉、且适应多种加工方式,已广泛应用于食品领域,成为世界第三大植物食用蛋白资源[1-4]。
花生蛋白具有良好的持水性、吸油性、乳化性和凝胶性,但溶解性较差,且对pH、温度敏感[5-6]。当花生蛋白处于酸性、中性条件时,因接近等电点,溶解性差,易产生沉淀,但当温度超过55 ℃时,会引发蛋白变性,也会导致溶解性下降,这限制了花生蛋白在饮料中的应用[7-9]。研究表明,改性可以提高植物蛋白的溶解性,其中去酰胺改性可有效提高花生蛋白、大豆蛋白、小麦蛋白的溶解性[10-15]。卢寅泉等[11]利用盐酸去酰胺改性花生蛋白,使花生蛋白的等电点降低到pH0.5~1之间,pH为7时,其溶解性由未改性时的66.3%提高到81.8%。目前,根据酸浓度高低,蛋白去酰胺改性可分为低酸长时与高酸短时两种改性方式。低酸长时法虽有反应温和的优点,但耗时长且能耗高;高酸短时虽有反应快速、效果明显、生产效率高的优点,但是会加剧蛋白水解,这限制了高酸短时法的应用,因此,有必要开展控制水解度的高酸短时去酰胺研究。以往的研究中,仅以蛋白的去酰胺度(DD)与水解度(DH)为评价指标,但上述指标不能直观反映体系中参与去酰胺反应与水解反应的蛋白的比例,因此,有必要对评价方法进行完善。此外,研究者也未深入探讨去酰胺改性对花生蛋白组成、结构的影响,有必要开展相关研究。
本研究中,以DD与DH为评价指标外,引入去酰胺度与水解度比值(DD/DH)来评价体系内去酰胺反应与水解反应的主次关系,优化花生蛋白的酸法去酰胺工艺,并表征去酰胺改性对花生蛋白组成结构与功能性的影响,推动花生蛋白去酰胺改性研究。
1 材料与方法
1.1 材料与仪器
花生蛋白粉 实验室自制;KBr 光谱纯,上海阿拉丁生化科技股份有限公司;其他试剂 均为分析纯,国药集团化学试剂有限公司。
IS5傅立叶红外分析仪 美国赛默飞世尔科技公司;K-05型自动定氮仪 上海晟声自动化分析仪器有限公司;Lyovac GT1冷冻真空干燥机 德国SRK有限公司;DL-5B型离心机 上海安亭科学仪器厂;UV-6300型分光光度计 上海美谱达有限公司;XS205电子天平 瑞士梅特勒-托利多仪器有限公司;DF-101S集热磁力加热搅拌器 巩义市予华仪器有限责任公司。
1.2 实验方法
1.2.1 花生蛋白制备 称取一定量的脱脂花生饼粕粉加入到蒸馏水中,两者比例为1∶10 (g/mL),磁力搅拌下用1.0 mol/L NaOH调节到pH10.0,室温搅拌2 h,采用4000 r/min 离心20 min,收集上清液,将沉淀再次加入到相同体积蒸馏水并调节到pH10.0,重复上述搅拌和离心操作,合并第1次和第2次上清液,采用1.0 mol/L HCl调节到pH4.30,4 ℃静置30 min,4000 r/min离心20 min,收集沉淀,并水洗至中性,透析,冷冻干燥,粉碎过100目筛,得到花生蛋白[16]。蛋白含量94.06%±0.47%,水分含量5.12%±0.25%,灰分含量0.82%±0.07%
1.2.2 花生蛋白去酰胺改性 参考大豆蛋白的去酰胺方法[14-15],称取一定质量的花生蛋白加入到0.05~0.5 mol/L的硫酸溶液中,配制成质量浓度1%~7%的花生蛋白溶液,在60~100 ℃下,反应1~6 h后,用3 mol/L NaOH中和后,采用截留分子量3500 Da透析袋4 ℃透析18 h,-40 ℃冷冻干燥,得到改性花生蛋白粉,测定其DD和DH,并计算DD/DH。
1.2.3 单因素实验设计 为优化去酰胺实验,首先以DD和DH为评价指标,进行硫酸浓度、花生蛋白质量浓度、反应时间、反应温度单因素实验。
优化硫酸浓度时,固定花生蛋白质量浓度4%,分别采用0.05、0.15、0.25、0.35、0.45、0.55 mol/L硫酸在80 ℃下水解1 h。
优化花生蛋白质量浓度时,固定硫酸浓度为0.25 mol/L,分别取花生蛋白质量浓度1.0%、2.5%、4.0%、5.5%、7.0%在80 ℃下水解1 h。
优化反应时间时,固定硫酸浓度0.25 mol/L,取质量浓度为5.5%花生蛋白在80 ℃分别反应1、2、3、4、5、6 h。
优化反应温度时,采用0.25 mol/L硫酸作用于质量浓度5.5%花生蛋白溶液分别在60、70、80、90、100 ℃反应2 h。
1.2.4 正交实验设计 综合单因素实验结果,选用硫酸浓度、反应时间、反应温度对DD、DH、DD/DH进行正交实验。

表1 花生蛋白去酰胺正交实验设计表Table 1 The orthogonal experimental design for deamination of peanut protein
1.2.5 指标的测定
1.2.5.1 去酰胺度的测定 采用那治国修改的微量弥散皿法[14]。
1.2.5.2 水解度的测定 采用茚三酮比色法[17]。
1.2.6 改性蛋白性质的确定
1.2.6.1 氨基酸的测定 采用GB 5009.124-2016测定未改性花生蛋白与去酰胺花生蛋白的氨基酸含量,其中去酰胺花生蛋白是采用5.5%花生蛋白溶液,0.3 mol/L硫酸,在85 ℃改性120 min,中和透析、冷冻干燥的样品。
1.2.6.2 花生蛋白微观结构 使用E-1010离子喷溅仪对花生蛋白粉进行真空喷金,随后采用15 kV的加速电压下,在电子显微镜下拍摄,照片分辨率1280×960。
1.2.6.3 花生蛋白的红外光谱测定 采用红外光谱进行分析,分析0.3 mol/L硫酸在85 ℃改性5.5%花生蛋白溶液过程中蛋白二级结构的变化。操作条件参考芦鑫等[5]的方法,获得红外光谱图后,用Origin 8.5以二次微分从红外光谱1600~1700 cm-1的波峰中寻找隐峰,按照1610~1642 cm-1归属β-折叠,1642~1650 cm-1归属无规则卷曲,1650~1660 cm-1归属α-螺旋,1660~1680 cm-1归属β-转角,1680~1700 cm-1归属β-逆折叠[18],进行归类与计算二级结构组成。
1.2.6.4 溶解度的测定 为考察不同改性程度花生蛋白在不同pH条件下的溶解度特性,取未改性花生蛋白与采用5.5%花生蛋白溶液,0.3 mol/L硫酸,在85 ℃改性时间分别为30、60、90和120 min的去酰胺花生蛋白,在pH4、7、10的氮溶解指数(NSI)。NSI测定条件:称取0.2 g样品,溶于30 mL纯水中,调节pH为4、7、10,缓慢搅拌30 min后,4000 r/min离心30 min,取上清液5 mL。凯氏定氮法测定上清液中可溶性氮质量Ms与样品总氮质量Mt,计算NSI,见公式(1)。
NSI(%)=(Ms/Mt)×100
式(1)
1.3 数据处理
除特别说明,所有实验平行测定3次,采用IBM SPSS 20进行Duncan算法的单因素方差分析,显著水平为p<0.05,高度显著水平为p<0.01。同一曲线上带有相同小写字母的数据在0.05水平上无显著差异。
2 结果与分析
2.1 硫酸浓度对花生去酰胺改性的影响
由图1和图2可知,随着硫酸浓度升高,花生蛋白的去酰胺度与水解度显著提高,这是由于随着酸浓度提高,体系中有更多的氢离子参与到酰胺基与酰亚胺基的亲和取代反应中,从而提高蛋白去酰胺反应与肽链断裂反应的速度[11]。蛋白水解作为酸法脱酰胺的副反应,适度水解可以降低蛋白分子尺寸,从而提高蛋白溶解分散性,但过度水解会导致蛋白内部疏水氨基酸暴露,产生苦味,从而影响口感[19]。故开展花生去酰胺改性研究时,应在控制水解度的前提下,提高去酰胺度。结合DD/DH分析,硫酸浓度应选择0.25 mol/L为宜。
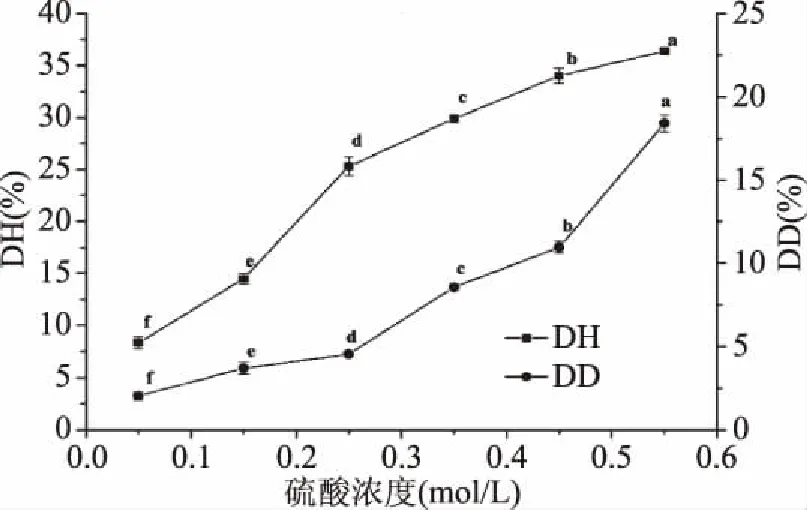
图1 硫酸浓度对花生蛋白脱酰胺度和水解度的影响Fig.1 Effect of sulfuric acid on degree of deamination and hydrolysis of peanut protein

图2 DH/DD在硫酸浓度作用下的变化Fig.2 Variation of DH/DD under the effect of sulfuric acid
2.2 蛋白质量浓度对花生去酰胺改性的影响
由图3和图4可知,花生蛋白质量浓度从1%增加到7%,蛋白去酰胺度与水解度呈现下降趋势;当花生蛋白质量浓度从1%增加到5.5%时,DD/DH有所上涨,这表明脱酰胺度的下降幅度小于水解度下降幅度,随后继续增加蛋白质量浓度,水解度趋于稳定,而去酰胺度持续下降,导致DD/DH下降。结合DD/DH考虑,花生蛋白质量浓度取5.5%为宜。
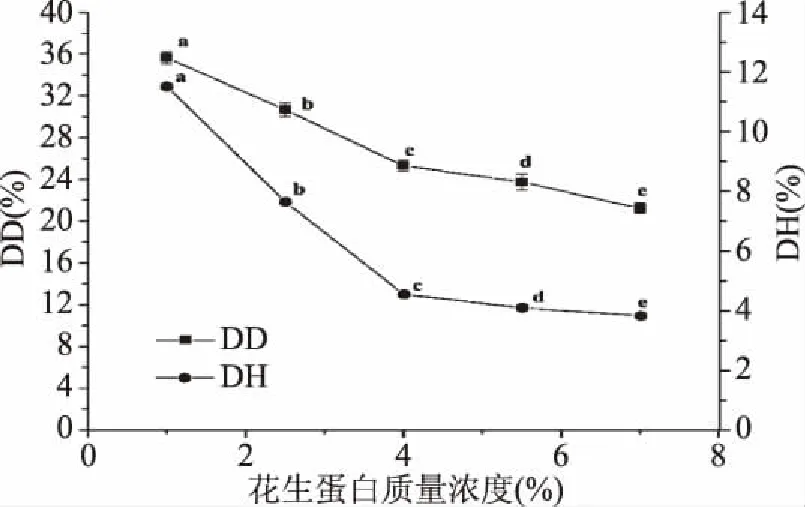
图3 质量浓度对花生蛋白脱酰胺度和水解度的影响Fig.3 Effect of mass concentration on degree of deamination and hydrolysis of peanut protein

图4 DH/DD在花生蛋白质量浓度作用下的变化Fig.4 Variation of DH/DD under the effect of mass concentration of peanut protein
2.3 反应时间对花生去酰胺改性的影响
由图5和图6可知,反应时间从1 h延长到3 h时,花生蛋白去酰胺度显著提高(p<0.05),随后延长反应时间,花生蛋白的去酰胺度无显著变化(p>0.05);在此过程中,蛋白水解度持续增加。这可能是在反应初期,蛋白中天冬氨酰(Asn)和谷氨酰胺(Gln)残基中的酰胺基数量多,且由于位于氨基酸残基的侧链上,其空间位阻小于肽链中酰亚胺基,故去酰胺反应速度大于肽链断裂速度;但随着反应进行,蛋白中的Asn和Gln残基中的酰胺基减少,氢离子有更大概率与肽链中酰亚胺基碰撞发生反应,因此,水解度持续增加,而去酰胺度增幅较小[11]。
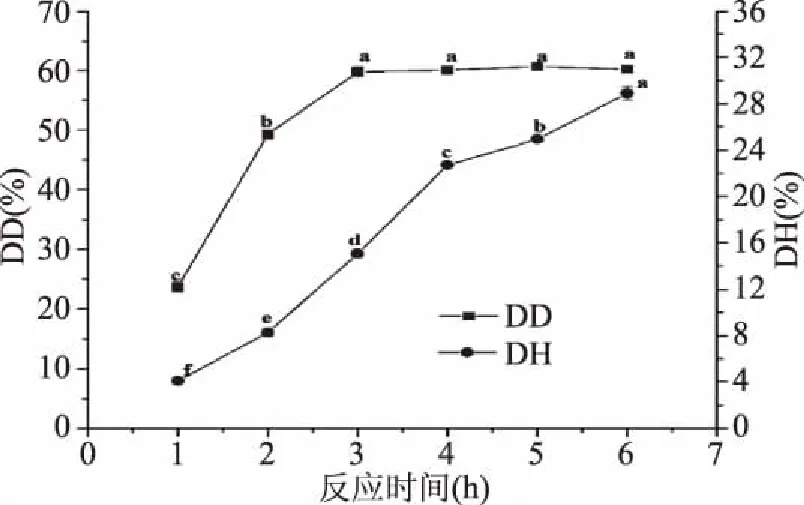
图5 反应时间对花生蛋白脱酰胺度和水解度的影响Fig.5 Effect of reaction time on degree of deamination and hydrolysis of peanut protein
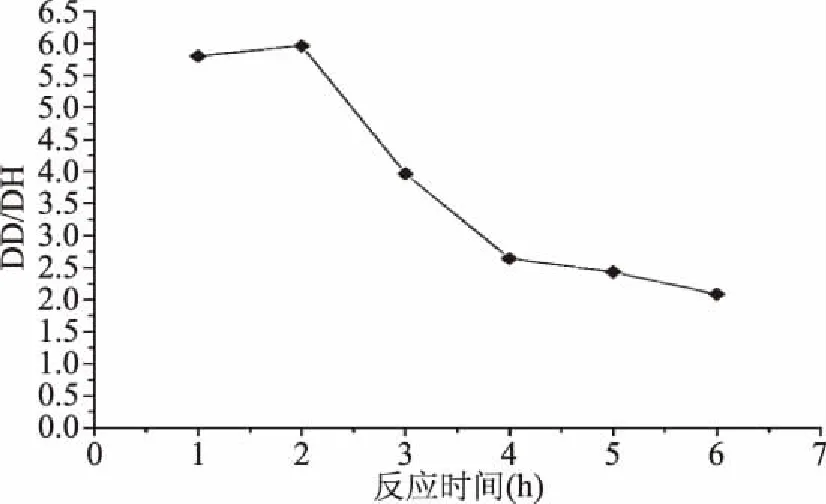
图6 DH/DD在反应时间影响下的变化Fig.6 Variation of DH/DD under the effect of reaction time
将水解时间在3 h蛋白的去酰胺度较水解时间2 h的蛋白有所提高,但蛋白水解度的提高幅度更大(反应时间从2 h增加到3 h时,蛋白去酰胺度增幅为21.21%,水解度增幅为82%)。水解度过高,会导致蛋白变成多肽,影响改性蛋白的其他功能特性。综合考虑蛋白的DD、DH、DD/DH,反应时间选取2 h为宜。
2.4 反应温度对花生去酰胺改性的影响
由图7和图8可知,随着反应温度的提高,花生蛋白的去酰胺度与水解度均显著提高(p<0.05)。当加热温度低于90 ℃时,花生蛋白去酰胺反应增速快于水解反应,DD和DH持续增加;但加热温度高于90 ℃时,花生蛋白去酰胺反应速度基本达到平衡,而水解反应速度快速增加,导致DD/DH下降。综合考虑DD、DH和DD/DH,反应温度以90 ℃为宜。
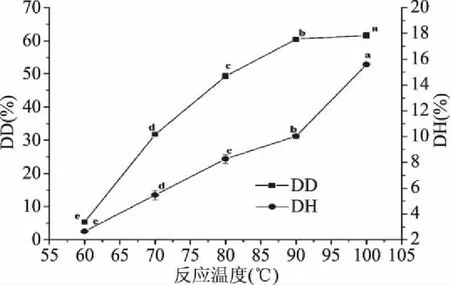
图7 反应温度对花生蛋白脱酰胺度和水解度的影响Fig.7 Effect of reaction temperature on degree of deamination and hydrolysis of peanut protein
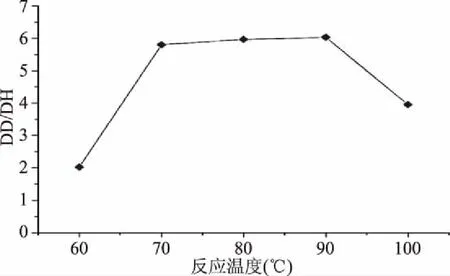
图8 DH/DD在反应温度影响下的变化Fig.8 Variation of DH/DD under the effect of reaction temperature
2.5 最佳去酰胺改性条件的确立
固定花生蛋白质量浓度在5.5%,对硫酸浓度、反应温度与反应时间进行正交设计,以获得最佳的花生蛋白去酰胺工艺参数。采用SAS进行正交方差分析发现:在取值范围内,去酰胺度与水解度的正交模型显著,可以客观真实地反映硫酸浓度、反应时间、反应温度对去酰胺度与水解度的影响规律。分析各影响因素对去酰胺度的影响,硫酸浓度是第一显著因素,其次是反应时间,最后是反应温度;而对于水解度而言,反应温度是第一显著因素,其次是硫酸浓度,反应时间不显著。通过极差分析因素的影响强弱与方差分析结果相一致。
为获得较高去酰胺度且水解度较低的花生蛋白以去酰胶度为主要指标,采用极差分析,获得去酰胺度最高的工艺组合为A3B3C3,但在此条件下,蛋白水解度也是最高,不符合研究目的。故结合显著性分析,由表2可知,对于硫酸浓度而言,正交实验的3个水平的去酰胺度均有显著差异(p<0.05),故选择水平3,即硫酸浓度取0.3 mol/L;对于反应时间,水平2和水平3的去酰胺度之间为非显著差异(p>0.05),选择水平2(2 h)可以减少反应时间,故反应时间取2 h;对于反应温度,水平2与水平3之间的去酰胺度无显著差异(p>0.05),同时,选择水平2可以减少水解度,故反应温度取90 ℃;在此因素水平组合下,花生蛋白去酰胺度是69.07%±0.34%,但水解度过高,达到16.75%±0.18%。

表2 花生蛋白去酰胺正交实验结果表Table 2 The orthogonal experimental result for deamination of peanut protein
在控制水解度的前提下,进一步提高花生的去酰胺度,有必要分析DD/DH变化趋势。在取值范围内,反应时间对水解度影响不显著,但会显著影响脱酰胺度。为获得高脱酰胺的蛋白,固定反应时间2 h,分析硫酸浓度、反应温度对DD/DH的影响。由图9可知,高DD/DH的区域出现在0.23~0.25 mol/L硫酸、88~90 ℃反应温度和0.29~0.30 mol/L硫酸、85~86 ℃反应温度,在上述区域中去酰胺反应是主要反应,水解反应不起主导作用。由表3可知,去酰胺度与反应温度呈正比,但在85~90 ℃之间时,反应温度对去酰胺度的无显著影响;而水解度与反应温度呈反比,故高硫酸浓度、低反应温度的区域适宜花生蛋白去酰胺反应。结合DH/DD,确定最佳的花生蛋白去酰胺反应条件为:采用0.30 mol/L硫酸,在85 ℃反应2 h,此时花生蛋白脱酰胺度、水解度、DD/DH分别为(66.98%±0.54%)、(10.56%±0.27%)、6.34。
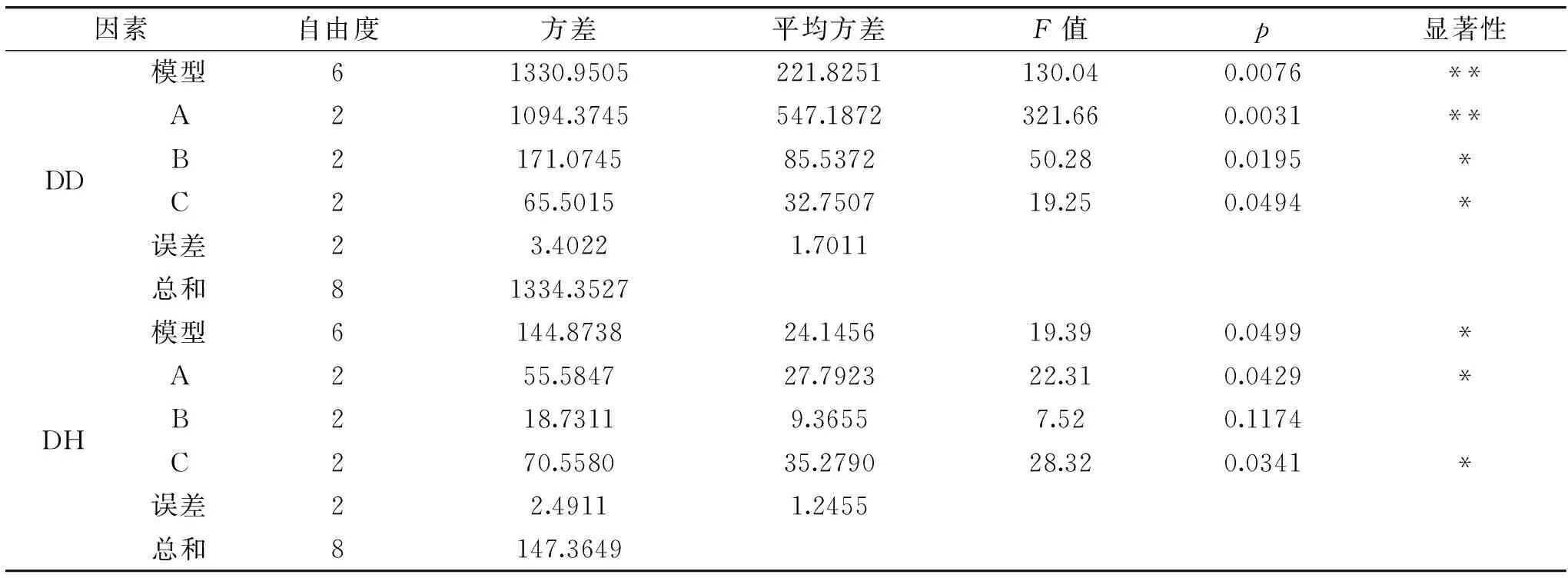
表3 花生去酰胺正交实验的方差分析表Table 3 The variance analysis of the orthogonal experiment for deamination of peanut protein

图9 花生去酰胺改性过程中DD/DH变化趋势Fig.9 The change trend of DD/DH during modification of peanut protein by deamination
2.6 去酰胺反应对花生蛋白组成结构和性质的影响
为分析去酰胺反应对花生蛋白组成结构的影响,分别利用氨基酸分析、扫描电镜、红外光谱来观察花生蛋白氨基酸组成、微观特征、二级结构的变化。
2.6.1 去酰胺改性对花生蛋白氨基酸组成的影响 由表5可知,经过去酰胺改性花生蛋白的氨基酸组成与未改性花生蛋白基本一致,这表明去酰胺不会破坏花生蛋白的氨基酸,因而不会影响蛋白的营养价值,这与前人去酰胺改性大豆蛋白的氨基酸组成变化的结果一致[20]。氨基酸存在的细微差异可能是去酰胺改性过程中,花生蛋白发生部分水解,产生的短肽在透析过程中有部分损失,从而导致氨基酸组成有所变化[20]。

表5 花生蛋白与去酰胺花生蛋白氨基酸组成表Table 5 Compositions of amino acid of peanut protein and deaminated peanut protein
2.6.2 去酰胺改性对花生蛋白微观结构的影响 由图10可知,花生蛋白经过去酰胺改性,其微观结构发生明显变化。未改性的花生蛋白粉以有序、排列紧密的扁平状颗粒聚集体的形式存在;而去酰胺改性的花生蛋白以松散、无规则片层状的形式存在(图10(a、c))。观察蛋白微粒发现,未改性花生蛋白表面光滑且形态完整,而去酰胺花生蛋白表面粗糙、凹凸不平且有大量裂纹。这些变化可能是去酰胺过程中,蛋白质的氨基酸残基侧链发生变化,肽键部分断裂,导致蛋白分子之间的氢键、疏水作用减弱,形成这种疏松的网络片层结构。上述蛋白形态变化与姜红研究酸法去酰胺大豆蛋白的形态变化相一致[15]。

图10 花生蛋白与去酰胺花生蛋白的扫描电子显微镜图Fig.10 Scanning electron microscope photo of peanut protein and deaminated peanut protein注:(a)和(b)花生蛋白,(c)和(d)去酰胺花生蛋白,(a)、(c)放大1000倍,(b)、(d)放大10000倍。
2.6.3 去酰胺改性对花生蛋白二级结构的影响 在加工过程中,花生蛋白的构象会发生改变[21-22]。因此,有必要分析改性对花生蛋白二级结构的影响。由图11可知,改性对花生蛋白二级结构影响有限,虽然改性使花生蛋白的β-折叠、β-转角、无规则卷曲的比例有所下降,β-逆折叠和α-螺旋比例略微上升,但未改变花生蛋白以β-折叠、β-转角、α-螺旋为主的结构组成特点。

图11 去酰胺改性过程中花生蛋白二级结构变化图Fig.11 The change in secondary structure during modification of peanut protein by deamination
2.6.4 去酰胺改性对花生蛋白溶解性的影响 为评价去酰胺改性对花生蛋白溶解性提高效果,测试不同pH条件下,花生蛋白与去酰胺花生蛋白的NSI。由图12可知,在pH分别为4、7、10条件下,去酰胺花生蛋白的NSI明显高于花生蛋白,并且伴随着改性程度增加,花生蛋白的溶解性也随之增加。尤其在pH4条件下,通过去酰胺改性花生的溶解度从11.64%±0.38%上升到68.43%±0.70%。这表明去酰胺改性提高花生蛋白溶解性,有效改善在酸性和中性溶液中的分散性。以上结果与去酰胺改性提高大豆蛋白、面筋蛋白、玉米蛋白溶解性的结果一致[12-14,23]。去酰胺花生蛋白溶解度的增加的原因是:蛋白质去酰胺反应将弱极性的Asn和Gln转化为极性的Asp和Glu,增加蛋白质的净电荷,从而增强水化作用。此外,肽键的部分断裂形成小分子多肽,也促进溶解性提高[19,24-25]。

图12 花生蛋白与去酰胺花生蛋白的NSI图Fig.12 NSI of peanut protein and deaminated peanut protein
3 结论
以DD、DH、DD/DH为评价指标,通过单因素实验考察硫酸浓度、反应温度、反应时间与蛋白质量浓度对去酰胺改性花生蛋白效果的影响规律,并采用正交实验确定最佳的改性条件。随后,采用氨基酸分析、电子显微镜、红外光谱、察改性对花生蛋白结构组成的影响,并利用NSI来验证去酰胺改性对提高花生蛋白溶解性的效果。获得如下结论:
a. 花生蛋白去酰胺的最优条件是:采用0.30 mol/L硫酸作用于质量浓度5.5%花生蛋白溶液,85 ℃反应2 h,在此条件下,花生蛋白脱酰胺度、水解度、DD/DH分别为66.98%±0.54%、10.56%±0.27%、6.34。
b. 去酰胺改性基本未改变花生蛋白的氨基酸组成;改性使花生蛋白的β-折叠、β-转角、无规则卷曲的比例有所下降,β-逆折叠和α-螺旋比例略微上升,但未改变花生蛋白以β-折叠、β-转角、α-螺旋为主的结构组成特点。
c. 去酰胺改性使花生蛋白由原有紧密完整的聚团结构变成疏松破裂的网络片层结构,并且将原有弱极性的Asn和Gln转化为极性强的Asp和Glu,增强水化作用,加之蛋白的部分水解,从而使去酰胺花生蛋白的溶解性得到明显改善。
[1]芦鑫,张丽霞,孙强,等. 花生蛋白制备与应用研究[J]. 食品工业科技,2012,33(8):444-477.
[2]赵晓燕,孙秀平,陈锋亮,等. 花生蛋白的研究进展与开发利用现状[J]. 中国粮油学报,2012,26(12):118-122.
[3]刘大川,廖晓龙,王祖奎,等. 花生分离蛋白制备工艺研究[J]. 中国油脂,2010,35(10):21-24.
[4]Sandefur H N,Mccarty J A,Boles E C,et al. Sustainable Protein Sources[M]. Cambridge:Academic Press,2017:209-221.
[5]王莹,王瑛瑶,刘建学,等. 花生蛋白水合性质的研究进展[J]. 食品工业科技,2014,35(13):374-377.
[6]Yu J M,Ahmednam G I. Peanut protein concentrate:production and functional properties as affected by processing
[J].Food Chemistry,2007,103(1):121-129.
[7]杜寅,王强,刘红芝,等. 花生蛋白组分及其功能性质研究进展[J].食品科学,2012,33(1):285-289.
[8]张健磊,崔波,隗苗苗,等. 三聚磷酸钠改性花生蛋白的研究[J]. 食品工业科技,2011,32(8):346-349.
[9]董新红,赵谋明,蒋跃明. 花生蛋白改性的研究进展[J]. 中国粮油学报,2011,26(12):109-117.
[10]Yu L N,Yang W Q,Sun J,et al. Preparation,characterisation and physicochemical properties of the phosphate modified peanut protein obtained fromArachinConarachinL[J]. Food Chemistry,2015,170(1):169-179.
[11]卢寅泉,肖红媚,郑宗坤. 花生蛋白加工功能性改善的研究[J]. 食品科学,1995,16(6):9-14.
[12]Liao L,Zhao M M,Ren J Y,et al. Effect of acetic acid deamidation-induced modification on functional and nutritional properties and conformation of wheat gluten[J]. Journal of the Science of Food and Agriculture,2010,90(3):409-417.
[13]李瑜,庞凌云,乔明武. 去酰胺作用对谷朊粉功能特性影响研究[J]. 粮食与油脂,2007(6):26-27.
[14]那治国,王成波,张浩,等. 大豆蛋白酸法去酰胺改性及对蛋白溶解性的影响[J]. 现代食品科技,2009,25(6):600-603.
[15]姜红,迟玉杰,胥伟,等. 酸法去酰胺提高大豆分离蛋白持水性的研究[J]. 食品与发酵工业,2011,37(8):32-36.
[16]芦鑫,朱巧梅,孙强,等. 高温压榨花生饼粕酶法制备抗氧化肽的研究[J].中国粮油学报,2013,28(3):99-104.
[17]赵新淮,冯志彪. 大豆蛋白水解物水解度测定的研究[J].东北农业大学学报,1995,26(2):178-181.
[18]He S D,Shi J,Walida E,et al. Reverse micellar extraction of lectin from black turtle bean(Phaseolusvulgaris):Optimisation of extraction conditions by response surface methodology[J]. Food Chemistry,2015,166(1):93-100.
[19]吴向明,雕鸿荪,沈蓓英. 大豆蛋白去酰胺改性的研究[J]. 中国油脂,1996,21(5):13-16.
[20]Latif S,Pfannstiel J,Makkar H P S,et al. Amino acid composition,antinutrients and allergens in the peanut protein fraction obtained by an aqueous enzymatic process[J]. Food Chemistry,2013,136(1):213-217.
[21]Vanga S K,Singh A,Raghavan V. Effect of thermal and electric field treatment on the conformation of Ara h 6 peanut protein allergen[J]. Innovative Food Science & Emerging Technologies,2015,30:79-88.
[22]赵瑞芳,吴志华,连君,等. 加工导致的花生过敏原蛋白结构变化及其对性质的影响[J].食品工业科技,2015,36(23):386-390,394.
[23]孔祥珍,周惠明. 小麦面筋蛋白去酰胺改性的研究[J]. 食品科学,2003,24(12):47-49.
[24]赵谋明,辛佩贤,赵强忠,等. 酸性条件下花生分离蛋白亚基结构的变化规律[J]. 现代食品科技,2014,30(12):37-42.
[25]Ma T Z,Zhu H G,Wang J,et al. Influence of extraction and solubilizing treatments on the molecular structure and functional properties of peanut protein[J]. LWT-Food Science and Technology,2017,79:197-204.

