类风湿关节炎合并肺腺癌1例及文献复习
原菁蔓,赵丽军,尚莉丽,李 倩,高惠英*
(1山西医科大学第二临床医学院风湿免疫科,太原 030001;2山西医科大学第二医院风湿免疫科;*通讯作者,E-mail:gaohuiying168@163.com)
类风湿关节炎为风湿科常见的一种累及关节及各个脏器的常见病;随着环境污染、吸烟及工作压力的改变,肺癌的发生率也逐年增加,我科收治1例既往无类风湿关节炎及肺癌相关病史的患者,二者症状几乎同时出现,查阅文献得出人体内多种分子及蛋白共同参与两种疾病的发生发展。
1 病例资料
患者,男,66岁,因多关节痛1年余,加重3月,咳嗽、咳痰10 d,于2016年5月30日入我院风湿免疫科。患者于2015年5月起出现双肩关节疼痛,伴上肢抬举困难,渐累及双手第2,3,4近端指间关节、双腕、双膝关节,伴晨僵,持续3-5 min,活动后可缓解,自行外敷“膏药”治疗,关节痛可减轻。2015年6月出现发作性头晕、晕厥、跌倒,持续2-3 min自行缓解,入院前发作10次左右,发作前无诱因,无头痛、大汗、心悸,晕厥与活动、体位改变无明显相关。2016年3月再次出现多关节疼痛,伴右膝关节肿胀,晨僵持续时间大于1 h,活动后减轻。同时出现双侧肋骨疼痛,为钝痛,自行口服“布洛芬”,疼痛可缓解。5月20日上述症状加重,口服“布洛芬”效差,同时出现低热,体温最高持续在37.9 ℃,无寒战,伴咳嗽、咳白黏痰,量少,无咯血、胸憋、气紧。自发病以来,患者精神较差,乏力明显,食欲、睡眠可,大小便正常,近2年体重下降约5 kg。
既往史:反复咳嗽、咳痰10余年,多于冬季出现,每次持续3月以上,自行口服中药治疗;2014年11月5日摔伤后致“右股骨颈骨折”,行“右侧人工股骨头置换术”,间断口服“利伐沙班片”。个人史:吸烟35年,15支/d。
体格检查:体温37.9 ℃,脉搏94次/min,呼吸19次/min,血压136/100 mmHg(1 mmHg=0.133 kPa)。发育正常,营养中等,神志清楚,查体合作。右髋区可见约15 cm长瘢痕。全身浅表淋巴结未触及肿大。右侧第7肋骨及左侧第5、6、7肋骨压痛阳性,无胸骨中下段叩击痛。双肺呼吸音粗,右肺下叶可闻及散在湿啰音。心、腹未见异常。脊柱未见异常。双肩、右肘、右腕、右手第1掌指关节压痛阳性,右手第2指间关节骨性膨大,右第4近端指间关节梭形肿胀,双手骨间肌轻微萎缩。双腕及双膝活动稍受限,左肘关节屈曲160°,左上肢活动稍受限。双下肢无水肿。神经系统检查未见异常。
辅助检查:血常规:WBC 7.73×109/L,LY 0.71×109/L,PLT 341×109/L,HGB 113 g/L;尿、便常规及隐血未见明显异常,凝血功能未见异常,D-二聚体明显升高(5 083 ng/ml),ESR升高(80 mm/h),C反应蛋白升高(45.8 g/L),肝功能、肾功能、离子未见明显异常,血清白蛋白降低(31.7 g/L),多肿瘤标志物未见异常;RF 1 280 IU/ml,ANA1:320S,抗环瓜氨酸肽抗体1 265.2 RU/ml;抗Ku(+),抗杀菌/通透性增高蛋白弱阳性,p-ANCA 1 ∶40;抗ENAs、血管炎筛查(-);免疫功能:总T细胞(CD3+CD19-)516个/μl,总B细胞(CD3-CD19+)69个/μl,辅助性T细胞(CD3+CD4+)244个/μl,抑制性T细胞(CD8+T)207个/μl,自然杀伤细胞119个/μl;CD4+T细胞亚群:Th1(IFN-γ)11.74个/μl,Th2(IL-4)1.88个/μl,Th17(IL-17)4.17个/μl,Treg(CD4+CD25+FOXP3)14.32个/μl,Th17/Treg 0.29。胸部正位X片示双侧胸腔少量积液;胸部CT(2016年6月1日)双肺肺气肿伴双肺肺大泡,右肺下叶炎症伴间质性改变,双侧胸腔及叶间裂积液,纵隔淋巴结肿大(见图1,2)。骨盆正位X片示骨盆各骨骨质疏松,右侧股骨头置换术后,骨密度(腰椎+左髋)示骨质疏松,腰椎T=-2.1,左髋T=-2.7;骨扫描示全身多发骨病变,考虑恶性病变骨转移可能。
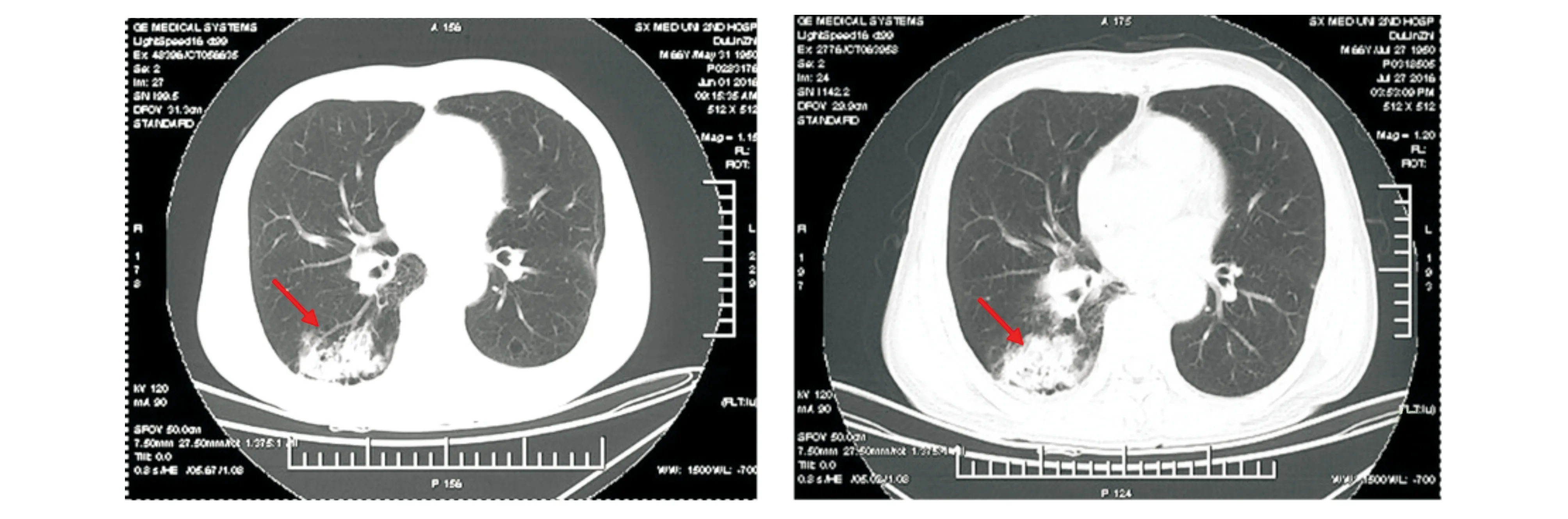
图1 该患者6月1日入院时胸部CT平扫肺窗 图2 该患者间断抗感染治疗后7月23日复查胸部CT平扫肺窗
入院诊断:①类风湿关节炎,继发性血管炎?肺部类风湿结节?肺部感染;②恶性肿瘤骨转移?③晕厥原因待查。入院后予以复方倍他米松1 ml,肌注,每日一次持续2 d,地塞米松5 mg,每日一次,静推7 d,并予注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白25 mg,皮下注射,每日一次持续1 d,注射用重组白介素-2 50万IU,皮下注射,每日一次持续5 d,同时予以抗感染、化痰、预防骨质疏松,排查晕厥原因等,患者关节疼痛明显好转,随后于6月20日自动出院。出院后仍有咳嗽、咳痰,关节痛症状反复,于2016年7月21日再次入住我科,在CT引导下肺穿刺活检(2016年8月2日):(右肺下叶)送检组织内可见异型增生的腺体,结合免疫组化结果,病变符合肺中分化腺癌。免疫组化结果:AE1/AE3(+),Vimentin(+),P63(-),P40(-),Napsin(个别细胞+),TTF-1(+),Syn(-),CgA(-),CD56(-),Ki67(+5%)(见图3,4)。
最后诊断:类风湿关节炎合并肺腺癌(中分化)。
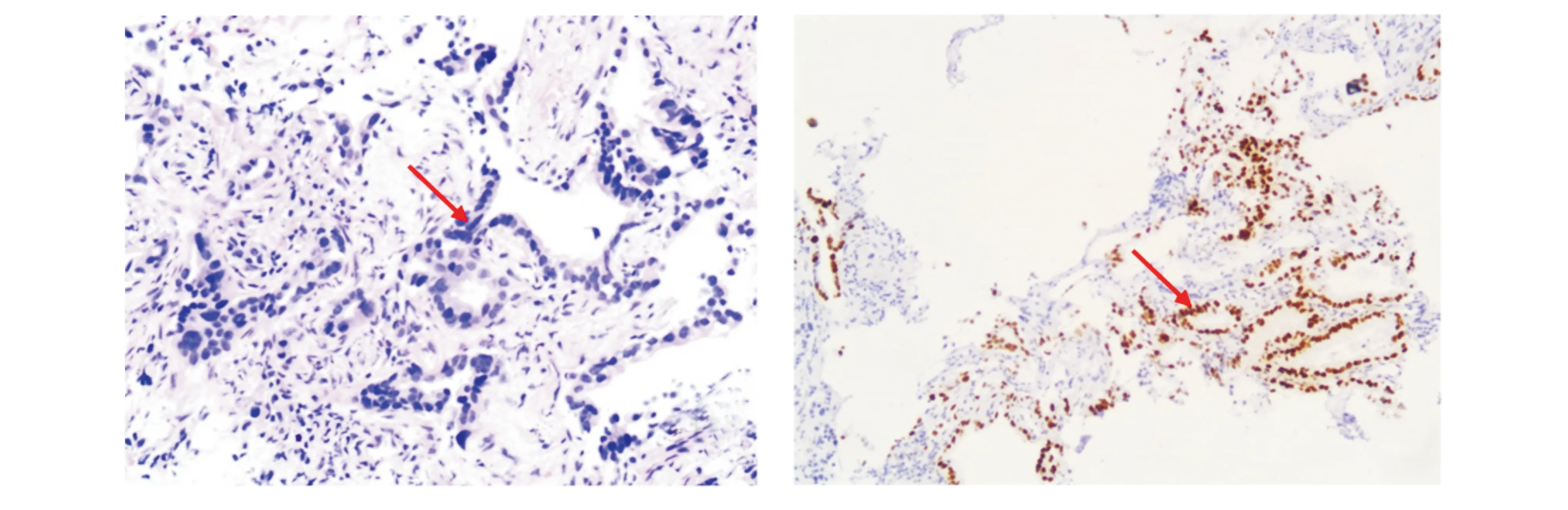
图3 该患者8月2日右肺下叶经皮肺穿刺活检病理光镜结果 (HE染色,×200)图4 该患者8月2日右肺下叶经皮肺穿刺活检免疫组化染色结果 (TTF-1染色,×100)
2 讨论
类风湿关节炎是以滑膜炎和血管炎为主要病理表现的全身性自身免疫系统疾病,除关节软骨和骨破坏以外,还可累及关节外组织,关节外受累最常见的为类风湿结节(几乎累及所有脏器:心、肺、眼等),据报道,皮下类风湿结节的发生率较高,但根据影像学表现,肺部类风湿结节的发生率不足1%[1],多发现于抗体阳性的男性患者。肺部类风湿结节与支气管肺癌有着相似的危险因素(如吸烟),相仿的临床表现、相近的影像学改变,因此,类风湿关节炎患者合并肺部病变的诊断及鉴别诊断,对临床医生来说是一个极大的挑战。
该患者有长期吸烟史,反复咳嗽咳痰,而既往单位体检胸片无明显异常,以多关节痛为首发症状,几乎同时出现发作性晕厥,晕厥原因考虑与肺病变可能有关,该患者行肺活检确诊右下肺中分化腺癌,关于类风湿关节炎与支气管肺癌的发病是否相关尚不明确,查阅相关文献发现类风湿关节炎和肺癌在某些通路上享有共同的因素。
有文献报道,在对11 782例类风湿关节炎患者与57 973例对照组的横断面研究中,经过Logistic回归分析未发现肺癌与类风湿关节炎存在显著相关性[2]。而美国的另外一项研究对483 721名退伍军人的回顾性病例对照研究显示,8 768例确诊类风湿关节炎,7 280例确诊肺癌,247人确诊类风湿关节炎合并肺癌,在校正年龄、性别、吸烟史、石棉暴露史后,通过Logistic回归分析发现患有类风湿关节炎的病人患支气管肺癌的概率是正常人的43倍(OR=1.43)[3];同样,日本的一项前瞻性队列研究,通过观察7 566例类风湿关节炎患者,并随访5年发现恶性肿瘤肺癌发病率显著升高[4]。更有研究表明:类风湿关节炎合并肺癌患者死亡率明显增加[5]。本例患者为了控制类风湿关节炎疾病的活动,在治疗过程中曾应用注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白1支,但该剂量推测并不是导致该患者肺腺癌发病的启动,有关肿瘤坏死因子拮抗剂不会增加肿瘤形成的风险有多项研究佐证[6-8]。关于类风湿关节炎与肺癌是否存在相关性值得进一步研究探讨。
文献报道YKL-40、溶血磷脂酸、基质金属蛋白酶及趋化因子受体4同时在类风湿关节炎及非小细胞肺癌中有一定的相关性,具体表现如下:①YKL-40又称为人软骨糖蛋白39(human cartilage glycoprotein-39,HCgp-39)/Chitinase 3-like 1(CHI3L1),与炎症及组织重塑有关,存在于滑膜、软骨及滑液中,可通过局部释放诱导CD4+T细胞介导特异性自身免疫反应。肺癌患者血清中YKL-40水平明显升高,并且在有远处转移的血清中尤为明显[9],早在1998年就有学者提出YKL-40可能与类风湿关节炎的组织重塑与退行性变有关[10],并且与关节损伤的程度正相关[11]。②溶血磷脂酸(lysophosphatidic acid,LPA)已经被证明与血管生成、炎症、肿瘤生长有着密切的联系,溶血磷脂酸受体-1(LPA receptor type 1,LPA1)是一种G蛋白耦联受体,在类风湿关节炎及肺癌的病理生理作用中扮演了重要的角色:Yamada等[12]发现LPA1基因突变可能诱导小鼠肺癌的发生发展,而类风湿关节炎患者滑膜中LPA1高表达,LPA1通过促进破骨细胞形成及Th17细胞分化介导关节炎症的发展[13]。③基质金属蛋白酶(matrix metalloproteinases,MMPs)作用包括组织破坏,如癌症侵袭转移,纤维化、细胞外基质降解、血管生成和凋亡等。MMP1主要介导肿瘤细胞的转移,MMP2介导纤维化的形成,MMP7与肿瘤增殖密切相关,MMP9参与降解细胞外基质,MMP-12与肿瘤的复发与转移相关[14];有研究分析了125例肺癌患者基质金属蛋白酶-1基因启动子区(-1607)1G/2G单核苷酸多态基因,发现其频率明显高于健康对照组[15],基质金属蛋白酶-2在非小细胞肺癌患者血清及痰标本中均明显升高[16];同样的,也有研究表明MMP-1,2,3,9在类风湿关节炎的骨破坏及疾病活动中具有重要的作用[17,18]。④趋化因子是驱化白细胞和干细胞定向聚集的细胞因子,趋化因子受体(the chemokine receptors,CXCR4)属于G蛋白耦联受体,多表达于免疫细胞及内皮细胞的表面,CXCR4与其配体基质细胞衍生因子-1(SDF-1)/CXCL12的相互作用同样参与癌症细胞转移及类风湿性关节炎的病理过程[19,20]。
综上所述,多种细胞因子、基因、蛋白等共同参与类风湿关节炎与肺癌的病理过程,但二者是否确有相关性仍需进一步研究探讨。关于类风湿关节炎患者肺部病变的鉴别诊断,如类风湿结节、肺部恶性疾病、肺部感染等非常重要,尤其类风湿关节炎是否合并肺癌需要临床医生高度重视。
参考文献:
[1] Kitamura A, Matsuno T, Narita M,etal. Rheumatoid arthritis with diffuse pulmonary rheumatoid nodules[J]. Pathol Int, 2004,54(10):798-802.
[2] Dagan A, Segal G, Tiosano S,etal. Coexistent malignant conditions in rheumatoid arthritis-A population-based cross-sectional study[J]. Int J Clin Pr,2017,71(3-4):e12929.
[3] Khurana R, Wolf R, Berney S,etal. Risk of development of lung cancer is increased in patients with rheumatoid arthritis: a large case control study in US veterans[J]. J Rheumatol,2008,35(9):1704-1708.
[4] Yamada T, Nakajima A, Inoue E,etal. Incidence of malignancy in Japanese patients with rheumatoid arthritis[J]. Rheumatol Int, 2011,31(11):1487-1492.
[5] Park JK, Yang JA, Ahn EY,etal. Survival rates of cancer patients with and without rheumatic disease: a retrospective cohort analysis[J]. BMC Cancer,2016,16:381.
[6] Carmona L, Abasolo L, Descalzo MA,etal. Cancer in patients with rheumatic diseases exposed to TNF antagonists[J]. Semin Arthritis Rheum,2011,41(1):71-80.
[7] Strangfeld A, Hierse F, Rau R,etal. Risk of incident or recurrent malignancies among patients with rheumatoid arthritis exposed to biologic therapy in the German biologics register RABBIT[J]. Arthritis Res Ther,2010,12(1):R5.
[8] Le Blay P, Mouterde G, Barnetche T,etal. Short-term risk of total malignancy and nonmelanoma skin cancers with certolizumab and golimumab in patients with rheumatoid arthritis: Meta analysis of randomized controlled trials[J]. J Rheumatol,2012,39(4):712-715.
[9] Libreros S, Iragavarapu-Charyulu V. YKL-40/CHI3L1 drives inflammation on the road of tumor progression[J]. J Leukoc Biol,2015,98(6):931-936.
[10] Volck B, Price PA, Johansen JS,etal. YKL-40, a mammalian member of the chitinase family, is a matrix protein of specific granules in human neutrophils[J]. Proc Assoc Am Physicians,1998,110(4):351-360.
[11] Kazakova M, Batalov A, Deneva T,etal. Relationship between sonographic parameters and YKL-40 levels in rheumatoid arthritis[J]. Rheumatol Int,2013,33(2):341-346.
[12] Yamada T, Obo Y, Furukawa M,etal. Mutations of lysophosphatidic acid receptor-1 gene during progression of lung tumors in rats[J]. Biochem Biophys Res Commun, 2009,378(3):424-427.
[13] Miyabe Y, Miyabe C, Iwai Y,etal. Activation of fibroblast-like synoviocytes derived from rheumatoid arthritis via lysophosphatidic acid-lysophosphatidic acid receptor 1 cascade[J]. Arthritis Res Ther,2014,16(5):461.
[14] Merchant N, Nagaraju GP, Rajitha B,etal. Matrix metalloproteinases: Their functional role in lung cancer[J]. Carcinogenesis,2017,38(8):766-780.
[15] 成晓龙.基质金属蛋白酶-1启动子区功能性单核苷酸多态(-1607)1G/2G与肺癌的相关性[J].山西医科大学学报,2007,38(9):777-779.
[16] Ali-Labib R, Louka ML, Galal IHE-S,etal. Evaluation of matrix metalloproteinase-2 in lung cancer[J]. Proteomics-Clin Appl,2014,8(3-4):251-257.
[17] Giannelli G, Erriquez R, Iannone F,etal. MMP-2, MMP-9, TIMP-1 and TIMP-2 levels in patients with rheumatoid arthritis and psoriatic arthritis[J]. Clin Exp Rheumatol,2004,22(3):335-338.
[18] Chen Y, Nixon NB, Dawes PT,etal. Influence of variations across the MMP-1 and-3 genes on the serum levels of MMP-1 and-3 and disease activity in rheumatoid arthritis[J]. Genes Immun,2012,13(1):29-37.
[19] Lee YL, Kuo WH, Lin CW,etal. Association of genetic polymorphisms of CXCL12/SDF1 gene and its receptor, CXCR4, to the susceptibility and prognosis of non-small cell lung cancer[J]. Lung Cancer,2011,73(2):147-152.
[20] Kanbe K, Chiba J, Inoue Y,etal. SDF-1 and CXCR4 in synovium are associated with disease activity and bone and joint destruction in patients with rheumatoid arthritis treated with golimumab[J]. Mod Rheumatol,2016,26(1):46-50.

