冠状动脉粥样硬化患者血脂及修饰化脂蛋白水平研究*
罗 薇,郭 英,都向阳,丁 霏,李小玲,贺 勇,聂 鑫,宋昊岚,李贵星
(四川大学华西医院实验医学科,成都 610041)
急性心肌梗死(AMI)是指心肌缺血导致的心肌细胞缺氧坏死而引起的急重症,是大多数国家人口死亡的主要原因之一,冠状动脉粥样硬化(AS)是AMI发生的主要病理基础[1-2]。传统研究认为,引发AS的危险因素有高脂血症、高血压、吸烟、糖尿病、肥胖和缺乏体力活动等[3]。近年来有研究表明,修饰化脂蛋白与AS的形成密切相关[4-5]。本研究分析AS患者血脂及修饰化脂蛋白水平,比较其与对照组之间的差异,探究血脂及修饰化脂蛋白与AS发生的关系,现报道如下。
1 资料与方法
1.1一般资料
1.1.1病例组 纳入2016年9-12月因AMI就诊于四川大学华西医院急诊科、最终诊断为冠状动脉粥样硬化性心脏病的220例患者作为病例组,其中男142例,女78例;年龄54~73岁,平均(56.35±2.35)岁。纳入标准:患者为首次发作,影像学检查提示冠状动脉粥样斑块,符合2015欧洲心脏病学年会急性冠状动脉综合征诊断标准,最终均行冠状动脉造影确诊为AMI[6]。排除标准:既往有陈旧性AMI、糖尿病、高血压病史的患者;严重肝肾疾病或恶性肿瘤患者;病历资料不全及不愿意提供基础信息的患者。
1.1.2对照组 纳入同期四川大学华西医院体检中心健康体检者200例作为对照组,其中男130例,女70例;年龄51~64岁,平均(51.28±1.72)岁。纳入标准:无冠心病、高血压、糖尿病、慢性阻塞性肺疾病、周围血管疾病、高脂血症、严重肝肾疾病病史;无心血管药物服用史;心电图和心脏彩超显示心脏功能正常。
1.2生化指标测定 采集所有研究对象空腹外周静脉血5 mL,颠倒混匀后取全血检测患者糖化血红蛋白(HbA1c),以3 000 r/min、离心10 min,取上清液检测空腹血糖(FBG)、三酰甘油(TG)、胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。所有指标均采用德国ROCHE公司Cobas 8000全自动生化分析仪及其配套试剂及校准品进行测定。所有标本检测均于华西医院实验医学科完成,符合试验项目标准化程序和美国病理家协会认可要求。检测完成后,将剩余血清标本分别用EP管分装置于-20 ℃冰柜冷冻保存备用。
1.3修饰化脂蛋白及脂蛋白相关磷脂酶A2( Lp-PLA2)测定 修饰化脂蛋白及Lp-PLA2检测均采用酶联免疫吸附试验(ELISA),将-20 ℃保存的研究对象血清复温,离心后取上层血清进行测定。氧化低密度脂蛋白(ox-LDL)、氧化高密度脂蛋白(ox-HDL)测定采用美国CELL BIOLABS公司提供的ELISA Kit试剂及其配套标准品。糖化低密度脂蛋白(gly-LDL)、糖化高密度脂蛋白(gly-HDL)测定采用美国TSZ公司提供的Human gly-HDL/LDL ELISA Kit试剂及其配套标准品。Lp-PLA2测定采用美国R&D Systems公司提供的Human PLA2G7/PAF-AH/Lp-PLA2 Immunoassay试剂及其配套标准品。
1.4统计学处理 采用SPSS20.0软件进行数据分析处理,正态性检验采用Kolmogorov-smirnov分析,所有指标均为非正态分布资料,故采用M(P25,P75)表示,组间比较采用秩和检验;计数资料组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1病例组与对照组修饰化脂蛋白与Lp-PLA2水平比较 见图1、表1。病例组ox-LDL、ox-HDL、gly-LDL、gly-HDL及Lp-PLA2水平明显高于对照组,差异均有统计学意义(P<0.05),见表1、图1。
2.2病例组与对照组血糖及血脂水平比较 见表2。由表2可见,病例组FBG和HbA1c高于对照组,而TC、HDL-C、LDL-C低于对照组,差异均有统计学意义(P<0.05),两组间TG差异无统计学意义(P>0.05)。

图1 病例组与对照组ox-LDL、gly-LDL、ox-HDL、gly-HDL、Lp-PLA2水平比较
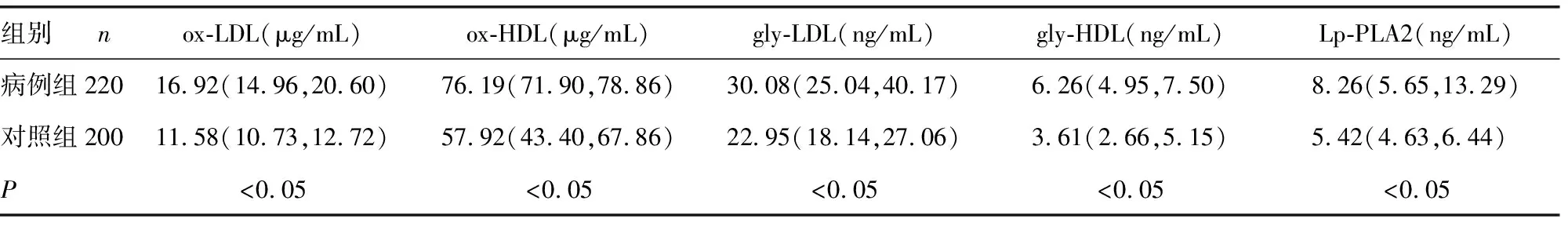
组别n ox-LDL(μg/mL)ox-HDL(μg/mL)gly-LDL(ng/mL)gly-HDL(ng/mL) Lp-PLA2(ng/mL)病例组22016.92(14.96,20.60)76.19(71.90,78.86)30.08(25.04,40.17)6.26(4.95,7.50)8.26(5.65,13.29)对照组20011.58(10.73,12.72)57.92(43.40,67.86)22.95(18.14,27.06)3.61(2.66,5.15)5.42(4.63,6.44)P<0.05<0.05 <0.05 <0.05 <0.05
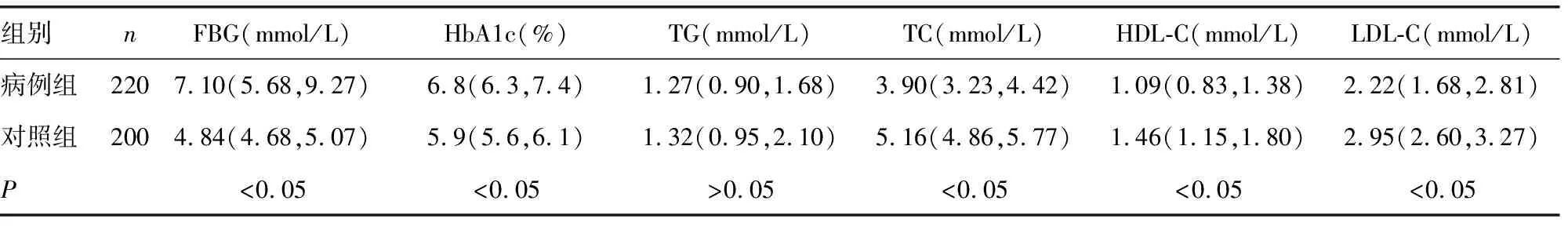
表2 病例组与对照组血糖及血脂水平比较[M(P25,P75)]
3 讨 论
AS是指动脉内膜的脂质和血液成分的沉积,平滑肌细胞及胶原纤维增生,同时伴有坏死及钙化等不同程度病变的一类慢性进行性病理过程[7]。AS所致AMI是由于冠状动脉血管腔狭窄、闭塞引起心肌供血不足,导致心肌缺血缺氧性坏死,具有高复发率、高致残率、高病死率等特点,严重威胁中老年患者身心健康[8]。有关AS的形成机制尚不完全清楚,传统观点认为,高脂血症特别是高LDL是动脉粥样硬化发生的主要危险因素[9]。但有研究显示,血脂水平与AS的关系并不密切[10-11]。2015年《美国居民膳食指南》去除了对居民TC摄入量的限制,膳食指南咨询委员会认为人体摄入TC量无须顾虑,建议控制糖摄入[12]。
正常情况下,LDL可与LDL受体结合,通过LDL受体途径进入细胞,当细胞TC水平过高时可通过下调LDL受体表达量减少LDL的摄入;另一方面可通过抑制羟甲基戊二酰辅酶A还原酶活性减少细胞内TC的合成,从而维持TC水平的稳定。HDL可将过量的TC从外周组织转运到肝脏进行清除,同时HDL还有抗炎、抗氧化功能,从而起到AS的作用。但LDL、HDL发生糖化或氧化修饰后,由于其结构改变,无法与正常受体结合。国外研究显示,修饰化的LDL、HDL只能通过清道夫受体摄入细胞,而通过清道夫受体摄入的脂质不能下调清道夫受体的表达。因此,修饰化的脂蛋白通过清道夫受体不断摄入细胞,引起TC不断堆积,最终引起细胞泡沫化,导致AS形成[13-14]。
Lp-PLA2又称血小板活化因子乙酰水解酶,是由成熟的巨噬细胞和淋巴细胞合成分泌的一种炎性标志物,能催化LDL中氧化磷脂水解释放出溶血卵磷脂和氧化型游离脂肪酸,生成的炎症因子吸引更多单核粒细胞聚集到病变部位形成巨噬细胞,进而吞噬修饰化脂蛋白形成更多的泡沫细胞,导致AS形成[15-17]。有研究显示,Lp-PLA2表达水平与动脉粥样硬化斑块稳定性及严重程度相关,且Lp-PLA2水平越高,斑块稳定性越差[18]。
本研究结果显示,病例组患者血脂水平与对照组比较无明显升高,TC、HDL-C、LDL-C水平低于对照组,但修饰化脂蛋白(ox-HDL、ox-LDL、gly-HDL、gly-LDL)及Lp-PLA2水平均明显高于对照组。表明常规降脂治疗可有效降低患者的血脂水平,AS患者并不存在高脂血症,但是修饰化脂蛋白水平明显高于对照组。因此,高水平的修饰化脂蛋白是促进AS发生和发展的重要因素,常规降脂治疗并不能明显延缓AS的发生和发展,在降脂治疗的同时更应控制修饰化脂蛋白形成。
值得注意的是,本研究结果显示,病例组FBG水平明显高于对照组,高血糖可通过对脂蛋白进行糖化形成糖基化终末产物,进而形成修饰化脂蛋白而促进泡沫细胞形成[14]。糖基化终末产物还可以趋化和活化单核巨噬细胞,并最终引发AS产生[19]。近年来,高血糖在AS发生中的作用受到越来越多的重视[10-11]。
综上所述,血脂水平并不是AS发生和发展的主要因素,而修饰化脂蛋白水平与AS的发生和发展密切相关。应进一步研究修饰化脂蛋白的形成机制及其途径,从而在降脂治疗的同时控制脂蛋白糖化和氧化,减少修饰化脂蛋白形成,这对延缓AS的发生和发展,减少动脉粥样硬化性心脏病的发生具有重要意义。
[1]LINDAHL B.Acute coronary syndrome-the present and future role of biomarkers[J].Clin Chem Lab Med,2013,51(9):1699-1706.
[2]DHOOT J,TARIQ S,ERANDE A,et al.Effect of morbid obesity on in-hospital mortality and coronary revascularization outcomes after acute myocardial infarction in the United States[J].Am J Cardiol,2013,111(8):1104-1110.
[3]KASCHINA E,GRZESIAK A,LI J,et al.Angiotensin Ⅱ type 2 receptor stimulation:a novel option of therapeutic interference with the renin-angiotensin system in myocardial infarction[J].Circulation,2008,118(24):2523-2532.
[4]CHISTIAKOV D A,OREKHOV A N,BOBRYSHEV Y V.Contribution of neovascularization and intraplaque haemorrhage to atherosclerotic plaque progression and instability[J].Acta Physiol,2015,213(3):539-553.
[5]KOULIS C,KANELLAKIS P,PICKERING R J,et al.Role of bone-marrow-and non-bone-marrow-derived receptor for advanced glycation end-products(RAGE) in a mouse model of diabetes-associated atherosclerosis[J].Clin Sci,2014,127(7/8):485-497.
[6]DAMMAN P,VAN′T HOF A W,TEN BERG J M,et al.2015 ESC guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation:comments from the Dutch ACS working group[J].Neth Heart J,2017,25(3):181-185.
[8]GOODACRE S,CROSS E,ARNOLD J,et al.The health care burden of acute chest pain[J].Heart,2005,91(2):229-230.
[9]WILLIAMS P T,ZHAO X Q,MARCOVINA S M,et al.Levels of cholesterol in small LDL particles predict atherosclerosis progression and incident CHD in the HDL-Atherosclerosis Treatment Study(HATS)[J].PLoS One,2013,8(2):e56782.
[10]DINICOLANTONIO J J,LUCAN S C,O′KEEFE J H.The evidence for saturated fat and for sugar related to coronary heart disease[J].Prog Cardiovasc Dis,2016,58(5):464-472.
[11]LI Y,HRUBY A,BERNSTEIN A M,et al.Saturated fats compared with unsaturated fats and sources of carbohydrates in relation to risk of coronary heart disease:a prospective cohort study[J].J Am Coll Cardiol,2015,66(14):1538-1548.
[12]TAGTOW A,RAHAVI E,BARD S,et al.Coming together to communicate the 2015-2020 dietary guidelines for americans[J].J Acad Nutr Diet,2016,116(2):209-212.
[13]DAI Y,CONDORELLI G,MEHTA J L.Scavenger receptors and non-coding RNAs:relevance in atherogenesis[J].Cardiovasc Res,2016,109(1):24-33.
[14]CHISTIAKOV D A,MELNICHENKO A A,OREKHOV A N,et al.How do macrophages sense modified low-density lipoproteins[J].Int J Cardiol,2017,230(2):232-240.
[15]RIBA-LLENA I,PENALBA A,PELEGRD,et al.Role of lipoprotein-associated phospholipase A2 activity for the prediction of silent brain infarcts in women[J].Atherosclerosis,2014,237(2):811-815.
[16]MAIOLINO G,BISOGNI V,ROSSITTO G,et al.Lipoprotein-associated phospholipase A2 prognostic role in atherosclerotic complications[J].World J Cardiol,2015,7(10):609-620.
[17]FENNING R S,BURGERT M E,HAMAMDZIC D,et al.Atherosclerotic plaque inflammation varies between vascular sites and correlates with response to inhibition of lipoprotein-associated phospholipase A2[J].J Am Heart Assoc,2015,4(2):e001477.
[18]BONNEFONT-ROUSSELOT D.Lp-PLA2,a biomarker of vascular inflammation and vulnerability of atherosclerosis plaques[J].Ann Pharm Fr,2016,74(3):190-197.
[19]RIZWAN H,MOHANTA J,SI S,et al.Gold nanoparticles reduce high glucose-induced oxidative-nitrosative stress regulated inflammation and apoptosis via tuberin-mTOR/NF-κB pathways in macrophages[J].Int J Nanomedicine,2017,12(1):5841-5862.

