埃克替尼联合化疗与埃克替尼单药在晚期非小细胞肺癌一线治疗中的比较研究*
王璐璐,王东林,李禄椿,李 艳,吴志鹃,阳 丹,马惠文
(重庆大学附属肿瘤医院/重庆市肿瘤研究所/重庆市肿瘤医院肿瘤内科 400030)
肺癌是我国发病率及病死率最高的肿瘤,其中非小细胞肺癌(NSCLC)占85%左右[1]。在晚期NSCLC的治疗中,特别是对于具有表皮生长因子受体(EGFR)敏感突变的NSCLC,表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)因其疗效确切、不良反应轻微、服药便利等特点,已经成为极其重要的治疗手段。埃克替尼是我国第一个拥有自主知识产权的EGFR-TKI[2-3]。ICOGEN试验中曾进行了埃克替尼与吉非替尼的比较,结果显示埃克替尼的疗效并不劣于吉非替尼,且埃克替尼具有更好的安全性[4]。在埃克替尼上市后的Ⅳ期临床研究中,738例具有EGFR敏感突变的患者经埃克替尼治疗后客观缓解率(ORR)达49.2%,疾病控制率(DCR)达92.3%,其中144例接受了埃克替尼一线治疗,ORR为56.3%,DCR为95.1%,进一步证实了埃克替尼的良好疗效,目前已被推荐为EGFR敏感突变晚期NSCLC患者的一线治疗药物[4]。EGFR-TKI虽然对于EGFR敏感突变的NSCLC患者具有良好的疗效,但是大多数患者在用药几个月后发现病情继续恶化,EGFR-TKI的疗效下降,这种现象被称为获得性耐药[5]。这种不可避免的耐药现象使EGFR-TKI的疗效达到瓶颈。为了延缓EGFR-TKI的耐药时间,进一步提高其在一线治疗中的疗效,研究者探索了EGFR-TKI联合治疗模式,如EGFR-TKI联合化疗、EGFR-TKI联合放疗、EGFR-TKI联合其他靶向治疗等。目前,EGFR-TKI联合化疗虽然展现出一定的临床应用前景,但其是否可以取得比EGFR-TKI单药更好的疗效,有效提高EGFR-TKI在一线治疗中的疗效,成为更好的选择方案,目前尚无定论。以往的研究多集中在吉非替尼或厄洛替尼,对于在一线治疗中埃克替尼联合化疗的疗效尚少有报道。本研究比较埃克替尼联合化疗与埃克替尼单药治疗在EGFR敏感突变晚期NSCLC一线治疗中的疗效及安全性,为EGFR-TKI联合化疗作为一线治疗方案提供更多的临床依据,现报道如下。
1 资料与方法
1.1一般资料 以2013年1月至2015年12月就诊于本院具有完整病例资料的78例肺癌患者作为研究对象。详细记录每例患者的年龄、性别、吸烟史、EGFR突变类型、最佳疗效、生存数据及不良反应。
1.2纳入标准 (1)年龄18~80岁;(2)体力状况评分(EOCG PS评分)≤2分;(3)病理检查证实为NSCLC;(4)基因检测结果显示为EGFR敏感突变(19外显子缺失或21外显子突变);(5)一线治疗为埃克替尼单药治疗或埃克替尼联合化疗。
1.3治疗方法 患者采用埃克替尼单药治疗或埃克替尼联合化疗。埃克替尼用量均为125 mg,3次/天,化疗方案为肺癌治疗中的常用化疗方案,包括培美曲塞+卡铂/顺铂、紫杉醇+卡铂/顺铂等。用法用量:培美曲塞500 mg/m2,每3周重复1次;紫杉醇135~175 mg/m2,每3~4周重复1次;顺铂75 mg/m2,每3周重复1次;卡铂200~300 mg/m2,每3周重复1次。
1.4疗效及不良反应评价 采用RECIST1.1标准评价患者治疗后近期疗效,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。本研究的首要研究终点为无进展生存期(PFS),次要研究终点为总生存期(OS)、客观缓解率(ORR)、疾病控制率(DCR)及不良反应。PFS定义为自患者首次治疗(埃克替尼单药或埃克替尼联合化疗)直至患者出现疾病进展或死亡或随访结束的时间;OS定义为自患者首次治疗直至患者死亡或最后1次随访的时间;ORR为CR+PR例数所占比例;DCR为CR+PR+SD例数所占比例。不良反应按照 CTCAE4.0版评价为0~4级。
1.5统计学处理 采用SPSS22.0软件进行数据处理。生存分析采用Kaplan-Meier法。计数资料以例数或百分率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1两组患者病例资料比较 见表1。78例具有EGFR敏感突变的晚期NSCLC患者纳入本研究,其中男32例,女46例;中位年龄(58.2±3.1)岁。36例接受埃克替尼联合化疗一线治疗方案者作为A组,男13例(36.1%),女23例(63.9%),平均年龄(59.2±1.6)岁;42例接受埃克替尼单药治疗者作为B组,男19例(45.2%),女23例(54.8%);平均年龄(58.1±3.8)岁。所有患者均经病理证实为肺腺癌,48例具有19外显子缺失,30例具有21外显子突变。A组化疗方案包括培美曲塞+卡铂/顺铂(11例),紫杉醇+卡铂/顺铂(25例)。A组与B组患者的性别、年龄、吸烟史等一般资料比较差异均无统计学意义(P>0.05),具有可比性。
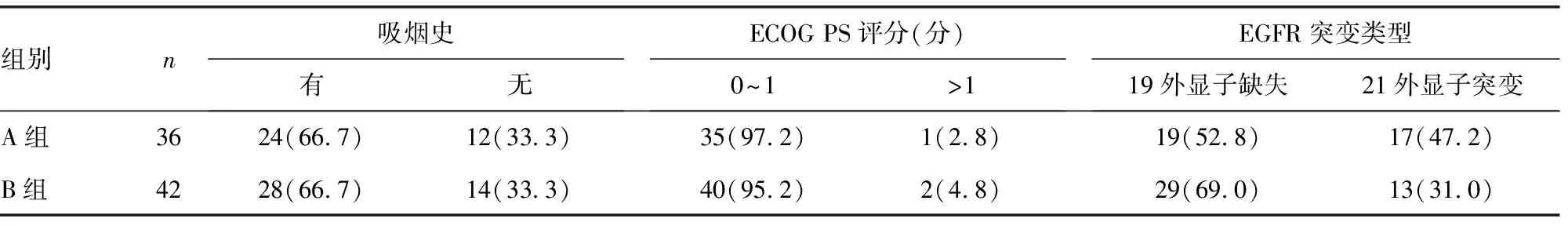
表1 两组患者病例资料比较[n(%)]
2.2两组患者近期疗效分析 见表2。A组2例为CR,25例为PR,8例为SD,1例为PD;A组ORR为75.0%(27/36),DCR为97.2%(35/36)。B组1例为CR,20例为PR,19例为SD,2例为PD;B组ORR为50.0%(21/42),DCR为95.2%(40/42)。A组ORR明显优于B组,差异有统计学意义(P=0.024),两组DCR差异无统计学意义(P=0.650)。
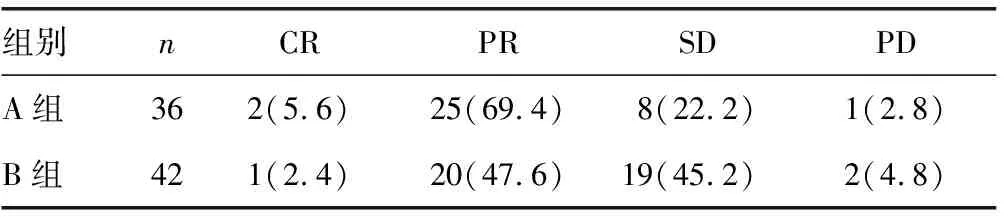
表2 两组患者近期疗效分析[n(%)]
2.3两组患者PFS及OS比较 见图1。至2017年3月,78例患者全部出现疾病为PD。A组中位PFS为12.4个月(95%CI:10.6~14.8),B组中位PFS为8.6个月(95%CI:7.4~9.8),相对于埃克替尼单药治疗,埃克替尼联合化疗可获得更长的PFS,两组PFS差异有统计学意义(P<0.05)。另外,至随访结束的时间,78例患者中有55例死亡。A组中位OS为23.3个月(95%CI:19.7~26.8),B组中位OS为18.9个月(95%CI:16.5~21.3),两组OS比较差异有统计学意义(P=0.037)。
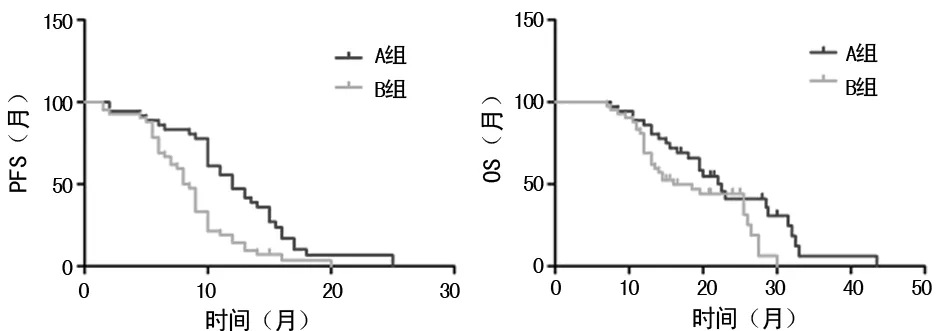
图1 两组患者PFS及OS比较
2.4两组EGFR19外显子缺失患者PFS及OS比较 见图2。亚组分析结果显示, A组EGFR19外显子缺失患者中位PFS为14.4个月(95%CI:12.0~16.9),B组中位PFS为9.3个月(95%CI:7.9~10.7),两组EGFR 19外显子缺失患者PFS比较差异有统计学意义(P<0.05); A组EGFR19外显子缺失患者中位OS为24.9个月(95%CI:21.9~27.9),B组中位OS为19.5个月(95%CI:16.3~22.6),两组EGFR19外显子缺失患者OS比较差异有统计学意义(P=0.032)。
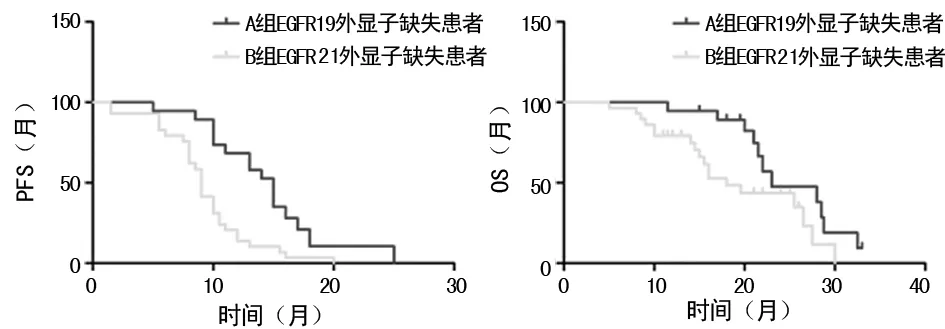
图2 两组EGFR19外显子缺失患者PFS及OS比较
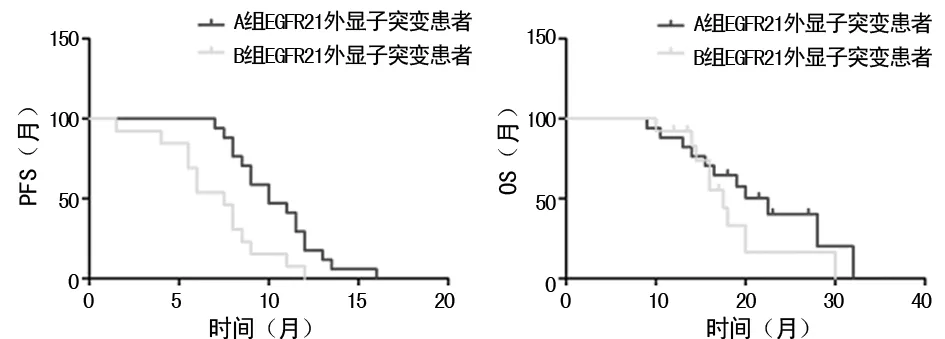
图3 两组EGFR21外显子突变患者PFS及总OS
2.5两组EGFR21外显子突变患者PFS及OS比较 见图3。A组EGFR21外显子突变患者中位PFS为10.4个月(95%CI:9.3~11.6),B组EGFR21外显子突变患者中位PFS为7.1个月(95%CI:5.6~8.6),两组PFS比较差异有统计学意义(P=0.004);A组EGFR21外显子突变患者中位OS为21.8个月(95%CI:17.7~25.9),B组EGFR21外显子突变患者中位OS为18.6个月(95%CI:14.6~22.6),两组OS比较差异无统计学意义(P=0.252)。
2.6两组患者不良反应比较 见表3。A组主要不良反应包括血液学毒性(中性粒细胞减少、白细胞减少、贫血、血小板减少等)、胃肠道反应(恶心、呕吐、腹泻、便秘等)、皮疹、肝功能损伤等。B组主要不良反应为皮疹、腹泻等。A组不良反应多因为化疗,大多不良反应为1~2级,大部分患者可耐受,未出现药物相关死亡事件。
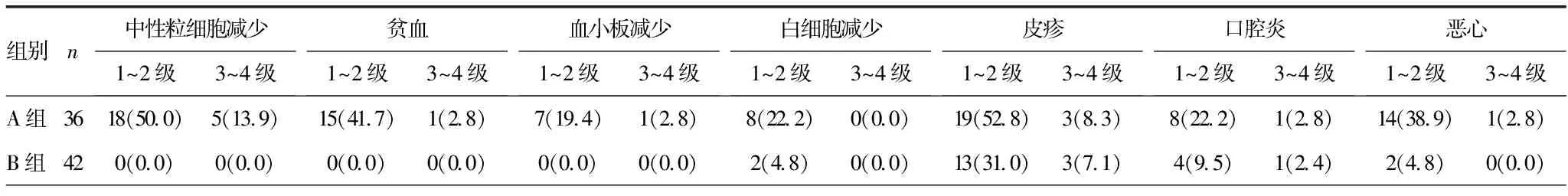
表3 两组患者不良反应比较[n(%)]

组别n呕吐1~2级3~4级腹泻1~2级3~4级便秘1~2级3~4级丙氨酸氨基转移酶升高1~2级3~4级乏力1~2级3~4级脱发1~2级3~4级肺炎1~2级3~4级A组3614(38.9)0(0.0)12(33.3)0(0.0)4(11.1)0(0.0)13(36.1)3(8.3)8(22.2)0(0.0)6(16.7)0(0.0)2(5.6)0(0.0)B组422(4.8)0(0.0)9(21.4)0(0.0)4(9.5)0(0.0)5(11.9)0(0.0)3(7.1)0(0.0)0(0.0)0(0.0)0(0.0)0(0.0)
3 讨 论
虽然在EGFR敏感突变NSCLC患者的治疗中EGFR-TKI明显延长了患者的PFS,但是因为获得性耐药的原因,患者在用药一段时间后均会发生肿瘤进展[3,6]。如何克服EGFR-TKI获得性耐药是近几年的研究热点,其策略包括延缓EGFR-TKI的耐药时间或在耐药后采取更好的治疗方案。在前期探索中发现,TKI与其他治疗方式联合是延缓TKI耐药时间的主要研究方向。多种联合方式中,TKI与化疗联合展现出了一定的优势。但在早期的几项临床研究(INTACT-1、INTACT-2等)中发现,TKI联合化疗并未展现出优于单纯化疗的生存获益,分析其原因可能是因为EGFR-TKI只对EGFR敏感突变的患者有效,而研究中未对EGFR的突变状态进行筛选分类,其中仍包含部分EGFR野生型患者,因而导致联合治疗的优势并未展现[7-10]。在近年的几项研究中,研究者们对患者进行了EGFR突变状态的筛选,结果发现,一线使用吉非替尼或厄洛替尼与化疗联合可延长患者PFS。如CHENG等[11]在Ⅱ期临床研究中探索了EGFR敏感突变NSCLC患者一线使用吉非替尼联合培美曲塞并与吉非替尼单药治疗的疗效及安全性进行比较,结果显示,吉非替尼联合培美曲塞组中位PFS为15.8个月,吉非替尼单药治疗组中位PFS为10.9个月。另外一项研究在EGFR敏感突变NSCLC患者的一线治疗中,探索了吉非替尼联合培美曲塞/卡铂、吉非替尼单药和培美曲塞/卡铂的疗效,结果显示,3组中位PFS分别为18.83、12.00、5.75个月[11]。从以上结果均可以看出,相对于吉非替尼单药或化疗,具有EGFR敏感突变的晚期NSCLC患者一线使用吉非替尼联合化疗可明显延长PFS。在厄洛替尼相关的2项研究中也发现,对于具有EGFR敏感突变的NSCLC患者,一线使用厄洛替尼联合化疗的PFS优于厄洛替尼单药治疗[12-13]。目前EGFR-TKI联合化疗是否可延长患者的OS,作为一线治疗方案成为延缓TKI耐药的主要策略,真正为患者带来生存获益尚无定论,仍需更多的研究提供临床依据,故本研究分析了埃克替尼联合化疗的疗效及安全性。
本研究回顾性分析了78例一线采用埃克替尼联合化疗或埃克替尼单药治疗EGFR敏感突变晚期NSCLC患者的临床资料,目的为探索埃克替尼联合化疗是否可以延缓埃克替尼的耐药时间,提高埃克替尼在一线治疗中的疗效。结果发现,埃克替尼联合化疗组中位PFS为12.4个月,ORR为66.7%,DCR为97.2%;埃克替尼单药治疗组中位PFS为8.6个月,ORR为50.0%,DCR为95.2%。由此可以看出,相对于埃克替尼单药治疗,埃克替尼联合化疗明显提高了ORR,延长了患者的中位PFS。虽然在随访截止时,仍有23例患者未达到最后的OS,但从目前结果来看,埃克替尼联合化疗组中位OS为23.3个月,优于单药治疗组的18.9个月。本研究还进行了亚组分析,结果发现,与埃克替尼单药比较,埃克替尼联合化疗不仅明显延长了具有EGFR19外显子缺失患者的PFS,而且明显延长了患者的OS。但是对于21外显子突变患者来说,埃克替尼联合化疗虽然延长了患者的PFS,但两组患者OS差异无统计学意义(P>0.05)。从本研究结果来看,对于具有EGFR敏感突变的患者,埃克替尼联合化疗相对于埃克替尼单药治疗具有更好的疗效,可作为延缓NSCLC一线治疗中埃克替尼耐药的有效方法,特别是对于19外显子缺失的患者。但因本研究纳入患者数量较少,该结论仍需要进一步研究加以证实。另外,A组出现了较多的不良反应,大多是化疗引起的血液学毒性或胃肠道反应,但大多较轻微,3级及以上不良反应出现较少,经对症处理后大多可明显缓解。埃克替尼相关的不良反应有皮炎、腹泻等,大部分患者均可耐受。
总之,本研究结果与吉非替尼或厄洛替尼的研究结果类似,相对于EGFR-TKI单药治疗,EGFR-TKI联合化疗具有更好的疗效,为EGFR-TKI联合化疗在EGFR敏感突变NSCLC一线治疗提供了更多的临床依据。但本研究是一项回顾性研究,样本量较少,埃克替尼联合化疗是否可以成为一线治疗中更好的选择仍需前瞻性研究。
[1]JEMAL A,SIEGEL R,XU J,et al.Cancer statistics,2010 [J].CA Cancer J Clin,2011,61(2):133-134.
[2]ZHOU C,WU Y L,CHEN G,et al.Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-smallcell lung cancer(OPTIMAL,CTONG-0802):a multicentre,open-label,randomised,phase 3 study [J].Lancet Oncol,2011,12(8):735-742.
[3]MITSUDOMI T,MORITA S,YATABE Y,et al.Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor(WJTOG3405):an open label,randomised phase 3 trial[J].Lancet Oncol,2010,11(2):121-128.
[4]SHI Y,ZHANG L,LIU X,et al.Icotinib versus gefitinib in previously treated advanced non-small-cell lung cancer(ICOGEN):a randomised,double-blind phase 3 non-inferiority trial[J].Lancet Oncol,2013,14(10):953-961.
[5]ACKMAN D,PAO W,RIELY G J,et al.Clinical defi nition of acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small-cell lung cancer[J].J Clin Oncol,2010,28(2):357-360.
[6]ROSELL R,CARCERENY E,GERVAIS R,et al.Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC):a multicentre,open-label,randomised phase 3 trial[J].Lancet Oncol 2012,13(3):239-246.
[7]HERBST R S,GIACCONE G,SCHILLER J H,et al.Gefitinib in combination with paclitaxel and carboplatin in advanced non-small-cell lung cancer:a phase Ⅲ trial-INTACT 2[J].J Clin Oncol,2004,22(5):785-794.
[8]GIACCONE G,HERBST R S,MANEGOLD C,et al.Gefitinib in combination with gemcitabine and cisplatin in advanced non-small-cell lung cancer:a phase Ⅲ trial-INTACT 1[J].J Clin Oncol,2004,22(5):777-784.
[9]HERBST R S,PRAGER D,HERMANN R,et al.TRIBUTE:a phase Ⅲ trial of erlotinib hydrochloride(OSI-774) combined with carboplatin and paclitaxel chemotherapy in advanced non-small-cell lung cancer[J].J Clin Oncol,2005,23(25):5892-5899.
[10]GATZEMEIER U,PLUZANSKA A,SZCZESNA A,et al.Phase Ⅲ study of erlotinib in combination with cisplatin and gemcitabine in advanced non-small-cell lung cancer:the Tarceva Lung Cancer Investigation Trial[J].J Clin Oncol,2007,25(12):1545-1552.
[11]CHENG Y,MURAKAMI H,YANG P C,et al.Randomized phase Ⅱ trial of gefitinib with and without pemetrexed as first-line therapy in patients with advanced nonsquamous non-small-cell lung cancer with activating epidermal growth factor receptor mutations[J].J Clin Oncol,2016,34(27):3258-3266.
[13]HIRSCH F R,KABBINAVAR F,EISEN T,et al.A randomized,phase Ⅱ,biomarker-selected study comparing erlotinib to erlotinib intercalated with chemotherapy in first-line therapy for advanced non-small-cell lung cancer[J].J Clin Oncol,2011,29(26):3567-3573.

