菌根真菌提高紫苏根腐病抗性的机制研究
刘芳洁
(晋中职业技术学院,山西晋中 030600)
紫苏(PerillafrutescensL.),别称红苏、赤苏,属一年生唇形科紫苏属草本植物,在我国常作为蔬菜、药用植物及油料作物进行栽培,已有2 000多年的栽培历史[1]。紫苏根腐病是国内外紫苏栽培中常见的病害之一,致病菌为半知菌链孢霉真菌,以土壤为媒介进行传播,危害较为严重,严重影响紫苏的产量和品质,如何提高紫苏根腐病抗性已成为紫苏栽培中急需解决的关键问题[2]。菌根真菌是土壤中存在的一类可与植物根系形成有益共生体的微生物,主要有内生菌根、外生菌根及内外生菌根三大类型。众多研究证实,菌根真菌可以改善植物根系的生态环境,促进植物生长,提高植物抵御不良环境的能力,尤其在提高植物抗病性方面作用显著[3-5]。韩亚楠等研究表明,接种AM真菌可显著提高连作西瓜的植株生物量,并对西瓜枯萎病的发生具有一定的防治效果[6];张淑彬等研究表明,接种丛枝菌根真菌可有效防止辣椒苗期疫霉病的发生,且不同菌种防治效果存在很大差异[7];秦海滨等研究表明,接种丛枝菌根真菌可显著提升黄瓜幼苗的生物量及保护酶活性,显著提高立枯病抗性,降低发病率[8];张茹琴等研究表明,4种外生菌根真菌均可与油松幼苗形成菌根,灰鹅膏菌对油松猝倒病防治效果最好[9];赵菊莲等研究认为,接种菌根真菌可显著提升草莓的保护酶活性,提高对枯萎病的抗性[10];刘东岳等研究表明,丛枝菌根真菌和植物根围促生细菌同时接种可显著提升黄瓜枯萎病抗性,且不同菌剂组合防治效果差异显著[11];湛蔚等研究表明,接种丛枝菌根真菌可明显提升杨树根系的超氧化物歧化酶(SOD)、苯丙氨酸解氨酶(PAL)、几丁质酶(CHT)及β-1,3-葡聚糖酶(GLU)活性,杨树溃疡病抗性效果显著优于接种外生菌根真菌[12]。菌根真菌的生物学效应常因寄主植物而异[13],而目前尚未见关于菌根真菌对紫苏根腐病抗性的影响研究报道。因此,本研究以奇苏1号紫苏为试验材料,分析不同菌根真菌对紫苏根腐病抗性的影响,并对其机制进行研究,以期为紫苏根腐病的生物防治提供参考和借鉴。
1 材料与方法
1.1 试验材料
供试紫苏品种为奇苏1号,由贵州省农业科学院油菜研究所提供。供试丛枝菌根真菌为摩西球囊霉(Glomusmosseae),外生菌根真菌为褐黄牛肝菌(Boletusluridus),均由北京市农林科学院菌根真菌种质库提供;紫苏根腐病病原菌半知菌链孢霉真菌由笔者所在实验室自主分离保存;供试基质为草炭蛭石(1 ∶1)。
1.2 试验方法
1.2.1 试验设计 试验于2016年8月15日开始实施,选取长势一致的奇苏1号幼苗180株,分别定植于30 cm×40 cm 的花盆中,每盆1株,栽培基质为灭菌的草炭蛭石。试验共设置3个处理,即分别于定植前接种15 g丛枝菌根真菌(AMF)、接种15 g外生菌根真菌(ECMF)及接种灭菌的15 g菌根真菌(CK),每处理20盆,重复3次,共计180株,试验期间给予各处理正常的水肥管理。定植90 d后,测定各处理的菌根侵染率。侵染成功后,接种半知菌链孢霉真菌,随水浇于根际4周,接种量为2.0×106CFU/g土。
1.2.2 测定指标及方法 菌根侵染率采用Phillips等的方法[14]进行测定,菌根侵染率=侵染菌根段数/检测菌根段数×100%;病情指数调查方法:自接种半知菌链孢霉真菌起,各处理每隔5 d调查1次,病情指数及防病效果按赵仕光等的方法[15]进行计算;自接种半知菌链孢霉真菌起,各处理每隔5 d进行一次生理生化指标测定,测定样品为紫苏根系。超氧化物歧化酶(SOD)活性采用抑制NBT光还原比色法测定;过氧化物酶(POD)活性采用愈创木酚法测定;过氧化氢酶(CAT)活性采用紫外分光光度法进行测定;苯丙氨酸解氨酶(PAL)活性采用苯丙氨酸比色法进行测定;丙二醛(MDA)含量测定采用硫代巴比妥酸比色法;脯氨酸(Pro)含量测定采用磺基水杨酸提取法;几丁质酶(CTH)及β-1,3-葡聚糖酶(GLU)活性参照Fink等的方法[16]进行测定。
1.2.3 数据分析 采用Excel 2010进行数据整理及作图,用SPSS 18.0软件进行差异显著性分析。
2 结果与分析
2.1 菌根真菌对紫苏根腐病病情指数及防病效果的影响
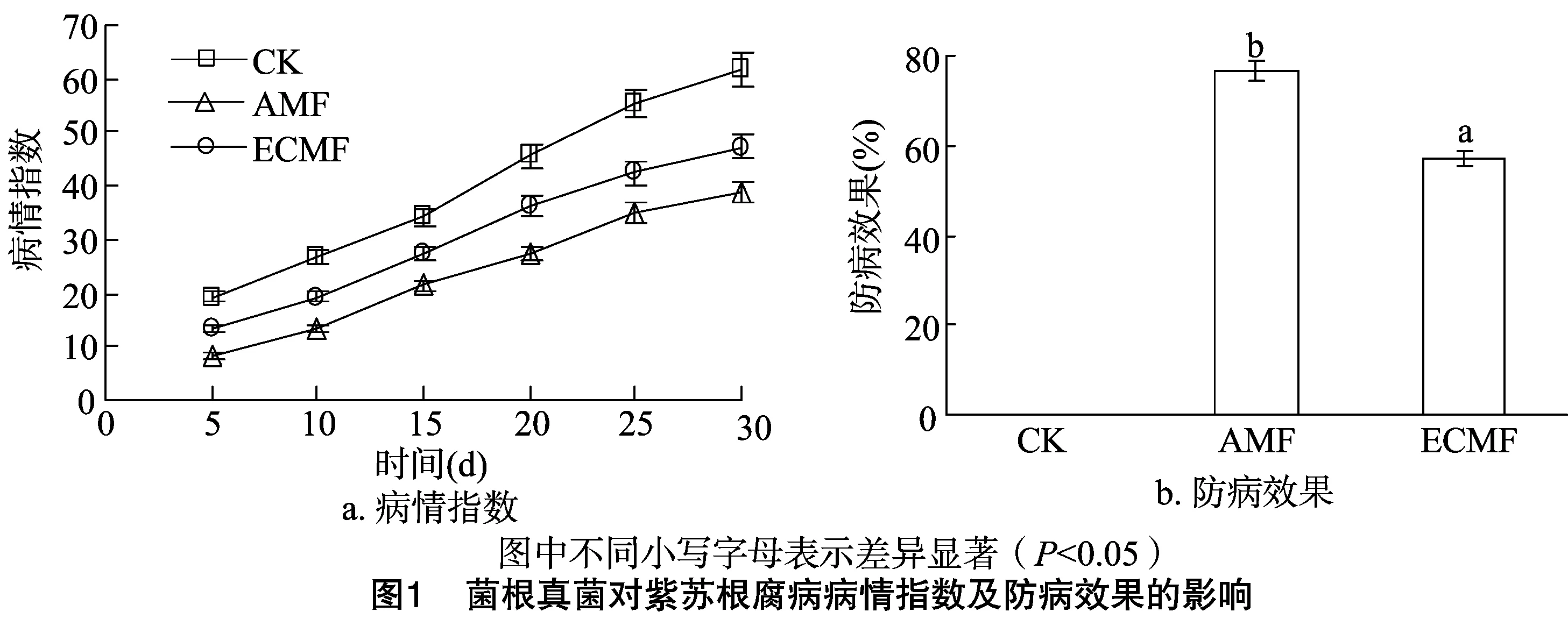
菌根真菌接种90 d后,接种AMF和ECMF的菌根侵染率分别达到82.36%和73.25%,对照无菌根产生。这说明,AMF和ECMF均可与紫苏形成良好的互利共生关系,且紫苏幼苗期AMF侵染率较高。菌根真菌对紫苏根腐病病情指数及防病效果的影响如图1所示,在整个试验期间,3种处理的根腐病病情指数均随着紫苏的生长逐渐升高,其中,接种AMF真菌的病情指数始终保持最低,其余依次为接种ECMF的和CK(图1-a);接种半知菌链孢霉真菌30 d时,CK、AMF和ECMF的病情指数分别达到61.82、39.02和47.28,假定CK防效为0,接种AMF和ECMF的防效分别达到76.82%和 57.25%(图1-b)。这说明,接种菌根真菌可显著提升紫苏的根腐病防治效果,且接种AMF效果显著优于ECMF。
2.2 菌根真菌对紫苏根系保护酶活性的影响
由表1可知,接种半知菌链孢霉真菌后,3种处理条件下的紫苏根系超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)及苯丙氨酸解氨酶(PAL)4种保护酶活性均随着时间的推移呈现先升高后降低的趋势,且接种AMF的保护酶活性始终保持最高,依次为接种ECMF和对照(CK)。接种半知菌链孢霉真菌10 d时,对照(CK)的SOD、POD、CAT及PAL活性均达到最高,分别为32.28、261.58、272.53、2.02 U/(g·min);接种AMF和ECMF的紫苏根系SOD、POD及CAT酶活性均在接种半知菌链孢霉真菌20 d时达到最大,其中接种AMF的紫苏根系SOD、POD及CAT酶活性分别为 43.05、372.83、342.36 U/(g·min),较同期CK分别提升 49.95%、68%和222.67%,均达到极显著差异水平(P<0.01);接种ECMF的紫苏根系SOD、POD及CAT酶活性分别为40.14、352.26、325.81 U/(g·min),较同期CK分别提升39.81%、58.73%和111.91%,均达到显著差异水平(P<0.05);接种AMF和ECMF的紫苏根系PAL酶活性均在接种半知菌链孢霉真菌15 d时达到最大,分别为2.42、 2.32 U/(g·min),较同期CK分别提升81.95%和74.44%,分别达到极显著(P<0.01)和显著差异水平(P<0.05)。这说明,接种菌根真菌可显著提升半知菌链孢霉真菌侵染的紫苏根系的保护酶活性,且接种AMF的提升效果显著高于接种ECMF(P<0.05)。
2.3 菌根真菌对紫苏根系丙二醛及游离脯氨酸含量的影响
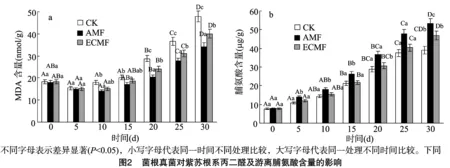
菌根真菌对紫苏根系丙二醛(MDA)含量的影响如图2-a所示,接种半知菌链孢霉真菌后,3种处理条件下的紫苏根系MDA含量均随着时间的推移呈现先降低后升高的趋势,且接种AMF的紫苏根系MDA含量始终保持最低,其余依次为接种ECMF的和对照(CK)。接种半知菌链孢霉真菌5 d时,CK的根系MDA含量达到最低,为15.47 nmol/g,而接种AMF和ECMF的紫苏根系MDA含量均在接种半知菌链孢霉真菌 10 d 时达到最低,分别为14.02、15.18 nmol/g。接种半知菌链孢霉真菌30 d时,CK、接种AMF和ECMF等3种处理的紫苏根系MDA含量均达到最大,分别为47.88、34.22、40.02 nmol/g,接种AMF和ECMF的分别较CK降低28.53%和16.42%,分别达到极显著(P<0.01)和显著差异水平(P<0.05)。这说明,根腐病病原菌侵染初期的紫苏根系MDA含量略有下降,随后逐渐升高,而接种菌根真菌的紫苏根系MDA含量则显著低于同期CK,且接种AMF效果显著优于接种ECMF(P<0.05)。
由图2-b可知,接种半知菌链孢霉真菌后,3种处理条件下的紫苏根系游离脯氨酸(Pro)含量均随着时间的推移呈现逐渐升高的趋势,且接种AMF的紫苏根系Pro含量始终保持最高,其余依次为接种ECMF的和对照(CK)。接种半知菌链孢霉真菌30 d时,CK、接种AMF和ECMF这3种处理的紫苏根系Pro含量均达到最大,分别为39.03、53.28、46.81 μg/g,接种AMF和ECMF的分别较CK高36.51%和19.93%,与对照相比分别达到极显著(P<0.01)和显著差异水平(P<0.05)。这说明,接种菌根真菌可显著提升半知菌链孢霉真菌侵染的紫苏根系的游离脯氨酸(Pro)含量, 且接种AMF效果显著优于接种ECMF(P<0.05)。

表1 菌根真菌对紫苏根系保护酶活性的影响
注:不同小写字母表示同项指标不同处理差异显著(P<0.05),不同大写字母表示同项指标同一处理不同时间之间差异显著(P<0.05)。
2.4 菌根真菌对紫苏根系几丁质酶(CHT)和β-1,3-葡聚糖酶(GLU)活性的影响
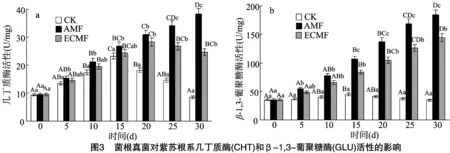
菌根真菌对紫苏根系几丁质酶(CHT)活性的影响如图 3-a所示,接种半知菌链孢霉真菌后,对照(CK)和接种ECMF的紫苏根系CHT活性随着时间的推移呈现先升高后降低的趋势,而接种AMF的紫苏根系CHT活性则呈现逐渐升高的趋势,且接种AMF的CHT活性始终保持最高,其余依次为接种ECMF的和CK。在接种半知菌链孢霉真菌15 d时,CK处理的CHT活性达到最大,为23.26 U/mg,而接种AMF和ECMF处理的CHT活性则分别在接种半知菌链孢霉真菌 20 d 和30 d时达到最大,分别为38.22、28.26 U/mg,较同期CK分别提升345.97%和55.62%,分别达到极显著(P<0.01)和显著差异水平(P<0.05)。这说明,接种菌根真菌可显著提升半知菌链孢霉真菌侵染的紫苏根系的几丁质酶活性,且接种AMF的提升效果显著高于接种ECMF的(P<0.05)。
由3-b可知,接种半知菌链孢霉真菌后,对照(CK)的紫苏根系β-1,3-葡聚糖酶(GLU)活性随着时间的推移呈现先升高后降低的趋势,而接种AMF和ECMF的紫苏根系GLU活性则呈现逐渐升高的趋势,且接种AMF的GLU活性始终保持最高,其余依次为接种ECMF的和CK。接种半知菌链孢霉真菌15 d时,CK的紫苏根系GLU活性达到最大,为 45.24 U/mg。接种AMF和ECMF的紫苏根系GLU活性在接种半知菌链孢霉真菌30 d时达到最大,分别为183.72、143.86 U/mg,分别较同期CK提升431.29%和316.02%,分别达到极显著(P<0.01)和显著差异水平(P<0.05)。这说明,接种菌根真菌可显著提升半知菌链孢霉真菌侵染的紫苏根系的β-1,3-葡聚糖酶活性,且接种AMF的提升效果显著高于接种ECMF(P<0.05)。
3 结论与讨论
菌根真菌可与植物根系形成互利共生体,参与植物的多种代谢过程,生物学效应广泛[17-17],尤其在诱导植物提高抗病性方面作用显著,减轻病害发生程度[3-5]。本研究结果表明,AMF和ECMF均可与紫苏形成菌根,侵染率分别达到82.36%和73.25%,对紫苏根腐病的防效分别达到76.82%和57.25%。
植物在遭遇生物和非生物胁迫时,其体内的抗性防御系统会被启动,以最大程度减少逆境对自身的伤害。大量研究表明,形成菌根的植株可以对病原菌的入侵产生快速的防御反应,可以明显提高植物的保护酶活性,进而有效清除因病原菌入侵而形成的氧化逆境,防止对细胞产生更严重的氧化损失,提升植物对病原菌的抗性[19-21]。本研究结果表明,接种菌根真菌可显著提升半知菌链孢霉真菌侵染的紫苏根系的SOD、POD、CAT及PAL活性,且接种AMF的提升效果显著高于接种ECMF,其原因可能是由于AMF与紫苏的亲和度高于ECMF所致;MDA是反映细胞膜膜脂过氧化程度的重要指标。本研究结果表明, 接种菌根真菌可显著降低半知菌链孢霉真菌侵染的紫苏根系的MDA,且接种AMF的降低效果显著优于接种ECMF,这说明接种AMF的紫苏细胞膜受损害程度最轻,其原因可能是接种AMF的紫苏根系保护酶活性显著高于接种ECMF和对照所致;游离脯氨酸含量是反映植物响应逆境强弱的重要指标。本研究结果表明,接种菌根真菌可显著提升半知菌链孢霉真菌侵染的紫苏根系的游离脯氨酸含量,且接种AMF效果显著优于接种ECMF,这说明接种AMF的紫苏响应半知菌链孢霉真菌侵染的能力较强。
几丁质酶和β-1,3-葡聚糖酶通过破坏真菌细胞壁而抑制病原菌的生长,是植物对病原菌入侵的一种重要的防卫反应[22]。湛蔚等研究表明,接种AMF可明显提高溃疡病病菌侵染杨树幼苗的几丁质酶和β-1,3-葡聚糖酶活性,而接种ECMF则提升效果不明显[12]。本研究结果表明,接种菌根真菌可显著提升半知菌链孢霉真菌侵染的紫苏根系的几丁质酶及β-1,3-葡聚糖酶活性,且接种AMF的提升效果显著高于接种ECMF,这说明接种AMF的紫苏防卫反应显著优于接种ECMF,本研究结果与湛蔚等的研究结果[12]存在一定出入,其原因尚待进一步研究。
综上所述,接种AMF可显著提升紫苏根腐病的防治效果,其原因是接种AMF可显著提升紫苏根系的保护酶活性,缓解病原菌入侵对植物细胞膜造成的伤害,提升了植物对病原菌入侵的响应能力,几丁质酶和β-1,3-葡聚糖酶活性显著提升,显著抑制了病原菌的生长。
参考文献:
[1]马 尧,孙玉开. 不同品种紫苏形态、生理指标初步研究[J]. 种子,2009,28(6):51-53.
[2]何永梅. 紫苏主要病虫害防治要点[J]. 北京农业,2012,12(6):16-17.
[3]袁丽环,闫桂琴. 丛枝菌根化翅果油树幼苗根际土壤微环境[J]. 植物生态学报,2010,34(6):678-686.
[4]王林闯,贺超兴,张志斌. AM真菌对不同栽培基质甜椒生长及产量品质的影响[J]. 中国蔬菜,2010(16):32-37.
[5]刘润进,唐 明,陈应龙. 菌根真菌与植物抗逆性研究进展[J]. 菌物研究,2017,15(1):70-88.
[6]韩亚楠,毕美光,刘润进,等. AM真菌对连作西瓜生长及其枯萎病的影响[J]. 北方园艺,2013(13):150-153.
[7]张淑彬,刘建斌,王幼珊. 丛枝菌根真菌对辣椒疫霉病害防治的初步研究[J]. 北方园艺,2015(5):125-128.
[8]秦海滨,张志斌,贺超兴. 丛枝菌根真菌提高黄瓜幼苗抗立枯病作用研究[J]. 华北农学报,2014,29(增刊1):98-102.
[9]张茹琴,唐 明,张海涵. 四种外生菌根真菌对油松幼苗的抗猝倒病和促生作用[J]. 菌物学报,2011,30(5):812-816.
[10]赵菊莲. 丛枝菌根真菌诱导草莓枯萎病抗性机理研究[J]. 北方园艺,2013(17):115-117.
[11]刘东岳,李 敏,孙文献,等. 抗黄瓜枯萎病丛枝菌根真菌与根围促生细菌组合菌剂的筛选[J]. 植物病理学报,2016,46(6):821-832.
[12]湛 蔚,刘洪光,唐 明. 菌根真菌提高杨树抗溃疡病生理生化机制的研究[J]. 西北植物学报,2010,30(12):2437-2443.
[13]杜俊卿. 接种丛枝菌根真菌对不同绿化植物根际微环境的影响[J]. 江苏农业科学,2017,45(18):149-152.
[14]Phillips J M,Hayman D S. Improved procedures for clearing roots and staining parasitic and vesicular arbuscular mycorrhizal fungi for rapid assessment of infection[J].Transactions of the British Mycological Society, 1970,55:158-160.
[15]赵仕光,景 耀,杨俊秀. 杨树树皮内过氧化物酶和多酚氧化酶活性与抗溃疡病的关系[J].西北林学院学报, 1993,8(3):13-17.
[16]Fink W,Liefland M,Mendgen K. Chitinases and beta-1,3-glucanases in the apoplastic compartment of oat leaves(AvenasativaL.)[J].Plant Physiology,1988,88(2):273-275.
[17]李少朋,毕银丽,彭星.接种丛枝菌根真菌对矿井水回灌玉米生长的影响[J]. 江苏农业科学,2016,44(5):112-115.
[18]王丽丽,杨 谦. 接种枯草芽孢杆菌和丛枝菌根真菌促进红三叶修复石油污染土壤[J]. 江苏农业科学,2016,44(5):526-529.
[19]李 敏,王维华,刘润进. AM真菌和镰刀菌对西瓜根系膜脂过氧化作用和膜透性的影响[J]. 植物病理学报,2003,33(3):229-232.
[20]Kapoor R.Induced resistance in mycorrhizal tomato is correlated to concentration of jasmonic acid[J]. Journal of Biological Sciences,2008,8(3):49-56.
[21]高雁琳,李钧敏,闫 明.接种AMF对煤矿废弃物上高丹草根系生长及抗氧化酶系统的影响[J]. 江苏农业科学,2016,44(12):452-456.
[22]左豫虎,康振生,杨传平,等.β-1,3-葡聚糖酶和几丁质酶活性与大豆对疫霉根腐病抗性的关系[J]. 植物病理学报,2009,39(6):600-607.

