抗纤益心方通过TGF-β/Smads信号通路改善糖尿病心肌病大鼠心肌纤维化和心功能的研究
张会超,聂恒,芮浩淼,曹程浩,杨凤鸣
(河南省中医院 心血管科,河南 郑州 450002)
糖尿病是一组由多病因引起的以慢性高血糖为特征的终身性代谢性疾病,其长期血糖增高对患者的大血管、微血管、心、脑、肾等产生较大影响,具有高发病率、高致死率、高致残率以及并发症多的特点[1]。糖尿病性心肌病(diabetic cardiomyopathy,DC)是糖尿病患者常见的一种严重并发症,可导致患者心力衰竭或猝死等,严重威胁患者生命安全[2]。研究表明,DC患者心肌纤维化是导致其心脏舒张与收缩功能不全,发生难治性心力衰竭的重要机制之一[3-4]。研究[5-6]表明,转化生长因子-β1(transforming growth factor-β1,TGF-β1)通过激活其下游Smads蛋白,调控相关细胞外基质合成基因定位转录,参与多种组织或是器官纤维化的发生。抗纤益心方是目前临床上心肌病治疗较常用的药方,具有抑制或减少心肌细胞凋亡的作用[7]。该方能改善患者心功能,但其机制尚不十分清除,为此本研究拟探讨抗纤益心方改善DC患者心功能是否与改善心肌纤维化有关,并探讨TGF-β/Smads信号通路是否参与其中。
1 材料与方法
1.1 动物分组与处理
选取40只大鼠,随机分成对照组(control group,C组)、抗纤益心方组(anti fibrinolytic group,AF组)、DC组、DC+AF组4组,每组10只,大鼠平均体重为(109.65±21.30)g。采用链脲佐菌素(STZ)单次腹腔注射制作DC大鼠模型,当大鼠血糖浓度>16.7 mmol·L-1则认为造模成功。各组大鼠作如下处理:C组大鼠予单次腹腔注射生理盐水;AF组大鼠先予单次腹腔注射生理盐水,随后用抗纤益心方溶液18.8 g·kg-1·d-1灌胃处理;DC组大鼠仅予单次腹腔注射STZ;DC+AF组大鼠先予单次腹腔注射STZ,随后应用抗纤益心方溶液灌胃处理。各组大鼠连续用药8周后处死。
1.2 指标检测
1.2.1 血液动力学检测 采用颈动脉心室内插管法评估大鼠的心脏血流动力学指标左室收缩压(left ventricular systolic pressure,LVSP)和左室舒张末压(left ventricular end diastolic pressure,LVEDP)。
1.2.2 心室肌组织Ⅰ型胶原蛋白(collagen Ⅰ,Col Ⅰ)表达检测 大鼠处死后收集心室肌标本,采用OCT包埋剂处理后冷冻,并将其制成5 mm的切片,经固定、复温、洗涤后封存。然后滴加Col Ⅰ 抗体在37 ℃下处理30 min,洗涤后滴加Alexa Fluor 488荧光标记二抗,甘油封片后采用免疫荧光染色在荧光显微镜下评价Col Ⅰ的表达情况。
1.2.3 TGF-β/Smads检测方式 大鼠处死后收集心室肌标本,经RIPA裂解液匀浆、离心后获得心室肌组织总蛋白。然后检测蛋白浓度、分离,电转印至PVDF膜上,封存后分别滴加TGF-β1、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)、Smad2、Smad3抗体,在4 ℃条件下孵育12 h,然后再次洗涤,室温下孵育30 min后显色法显色,采用蛋白质印迹法检测TGF-β1、Smad2、Smad3蛋白水平表达,蛋白的磷酸化水平采用蛋白质印迹法评价。
1.3 统计学处理
2 结 果
2.1 抗纤益心方对DC大鼠血糖以及心功能的影响
DC组、DC+AF组大鼠血糖浓度明显高于C组(P<0.05);AF组大鼠血糖浓度及LVEDP、LVSP与C组比较差异无统计学意义(P>0.05);DC组LVEDP显著上升(P<0.05),LVSP显著下降(P<0.05),DC+AF组大鼠LVSP明显高于DC组(P<0.05),LVEDP低于DC组(P<0.05)。见表1。
表1各组大鼠血糖及心功能指标检测结果比较
Tab1EffectofKangxianYixinrecipeonbloodglucoseandcardiacfunctionindiabeticcardiomyopathyrats

组 别n血糖水平/mmol·L-1LVEDP/mmHgLVSP/mmHgC组108.78±1.3424.56±2.34120.47±12.54AF组108.14±1.6426.27±3.61122.34±15.67DC组1022.15±4.57ab51.24±5.67ab69.85±8.67abDC+AF组1023.64±5.31ab40.23±4.12c85.34±12.34c
a 与C组比较,P<0.05;b 与AF组比较,P<0.05;c 与DC组比较,P<0.05
2.2 抗纤益心方处理对DC大鼠心肌纤维的影响
C组、AF组、DC组、DC+AF组大鼠Col Ⅰ表达水平依次为(1.63±0.67)、(1.72±0.71)、(3.14±1.52)、(2.12±1.26)ng·ml-1,DC组及DC+AF组显著高于C组(P<0.05),DC+AF组显著低于DC组(P<0.05),见图1。
2.3 抗纤益心方处理对DC大鼠心肌细胞TGF-β/Smads信号通路的影响
DC组大鼠TGF-β1、Smad2及Smad3的磷酸化水平显著高于C组(P<0.05),而DC+AF组大鼠TGF-β1、Smad2及Smad3的磷酸化水平显著低于DC组(P<0.05),C组与AF组大鼠TGF-β1、Smad2及Smad3比较差异无统计学意义(P>0.05),见表2、图2(图中p指磷酸化)。
3 讨 论
DC是指发生在糖尿病患者身上,并且不能用高血压性心脏病、冠心病等其他相关心脏病来解释的一种特异性心肌病[8]。该病常见的临床症状为心功能异常,患者主要表现为心脏重塑。心脏重塑包括心肌细胞与非心肌细胞重塑两种[9]。非心肌细胞发生重塑主要是大鼠成纤维细胞的增殖,进一步转化为肌成纤维细胞,而后者可分泌与合成细胞外基质(extracellular matrix,ECM),使患者心脏发生纤维化,进而出现心室重塑[10]。ECM在临床上的分类较多,但以Col Ⅰ最为常见,并且占所有ECM成分的80%以上,而Col Ⅰ的高度表达可提高人体心肌僵硬度,长期如此可导致心室收缩以及舒张功能下降[11-12]。在本研究中,DC组大鼠LVEDP及LVSP发生明显异常的同时伴有心肌细胞中明显的Col Ⅰ沉积,证明DC组大鼠心脏存在心功能异常并且有可能是心脏纤维化所导致。

图1各组大鼠心肌组织冰冻切片ColⅠ免疫荧光染色图像
Fig1ImmunohistochemicalstainingoffrozensectionsofColⅠinmyocardiumofratsineachgroup
表2各组大鼠心肌细胞TGF-β/Smads信号通路激活情况
Tab2EffectsofKangxianYixinrecipeonTGF-β/Smadssignalingpathwayincardiomyocytesofdiabeticcardiomyopathyrats

组 别nTGF-β1Smad2Smad3C组100.45±0.120.44±0.120.64±0.21AF组100.41±0.100.39±0.110.62±0.19DC组100.98±0.35ab0.95±0.52ab1.56±0.57abDC+AF组100.72±0.24c0.63±0.37c0.81±0.35c
a 与C组比较,P<0.05; b 与AF组比较,P<0.05; c 与DC组比较,P<0.05
DC对患者危害较大,严重者可导致患者猝死。因此在寻找合适治疗方式的同时,寻找其发生机制才是研究重点[13]。目前认为DC导致患者发生成纤维化的机制与高血糖引起的氧化应激、肾素-血管紧张素-醛固酮系统、基质金属蛋白酶、内皮素、TGF-β1等相关因子的表达水平增加有关[14-15]。Smads蛋白是TGF-β1下游的重要信号分子,Smad2及Smad3的磷酸化水平与下游胶原蛋白的表达密切相关[16]。有研究表明,TGF-β1能刺激Smad2、Smad3等蛋白的表达,同时抑制胶原酶原以及基质酶原等因子表达,促进心肌发生纤维化,从而加重患者的心功能异常[17]。在本研究中,DC组大鼠TGF-β1、Smad2及Smad3的磷酸化水平显著高于其他几组大鼠,提示TGF-β1信号通路参与DC组大鼠心脏纤维化过程,而且TGF-β1/Smads信号通路在DC组大鼠心肌细胞中呈高度活化状态。
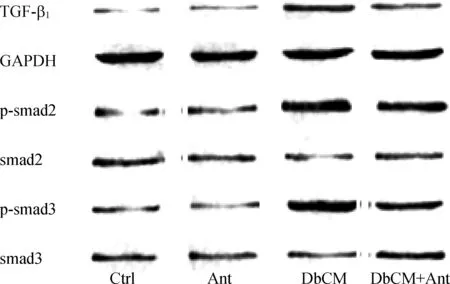
图2各组大鼠心肌组织TGF-β1、GAPDH、p-Smad2、Smad2、p-Smad3、Smad3免疫印迹
Fig2TheexpressionofTGF-β1,GAPDH,p-Smad2,Smad2,p-Smad3andSmad3inthemyocardiumofratsineachgroup
临床上根据DC发病机制研究出了各种控制DC进一步发展的药物。孙佳欢等[18]学者研究中药在心肌纤维化患者中的临床作用,结果证明,中药中不同活性成分对心肌纤维化起到一定的抑制效应,其疗效明显优于西药治疗。抗纤益心方主要由党参、茯苓、黄芪、丹参、白术、川芎、赤芍、泽兰、红花、益母草组成,具有抗纤维化、抗炎等多种生物学活性[19]。相关研究表明,抗纤益心方能稳定扩张型心肌病大鼠的血压,为β阻滞剂以及血管紧张素转化酶抑制剂的应用提供依据[20]。本研究发现,抗纤益心方在DC+AF组大鼠模型中能发挥抗心脏纤维化、改善大鼠心功能的作用,同时DC+AF组大鼠Col Ⅰ、TGF-β1、Smad2及Smad3的磷酸化水平明显低于DC组,进一步证明抗纤益心方通过抑制TGF-β1/Smads信号通路的表达,从而控制心肌纤维化进一步发展。
综上所述,抗纤益心方对DC大鼠心肌纤维化具有一定的抑制作用,且能改善大鼠的心功能,其作用机制与TGF-β/Smads信号系统密切相关。
[参考文献]
[1] 潘劲,胡如英,龚巍巍,等.浙江省2007至2012年糖尿病流行特征的描述性分析[J].中华内分泌代谢杂志,2015,31(10):846-850.
[2] 程天宇,鄢高亮,王栋,等.和肽素水平与糖尿病大鼠合并冠心病的相关性研究[J].东南大学学报:医学版,2016,56(3):327-331.
[3] 李俊龙,曹新冉,王莹,等.青蒿素对糖尿病心肌病大鼠心功能及纤维化的影响[J].上海中医药杂志,2016,63(3):70-73.
[4] 张花治,金智生,王东旭,等.红芪多糖对db/db小鼠糖尿病心肌病心肌纤维化的改善作用[J].中国临床药理学杂志,2017,33(3):239-243.
[5] 赵婷,李丹,刘晓雯,等.SLC7A5对肿瘤细胞增殖的影响及其与转化生长因子-β1信号调控的关系[J].中南大学学报:医学版,2017,42(5):485-492.
[6] 崔佳瞿,吴小涛.转化生长因子β超家族对椎间盘退变影响的研究进展[J].东南大学学报:医学版,2015,56(3):439-443.
[7] 王振涛,常红波,吴鸿,等.抗纤益心浓缩丸对扩张型心肌病大鼠心功能及心室重构的影响[J].中国中医急症,2017,26(3):394-396.
[8] 赵娜,潘硕,张勇,等.TGF-β/Smads信号通路参与苦参素抑制糖尿病心肌病大鼠心肌纤维化及改善心功能作用[J].山西医科大学学报,2015,46(11):1056-1060.
[9] 武洁,杨晓君,王晶,等.TGF-β1/Smads信号通路对PM2.5致大鼠肺组织损伤的免疫调控作用[J].西北药学杂志,2017,32(3):316-321.
[10]肖一佳,沈祥春,李杰平,等.心肌纤维化与TGF-β-Smad信号系统[J].中国新药杂志,2016,25(2):182-186.
[11]金智生,王东旭,张花治,等.红芪多糖对db/db小鼠糖尿病心肌病TGF-β1/Smads信号通路影响的实验研究[J].北京中医药大学学报,2017,40(1):20-26.
[12]孙晓慧,牟艳玲.糖尿病心肌病相关信号通路的研究进展[J].生理科学进展,2015,46(6):419-423.
[13]高原,谢世阳,王幼平,等.加参方通过抑制TGF-β/Smads信号转导通路改善大鼠心肌梗死后心室重构的机制[J].中华中医药杂志,2017,32(3):1328-1332.
[14]韩安邦,张健,路迎冬,等.芪苈强心胶囊对心肌梗死大鼠心肌纤维化及TGF-β1/Smad3信号通路的影响[J].北京中医药大学学报,2017,40(1):41-47.
[15]VIDYA K,RAMOJI K,LI H,et al.Forkhead box transcription factor 1:role in the pathogenesis of diabetic cardiomyopathy[J].Cardiovasc Diabetol,2016,15(1):44.
[16]孙桂芳,张晓芬,陈亚峰,等.转化生长因子-β1/Smads 信号在增生性瘢痕形成中的作用研究进展[J].创伤外科杂志,2015,16(5):473-477.
[17]UMME S,XUE M,SAYED A S M,et al.Role of transforming growth factor-β1 and Smads signaling pathway in intrauterine adhesion[J].Mediators Inflamm,2016,35(6):415.
[18]孙佳欢,于琨,刘玉,等.中药抗心肌纤维化的药效物质基础的研究进展[J].中医药导报,2016,23(15):86-90.
[19]JI Q,LIU X,HAN Z,et al.Resveratrol suppresses epithelial-to-mesenchymal transition in colorectal cancer through TGF-β1/Smads signaling pathway mediated Snail/E-cadherin expression[J].Bmc Cancer,2015,15(1):97.
[20]曾垂义,王振涛.抗纤益心方对扩张型心肌病大鼠血压的影响[J].中医学报,2016,31(8):1186-1188.

