全脊柱内镜及微创通道下椎间盘摘除治疗腰椎间盘脱出及对腰椎稳定性的影响
张在恒,厉玉杰,张元豫,邓少杰,张科
(深圳市宝安区人民医院骨科,广东 深圳 518101)
目前,对于腰椎间盘脱出的患者骨外科医生首选外科治疗,但选择哪一种手术方式仍有争议。全脊柱内镜、腰椎微创通道下椎间盘摘除及开放手术椎间盘摘除植骨融合固定等方法均在临床中应用[1-3]。由于腰椎后路植骨融合手术存在创伤大、术后并发症较多等问题,而全脊柱内镜、腰椎微创通道手术能够在解除神经压迫的同时,可维持腰椎的稳定性,近远期效果肯定,已逐渐成为腰椎间盘脱出患者的常规治疗方式[4]。本研究分别应用全脊柱内镜、腰椎微创通道治疗腰椎间盘脱出患者65例,疗效满意,现报告如下。
1 资料与方法
1.1 基本资料 随机选择自2012年9月至2017年12月接受治疗的腰椎间盘脱出患者65例,其中A组33例患者为应用全脊柱内镜组,B组32例患者为应用微创通道组。A组33例患者中男17例,女16例;年龄18~66岁,平均39.6岁;手术节段共33节段。B组32例患者中男17例,女15例;年龄19~73岁,平均41.9岁;手术节段共32节段。
患者术前需行腰椎正侧位及动力位X线、MRI或CT检查,结合临床病史及体查明确诊断。入组标准:a)腰椎MRI或CT提示1个节段腰椎间盘脱出,病变节段影像可解释临床症状及体征;b)L4~5或L5S1椎间盘脱出。排除标准:a)多节段腰椎间盘脱出;b)伴有腰椎滑脱;c)神经根管骨性狭窄,需切除关节突;d)患者因其他疾病无法耐受麻醉及手术。
1.2 影像学测量 两组患者均摄术前、术后腰椎正侧位及腰椎动力位X线片,测量腰椎水平位移及腰椎生理曲度的变化情况;术前及术后行腰椎CT或MRI检查,比较术前、术后神经根及硬膜囊受压变化。
1.3 手术方法 全脊柱内镜(经椎板间入路):取俯卧位,常规消毒,铺单,应用C型臂X线机定位手术节段,从穿刺切口长约0.7 cm进入,逐层应用1%利多卡因进行局部麻醉,穿刺到L4或L5椎体一侧下关节突及椎板内侧缘处,插入导针,逐级放入软组织扩张管,最后放入工作套管。电凝止血后,应用蓝钳及髓核钳清除部分黄韧带及硬膜外脂肪,神经探子探查后见神经根明显水肿,突出髓核压迫神经,髓核钳依次取出突出的髓核组织,同时应用等离子刀头进椎间盘内行消融热凝,修整椎间盘破口后再次热凝,同时探查松解对侧神经根,直至神经根松弛。彻底止血,常规送病检。
微创通道:全身麻醉,取俯卧位,常规消毒,铺单,透视下定位手术椎间隙水平。在手术椎间隙沿腰背正中线旁开1.5 cm做长约2 cm纵行切口,切开皮肤、浅筋膜、深筋膜,钝性分离椎旁肌肉直至椎板表面,逐级扩张软组织,置入通道,撑开软组织,固定好通道,再次术中透视,见通道位置良好在椎间隙平面,遂连接光源。清理椎板表面软组织,彻底止血后对手术间隙相邻的椎板开窗,尽量减少对上下椎板的破坏,依次切除黄韧带,显露硬膜囊和神经根,椎间盘突出压迫神经根,致神经根紧张无法移动,止血后对神经根管彻底减压,从神经根的外侧对纤维环切开,彻底清除变性突出的髓核组织及钙化组织后,探查神经根处未见突出髓核,神经根的移动性明显增大达到1~1.5 cm,彻底减压、松解神经根后止血,放入止血纱布,放负压引流管1根,逐层缝合,敷料包扎。
1.4 手术效果评价 记录日本骨科协会(Japanese orthopaedic association,JOA)评分、视觉模拟评分(visual analogue scale,VAS)、腰椎生理曲度(Cobb角)、腰椎水平位移(horizontal displacement,HD)的变化情况。腰椎生理曲度应用Cobb法测量,腰椎水平位移是指侧位X线片示上位椎体后缘相对于下位椎体后缘向前或向后滑移的水平距离[5-6]。通过术后随访测量以上指标来综合评价脊柱全内镜系统及微创通道的手术效果及对腰椎稳定性的影响。
1.5 统计学检测 收集65例腰椎间盘脱出患者的临床资料,应用统计学软件SPSS 19.0对临床资料数据进行统计学分析,计数及计量资料分别采用χ2检验与t检验,P<0.05为差异有统计学意义。
2 结 果
两组患者全脊柱内镜及微创通道手术顺利,椎间盘摘除及神经根松解充分,无手术失误及神经损伤等严重并发症。A组患者术后2例仍有腰部轻度疼痛症状,约3个月后症状消失。B组患者术后3例患者腰部仍有轻度疼痛症状,对症处理后好转;2例患者出现腰部切口积液,给予对症处理约2周后积液消失、切口愈合;3例患者仍残留下肢感觉障碍,2例患者1年后完全恢复,1例患者仍保留轻度皮肤感觉障碍。A组患者随访时间为16~63个月,平均36.7个月;B组患者随访时间为17~62个月,平均35.2个月。随访过程中未发现椎间盘突出复发、椎间隙感染及腰椎终板炎等并发症。两组患者在术后随访时,患者JOA评分、VAS评分均较术前有明显改善,差异具有统计学意义(P<0.05,见表1~2)。两组患者腰椎生理曲度及水平位移术前及术后比较,差异无统计学意义(P>0.05,见表1~2)。两组患者中出血量、切口长度、手术时间、住院时间、下地时间及休息时间比较,差异具有统计学意义(P<0.05,见表3)。
典型病例一为28岁男性患者,主诉腰腿部疼痛伴活动3年,加重伴左下肢乏力1周。诊断为L5S1椎间盘脱出,行全脊柱内镜下腰椎间盘摘除及神经根松解术,术后随访患者疼痛、麻木及乏力症状消除,治疗效果良好(见图1~2)。典型病例二为32岁男性患者,主诉腰腿部疼痛伴活动1年,加重伴右下肢麻木、乏力1个月。诊断为L4~5椎间盘脱出,行微创通道下腰椎间盘摘除及神经根松解术,术中发现纤维环破裂,小部分髓核脱出。术后随访患者疼痛、麻木及乏力症状消除,治疗效果良好(见图3~4)。
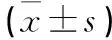
表1 A组术前及术后结果比较
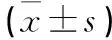
表2 B组术前及术后结果比较
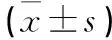
表3 两组手术指标对比
3 讨 论
腰椎间盘脱出患者常伴有明显的腰腿痛症状,神经根被脱出的髓核组织明显压迫,保守治疗效果差,且神经根长时间受压会导致神经变性,进而引起肢体的感觉和运动障碍。因此,在临床治疗中手术为首选治疗方式[7]。在腰椎的微创治疗中,胶原酶溶解术因存在进入蛛网膜腔内的风险而被逐渐放弃,激光气化、射频消融、臭氧溶解等经皮穿刺治疗方式尽管仍有临床报道,但因在治疗中很难去除脱出的髓核组织,治疗效果往往较差。腰椎后路小切口开窗、微创通道、脊柱内镜等手术方式能够完全取出脱出的髓核组织,神经根得到充分的松解,治疗效果良好。本研究探讨全脊柱内镜系统与微创通道系统治疗腰椎间盘脱出患者的临床疗效及并发症的差异,探讨其对腰椎生理曲度及稳定性的影响。
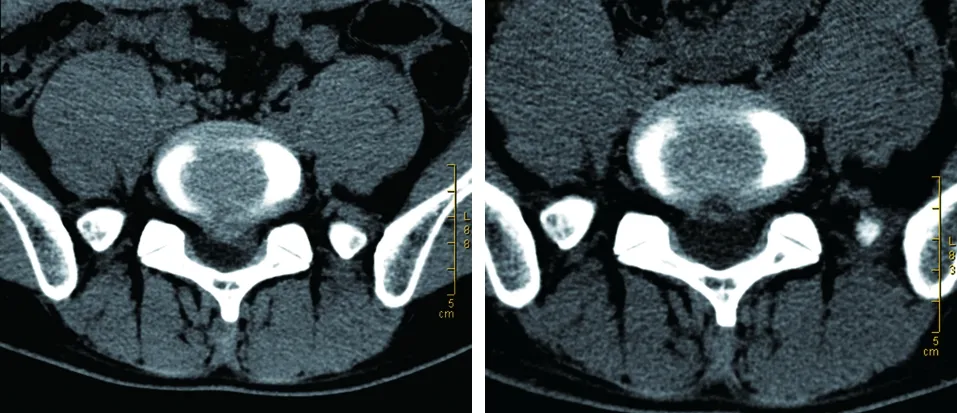
图1 术前CT示L5S1椎间盘中央偏左脱出,硬膜囊及左侧神经根明显受压,相应椎管狭窄 图2 术后CT示L5S1椎间盘大部切除,硬膜囊、神经根受压明显缓解
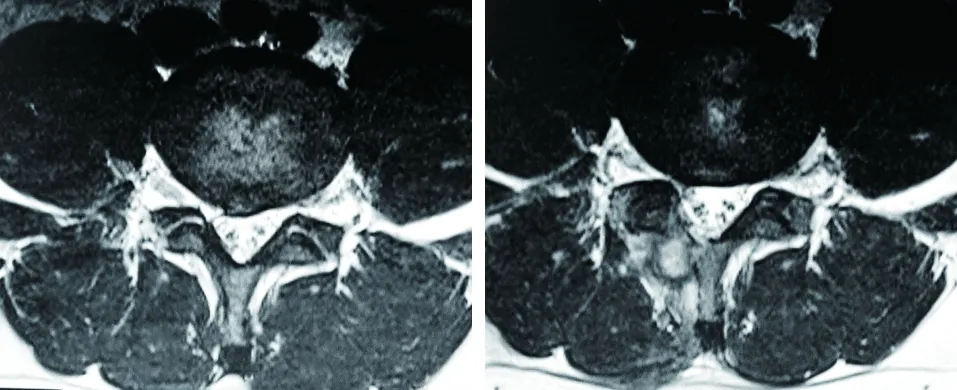
图3 术前MRI示L4~5椎间盘中央偏右脱出,硬膜囊及右侧神经根明显受压 图4 术后MRI示L4~5椎间盘已大部分切除,硬膜囊、神经根受压明显缓解
腰椎微创通道Quandrant可扩张系统目前在临床中普遍应用,是治疗腰椎间盘脱出的主要治疗方式。因特有的冷光源系统使术野更加清晰,手术操作时间更短,同时对于骨赘形成导致的单侧椎管狭窄及神经根管狭窄可以进行有效的切除,因此手术适应证较为广泛。近期应用Quandrant通道进行腰椎后路减压、融合及内固定治疗腰椎疾病多有报道[8]。本研究选取的病例均为腰椎间盘脱出患者,与全脊柱内镜相比临床效果虽无明显差异,但微创通道中手术操作时间明显缩短,术中术野清晰,范围较广。
全脊柱内镜(椎间孔镜)因其创伤小、恢复快,对腰椎稳定性无明显破坏,逐渐成为脊柱外科治疗腰椎间盘脱出的首选方式。Yue等[9]认为应用全脊柱内镜系统能够拥有更清晰的镜下术野,减少组织创伤;适应证的选择很重要,目前的脊柱内镜系统已扩展到经椎板间入路进行减压,但脊柱内镜学习曲线较长,培训应认真对待。Chen等[10]认为经椎板间入路全脊柱内镜下行椎间盘摘除在临床中能够取得良好的治疗效果。尽管脊柱内镜技术的适应证仍在不断发展,但这种技术还是有局限性的。游离的椎间盘碎片可以更好地使用传统的开放椎间盘切除方法或腰椎微创通道技术来取出。伴随先天和获得性骨性椎管狭窄也可以通过开放的减压技术得到更好的治疗。最后,在马尾综合征可能是明显或即将发生的情况下,也可以使用开放技术或通道下微创手术。
神经损伤、椎间隙感染是腰椎后路微创手术后较严重的并发症。本研究中全脊柱内镜及微创通道组患者均未出现较严重的并发症,仅残留轻度腰腿痛,在并发症方面两组患者无明显区别。两组患者术前及术后生理曲度及水平位移程度无明显统计学意义,患者腰椎稳定性无明显影响。脊柱内镜组在术中出血量、切口长度、住院及康复时间明显较微创通道组缩短。尽管全脊柱内镜在手术治疗过程中指标明显优于微创通道,但全脊柱内镜普遍手术时间及学习曲线均长。
全脊柱内镜及微创通道辅助下行椎间盘摘除及神经根松解对于腰椎间盘脱出患者均能获得良好的治疗结果,但应用脊柱内镜比微创通道腰椎功能恢复快,住院时间短,组织创伤小。尽管随访中所有病例未出现腰椎失稳及终板炎等并发症,但本研究中随访时间较短,尚无法确定长时间继续随访后的最后结果。
参考文献:
[1]Li ZZ,Hou SX,Shang WL,et al.The strategy and early clinical outcome of full-endoscopic L5S1discectomy through interlaminar approach[J].Clin Neurol Neurosurg,2015,133(12):40-45.
[2]Shearwood Mcclelland I,Goldstein JA.Minimally invasive versus open spine surgery:what does the best evidence tell us?[J].J Neurosci Rural Pract,2017,8(2):194-198.
[3]Wang Y,Sun H,Qin S.Clinical efficacy of lumbar interbody fusion using a channel system combined with ozone therapy for the treatment of central-type L3~4lumbar disc herniation[J].Exp Ther Med,2017,13(2):619-623.
[4]Lee S,Kim SK,Lee SH,et al.Percutaneous endoscopic lumbar discectomy for migrated disc herniation:classification of disc migration and surgical approaches[J].Eur Spine J,2007,16(3):431-437.
[5]王子平,陆耀刚,王秀会,等.腰椎间盘切除术后腰椎稳定性影响的临床研究——204例中、长期随访分析[J].中国骨与关节损伤杂志,2008,23(4):280-282.
[6]魏文智,李全义,王秋莲.腰椎后路镜下微创手术对腰椎间盘突出症患者疼痛及腰椎稳定性的影响[J].河北医药,2017,39(21):3221-3225.
[7]Dasenbrock HH,Juraschek SP,Schultz LR,et al.The efficacy of minimally invasive discectomy compared with open discectomy:a meta-analysis of prospective randomized controlled trials[J].J Neurosurg Spine,2012,16(5):452-462.
[8]Kulkarni AG,Bohra H,Dhruv A,et al.Minimal invasive transforaminal lumbar interbody fusion versus open transforaminal lumbar interbody fusion[J].Indian J Orthop,2016,50(5):464-472.
[9]Yue JJ,Long W.Full Endoscopic Spinal Surgery Techniques:Advancements,Indications,and Outcomes[J].Int J Spine Surg,2015,17 (9):141-152.
[10]Chen HT,Tsai CH,Chao SC,et al.Endoscopic discectomy of L5S1disc herniation via an interlaminar approach:Prospective controlled study under local and general anesthesia[J].Surg Neurol Int,2011,2(1):93.

