雏鸭肝炎的诊断与防治
(仪征市真州兽医站,江苏 仪征 211400)
0 引言
2016年9月仪征地区,雏鸭肝炎的发病率较高,通过在仪征市真州兽医站采集的3例疑似雏鸭肝炎病例死亡的雏鸭肝脏,经过研磨,匀浆,离心等操作以后提取其上清液,通过琼脂扩散实验(AGP)48 h以后对实验结果进行观查,最后实验结果均为阳性,证实了所取的3例病料均为雏鸭肝炎。通过合理的防治措施很好的控制了该病的发生和雏鸭的死亡,保护养殖户的经济效益。
1 材料与方法
1.1 材料
通过真州兽医站门诊部,采集了3份鸭肝炎的病料,现将整理如下。
1.1.1 第一例病料
临床症状:雏鸭采食下降,行动呆滞,有些病鸭出现神经症状,头向后仰,并快速死亡。
免疫和饲养情况:雏鸭购入以后未进行任何免疫,日常饮水中加入了氟派酸。饲料为某饲料厂全家料。
剖检变化:肝脏明显肿大,出血呈暗红色,表面有大小不等的出血点,胆囊肿大,胆汁呈茶色。脾脏稍肿大。
1.1.2 第二例病料
临床症状:雏鸭现采食下降,行动呆滞,眼半闭,雏鸭拉稀粪,呈水样。有些病鸭出现头向后仰,死亡以后呈角弓反张。
免疫饲养情况:在购买时没有具体向孵化厂询问的免疫情况,日常饲养中也未用任何的药物。所用饲料是自家用玉米和大豆等几样农作物进行配置的。
剖检变化:肝脏明显肿大,质脆,表面有大小不等的出血点,胆囊肿大,胆汁呈褐色。脾脏稍肿大,肠道股气,内有大量的黏性分泌物。
1.1.3 第三例病料
临床症状:雏鸭于25日下午开始出现采食下降,有10几只鸭出现瘫痪,地上垫草上出现大量的白色的粪便,当晚有一些鸭开始出现神经症状,并很快的死亡,死后呈明显的神经症状。到25日上午来就证前已经死亡了99只。
免疫和饲养情况:雏鸭购买前已经进行了鸭瘟和鸭霍乱二联苗免疫,用的是扬州一饲料厂的饲料。
剖检变化:肝脏肿大,质地很脆,严重的出血。胆囊肿大,胆汁呈深褐色。脾脏肿大。肾脏表面有白色的尿酸盐沉积,肠道内有大量的黏液,并伴有鼓气。
实验材料的收集:在解剖时,分别收集每例病鸭的肝脏,存放于-70℃的冰箱中。
1.2 方法
1.2.1 抗原的制备
(1)材料:玻璃研磨、移液枪和枪头、天平、高速离心机、高压灭菌锅、超声裂解器、指形管、记号笔、恒温箱、载玻片、移液管。
(2)试剂:生理盐水、阴性血清、阳性血清、琼脂粉、蒸馏水、氯化钠、PH试纸、NaOH、0.1mol/L的稀盐酸。
1.2.2 步骤
(1)将第一例病料去除以后称重,放在研磨中加入灭菌沙,进行充分的研磨,入等量的PBS液(pH为7.0)制成匀浆,匀浆制好以后在在用CRX型—2型的超色化器,进行超声裂解(频率2 000 Hz;20~30 W)12 s左右,裂解好以后在高速离心机上进行高速离心12 000转/min,离心20 min,取其上清液。
(2)抗原的稀释:把抗原进行2倍4倍8倍的稀释方法如下。
取3支指形管编号为1 2 3 ,1~3号指形管中各加0.5 mL的无菌生理盐水,在第1 管中加入0.5 mL的抗原,混匀后,用移液枪,吸取0.5 mL放到第2管中。将第2管中的生理盐水和抗原混匀,用移液枪,吸求0.5 mL放到第3管中。将第3管中的生理盐水和抗原混匀,丢弃0.5 mL。通过倍比稀释以后第1管中的抗原稀释倍数为2倍稀释,2号管中的稀释倍数为4倍稀释,3号管中的稀释倍数为8倍稀释。
(3)阴性血清和阳性血清微生物实验室提供。
1.2.3 琼脂平板的制备
(1)称取琼脂粉1 g NaCl 8g 放到烧杯中进行溶解。等到琼脂粉和NaCl完全溶解时,对溶液进行pH值的调节使琼脂液的pH在7左右(要求在6~8)
(2)将调节好pH值的琼脂液倒入250 mL干净生理盐水瓶中,将生理盐水瓶的瓶口用纱布包扎好,放入高压灭菌锅中进行高压灭菌,灭菌条件要求在121C这个温度维持在20℃左右。
1.2.4 浇板和打孔
(1)琼脂液灭菌好以后,待温度降到55℃左右的时候,开始进行浇板。取1块干净透明的载玻片,将琼脂液用移液管吸取进行浇板,浇板的厚度为2~3 mm。浇好板以后让琼脂液在载玻片上自然冷却凝固。
(2)待琼脂液在在载玻片上自然冷却凝固以后,在琼脂平板上打梅花孔,要求没孔的直径要求在2 mm左右,孔与孔之间的距离为3 mm左右。
(3)补底,在打好孔的琼脂平板在酒精灯的火焰上方来回的走动,使琼脂平板的底补琼脂融化,防止孔与孔底部之间相互连通。
1.2.5 加样(如图1)
中间孔加入阳性血清;第1孔加入抗原的原液;第2孔加入二倍稀释的抗原;第3孔加入四倍稀释的抗原;第4孔加入八倍稀释的抗原;第5孔加入阴性血清;第6孔加入无菌生理盐水。
1.2.6 培养观察
取一大培养皿,将底部放1块潮湿的纱布,然后将加好样的平板放在纱布上,将培养皿盖好放入恒温箱中,恒温箱的温度为37℃。在24 h和48 h进行观察,如果血清孔和抗原孔之间无任何反应,为阴性反应。如果血清孔和抗原孔之间有明显的沉淀线,为阳性反应。
2 实验结果
在48 h之后对结果进行观察发现,结果见表1、表2、表3。通过实验结果的观察,发现这3个病例多出现了阳性的白色沉淀线。那么就可以通过以上的临床症状和病理变化以及实验结果就可以确定这3个病例为雏鸭肝炎。
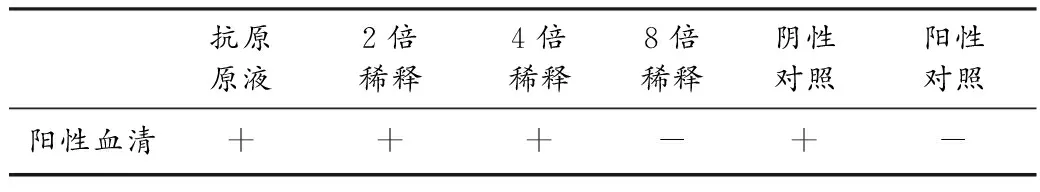
表1 第一病例结果

表2 第二病例结果

表3 第三病例结果
3 治疗
对病鸭采取严格的隔离饲养,加强饲养管理,严格进行环境的消毒,给雏鸭群肌注0.5 mL/只高免血清或康复鸭的血清,减少雏鸭的死亡。在饲料中添加5%甲砜霉素防治继发感染。在饮水添加电解多维增强抵抗力。同时使用中草药治疗,用复方禽瘟灵片(主要成分是穿心莲、板兰根、黄芩等)雏鸭0.5片/次, 2次/d连用3~5 d。
4 预防措施
雏鸭肝炎是一种传播迅速、死亡较高的病毒性传染病,如果在日常饲养中如果不能很好的预防和控制本病,将会给养殖户带来较大的经济损失。
(1)规模化养鸭,鸭龄在4周龄以内,且未发病的鸭群,雏鸭要进行病毒肝炎疫苗紧急接种。
(2)在有病毒性肝炎流行史地区,可以通过种鸭开产前2~4周进行全群免疫接种。对于严重污染地区要重复免疫1次。以使苗鸭获得高水平抗体。
(3)在病毒性肝炎流行地区,如种鸭未经病毒性肝炎弱毒苗接种,不能单纯用病毒性肝炎血清或卵黄液来代替免疫。
(3)初诊为病毒性肝炎后,每只雏鸭紧急肌肉注射高免血清1 mL。对存栏雏鸭进行圈养,及时隔离病弱雏鸭。在未发病的鸭饲料中加入磺胺嘧啶钠,在病鸭的饮水中加入恩诺沙星和口服补液盐,同时在所有雏鸭的饮水中加入水溶性多维素。
(4)养鸭场实行封闭式生产,本着“防重于治”的原则,做好隔离消毒工作。发病地区要加强消毒工作,场地用3%~5%热氢氧化钠喷洒消毒,1~2次/d,所用器皿用0.1%-0.2%高锰酸钾清洗消毒。用3%的过氧乙酸进行室内带鸭消毒,病死鸭深埋。
(5)进雏鸭时,要从正规无病史种鸭场引种,对1日龄雏鸭接种鸭肝炎弱毒疫苗,做好商品雏鸭的预防免疫接种工作。
Y.M.塞弗,苏敬良.禽病学(第十一版)[M].高福,译.北京:农业出版社,1999:276-382.
[2] B.W卡尔尼克.禽病学(第九版)[M].高福,刘文军,译.北京:中国农业大学出版社,1991:455-471.

