抗冻蛋白对预发酵冷冻面团中蛋白质特性及水分状态的影响
姬成宇,石媛媛,李梦琴,2,*,张 剑,2,安艳霞,2,艾羽函
(1.河南农业大学食品科学技术学院,河南 郑州 450002;2.农业部大宗粮食加工重点实验室,河南 郑州 450002)
随着面制品行业的快速发展,冷冻技术被越来越多的应用到面团生产中,冷冻面团技术得到迅速发展[1]。但研究发现,冷冻面团馒头在冻藏后达不到新鲜馒头的品质[2],随着冻藏时间的延长,冷冻面团表面变得粗糙,成品质量下降[3]。赵雷[4]发现当面筋蛋白冻藏时间超过90 d后,面筋网络结构几乎不存在。王沛[5]研究发现冻藏降低了面筋蛋白与水的结合作用,随着冻藏时间的延长,面筋蛋白发生解聚,从而使得面筋网络结构退化。针对这种问题,刘国琴等[6]运用圆二色谱研究冻藏对面筋蛋白二级结构的影响,发现冻藏90 d后面筋蛋白二级结构变化最显著。Ribotta等[7]运用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)技术发现冻藏使得冷冻面团中面筋蛋白的高分子质量谷蛋白条带强度减弱,认为可能是谷蛋白由于冰晶的重结晶而发生了解聚行为。
冻藏期间温度的波动会引起重结晶,破坏面筋蛋白结构,使冷冻面团品质下降[8-9]。冷冻面团在冻藏过程中,随着冻藏时间的延长,冷冻面团表面水分发生干耗,内部水分缓慢移动到表面,造成面团中水分的丧失[10],随着时间的延长,水分减少使得表面产生裂纹,影响冷冻面团品质及外观。温度波动时,冷冻面团中冰晶不断出现融化重组,发生重结晶,而重结晶产生的冰晶通常较大,会破坏面筋网络结构,从而影响冷冻面团及成品品质[11-12]。因此,如何改善冷冻面团的品质实现传统面制品的工业化急需研究。
目前,食品界改善冷冻面团的品质和延长货架期主要依靠添加剂,抗冻蛋白(antifreeze proteins,AFPs)是我国于2006年批准可用于冷冻食品的新型添加剂[13]。国内对于AFPs的研究虽然已有不少,但大多集中在面包生产中,将其应用于传统中式蒸煮冷冻面制品的研究相对较少。杜浩冉等[14-15]利用响应面法分别优化了冷冻面团馒头的工艺配方和混合发酵剂制作冷冻面团馒头的复配添加剂配方。Daniel等[16]将AFPs添加到冷冻甜食中,结果表明冷冻甜品的品质得到显著改善。Payne等[17]研究发现将牛肉浸泡在APFs溶液中,在-20 ℃冻结之后,冰晶体积明显缩小。Zhang Chao等[18]研究了AFPs对冷冻面团质地特性的影响,结果发现,添加AFPs可维持面包体积和改善面团的柔软性,降低硬度,这主要是因为结冰水含量的降低。
本研究旨在探讨冻藏和冻融循环条件下AFPs对冷冻面团蛋白质特性、水分状态等的影响,揭示AFPs在冷冻面团冻藏和温度波动条件下稳定冷冻面团品质的作用效果和内在机理。为AFPs提高传统中式蒸煮冷冻面团产品质量提供一定理论依据。
1 材料与方法
1.1 材料与试剂
高筋小麦粉 郑州金苑面粉厂;高活性干酵母安琪酵母股份有限公司;AFPs 郑州奇华顿化工产品有限公司。
1.2 仪器与设备
B5A型多功能搅拌机 广州威万事实业有限公司;FX-15S面包发酵箱 广州市赛思达机械设备有限公司;HDGDJ-150高低温交变试验箱 上海衡鼎仪器设备厂;LGJ-10D冷冻干燥机 北京四环科学仪器厂有限公司;UV-2000紫外-可见分光光度计、凝胶成像系统 尤尼柯(上海)仪器有限公司;DYY-5型稳压稳流电泳仪 北京六一仪器厂;Spectrum GX傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 美国Perkin Elmer公司;PQ001 MicroMR柜式核磁共振(nuclear magnetic resonance,NMR)成像仪上海纽迈电子科技有限公司。
1.3 方法
1.3.1 冷冻面团及冷冻面团馒头的制备
将100 g面粉与0.5 g AFPs混合均匀(不含AFPs的为空白面团);将混合的面粉倒入和面机,加入1 g预活化的酵母、50 g水进行和面至无生粉夹杂。取出静置10 min,将静置好的面团用压面机压面5 次(5 mm),然后分割成30 g的面团,整形后放入温度35 ℃、相对湿度85%的醒发箱中发酵20 min。待面团温度下降后放入-40 ℃低温试验箱中速冻30 min,取出放入-18 ℃冰箱中冻藏。
制备冷冻面团馒头时,将冷冻面团置于温度35 ℃、相对湿度85%的醒发箱中解冻发酵30 min。
1.3.2 冷冻面团冻藏冻融的处理
将制备好的冷冻面团于-18 ℃条件下分别冻藏1、7、15、30、60、90 d,取出处理,得到不同冻藏时间的样品,待测。
冻融循环处理参照叶晓枫等[19]的方法略作修改,将冻藏3 d的冷冻面团取出,在35 ℃恒温箱中解冻30 min,取出部分面团进行处理,记作第0次冻融循环;其余面团放入-18 ℃冰箱中冻藏1 d后取出,按上次解冻条件解冻,取出部分面团进行处理,记作第1次冻融循环;其余部分按上述方法分别进行第2、3、4、5次冻融循环。
样品经冻藏冻融处理后,取出部分进行冷冻干燥,粉碎,过120 目筛,装入自封袋中备用。
1.3.3 冷冻面团游离巯基和二硫键含量的测定
称取75 mg粉碎过筛的冷冻面团样品,采用Ellman’s试剂比色法测定冷冻面团二硫键及游离巯基的含量[20]。
1.3.4 冷冻面团的SDS-PAGE测定
参考王晶[21]的方法进行单向SDS-PAGE分析冷冻面团中高分子质量谷蛋白亚基(high molecular weight-glutenin subunits,HMW-GS)和低分子质量麦谷蛋白亚基(low molecular weight-glutenin subunits,LMW-GS)的组成。
1.3.5 冷冻面团蛋白质二级结构的FTIR测定
称取一定量的样品,与溴化钾质量比为1∶100在玛瑙研钵中研磨并混合均匀,压制成薄片,用FTIR仪对样品做全波段(400~4 000 cm-1)扫描测定,扫描次数为32,分辨率为4 cm-1。之后使用OMNIC 8.0数据处理软自动校正水汽,运用Peakf i t 4.12软件截取1 600~1 700 cm-1波段,并进行基线校正,高斯去卷积,二阶导数拟合,使残差大于0.96,指认蛋白质二级结构特征峰并计算各结构含量。
1.3.6 冷冻面团失水率的测定
将速冻好的冷冻面团馒头每组取出3 个,用保鲜膜包好,置于-18 ℃冰箱中冻藏,经冻藏冻融处理后按下式计算面团失水率:

式中:m1为样品冻藏前面团质量/g;m2为样品冻藏后面团质量/g。
1.3.7 冷冻面团NMR弛豫时间的测定
利用FID试验调节共振中心频率,利用CPMG脉冲序列测量样品的自旋-自旋弛豫时间(T2)。称取面团(1.00±0.01)g放入试管中,置于永久磁场中心位置射频线圈的中心,进行CPMG脉冲序列的扫描实验。CPMG实验参数:采样点数104 902,重复扫描次数8,重复时间2 000 ms,半回波时间210 μs。利用T2反演拟合软件对CPMG弛豫衰减曲线进行反演得到弛豫图谱和T2值。
1.4 数据处理
采用SPSS 13.0对实验数据进行均值的多重比较(Duncan法),简单的分析和作图用Origin 8.0软件。
2 结果与分析
2.1 冻藏期AFPs对冷冻面团游离巯基和二硫键含量的影响
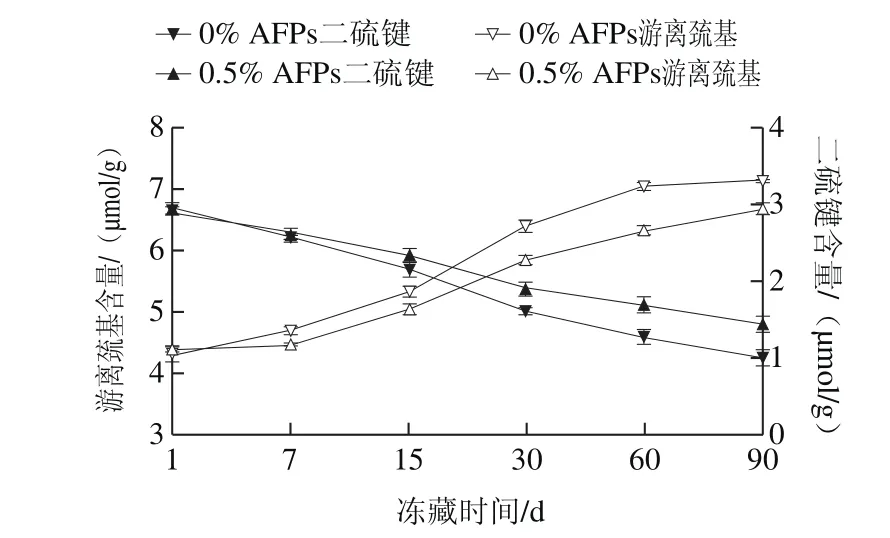
图1 冻藏条件下AFPs对冷冻面团游离巯基和二硫键含量的影响Fig.1 Effect of AFPs on the contents of –SH and –S–S– of frozen dough during frozen storage
由图1可见,随着冻藏时间的延长,预发酵冷冻面团中游离巯基含量均上升,二硫键含量逐渐减少。由此可见,冷冻面团中的二硫键随着冻藏时间的延长发生断裂,与Zhao Lei等[22]研究结论一致。相比较于空白面团,添加了AFPs冷冻面团的二硫键和巯基含量变化幅度较小,说明AFPs可以在冻藏过程中减少面团中二硫键的断裂,能较好地保护面筋蛋白的功能特性。
2.2 冻融循环条件下AFPs对冷冻面团游离巯基和二硫键含量的影响

图2 冻融循环条件下AFPs对冷冻面团游离巯基和二硫键含量变化Fig.2 Effect of AFPs on the contents of –SH and –S–S– of frozen dough during freeze-thaw treatment
由图2可见,随着冻融循环次数的增加,冷冻面团中游离巯基含量上升,在冻融循环5 次后,添加AFPs冷冻面团游离巯基含量比空白面团有所降低;相反地,冷冻面团中二硫键含量降低,在冻融循环5 次后,比空白面团二硫键含量有所增多,说明AFPs的加入降低了预发酵冷冻面团中二硫键的断裂。
比较图1和2可知,冻融循环过程中预发酵冷冻面团中游离巯基和二硫键变化趋势与冻藏过程相同,但变化幅度均高于冻藏过程,说明冻融处理对冷冻面团中二硫键的破坏更明显。这可能是因为冻融循环使冷冻面团中冰晶反复重结晶加剧了对面团面筋结构的破坏。而AFPs对于冰晶的修饰作用和重结晶的抑制作用可以有效地抑制冻融过程中面筋结构的破坏程度[23],减少二硫键的断裂。
2.3 AFPs对冷冻面团SDS-PAGE的影响
由图3、4可知,冻藏和冻融循环处理下,100 kDa上下有3 条清晰的条带,表示这部分的亚基分子质量最大,迁移率最慢,颜色较浅,属于HWM-GS;30~70 kDa之间的图谱颜色较深,含量较高,在凝胶上迁移速率较快,分子质量较小,属于LMW-GS和醇溶蛋白。观察冻藏和冻融循环SDS-PAGE图发现条带数目、相对迁移率等均无明显的变化,这说明冻藏和冻融循环对于冷冻面团蛋白质的亚基无明显影响,且添加AFPs对冷冻面团亚基无影响。
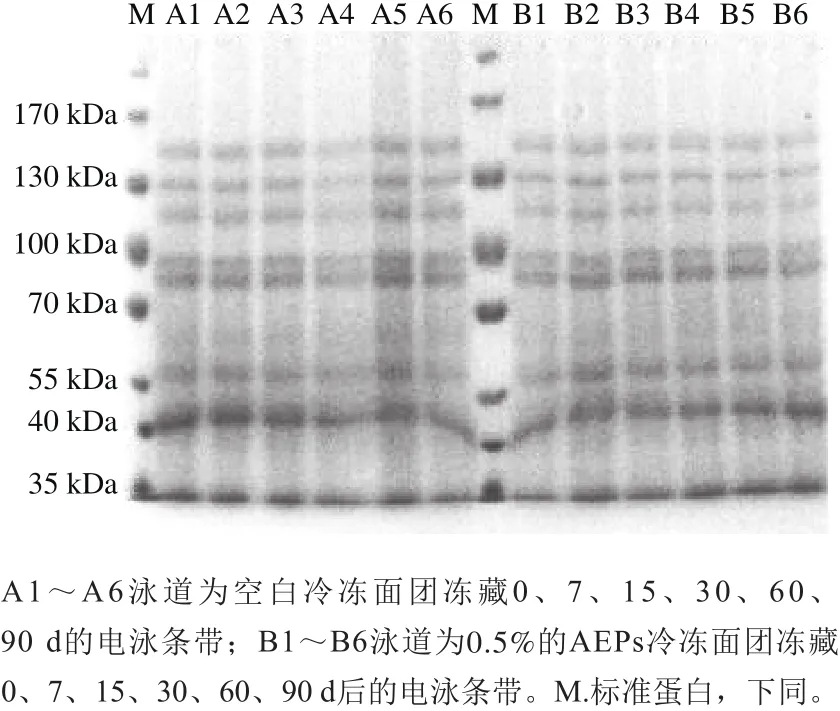
图3 冻藏条件下冷冻面团SDS-PAGE图Fig.3 SDS-PAGE prof i les of frozen dough during frozen storage
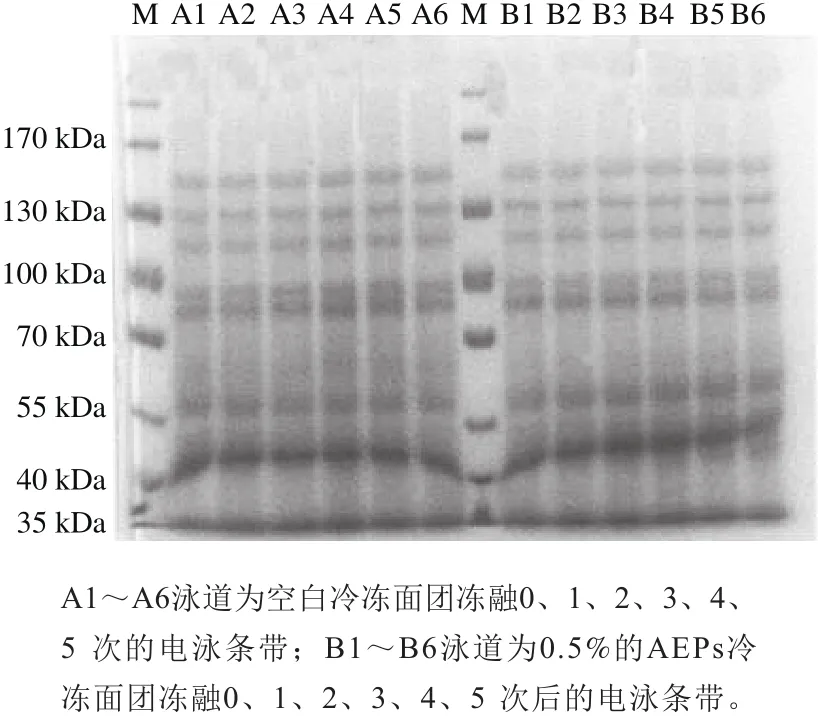
图4 冻融循环条件下冷冻面团SDS-PAGE图Fig.4 SDS-PAGE prof i les of frozen dough during freeze-thaw treatment
2.4 冻藏条件下AFPs对冷冻面团蛋白质二级结构的影响
FTIR酰胺I带各个波峰二级结构指认参照冯蕾等[24]方法。冻藏期间AFPs对冷冻面团蛋白质二级结构的影响见图5。
将2 种冷冻面团的FTIR图运用Peakf i t软件进行基线校正,高斯去卷积后进行蛋白质二级结构表征峰的拟合,蛋白质二级结构指认的特征峰的峰面积发生变化,对应二级结构的含量也随着变化。由图5可知,经过90 d冻藏后,1 617 cm-1处的分子间β-折叠的含量随冻藏时间的延长呈上升趋势,1 669 cm-1处的β-转角含量呈下降趋势,而反向平行β-折叠、α-螺旋、无规则卷曲和1 683 cm-1处的β-折叠这4 种二级结构的含量在冻藏过程中有小幅度波动,但变化不明显。说明冻藏会影响面团蛋白质的分子间β-折叠和β-转角的含量,而随着β-转角的减少,分子间β-折叠增加,可能是β-转角在冻藏过程中转化为了β-折叠,与赵雷[4]研究结果一致。从图5还可看出,添加AFPs面团中的蛋白质二级结构变化较空白面团低,表明AFPs的加入能够保护面团中蛋白质分子间的氢键作用,且保护β-转角不受冰晶的破坏。
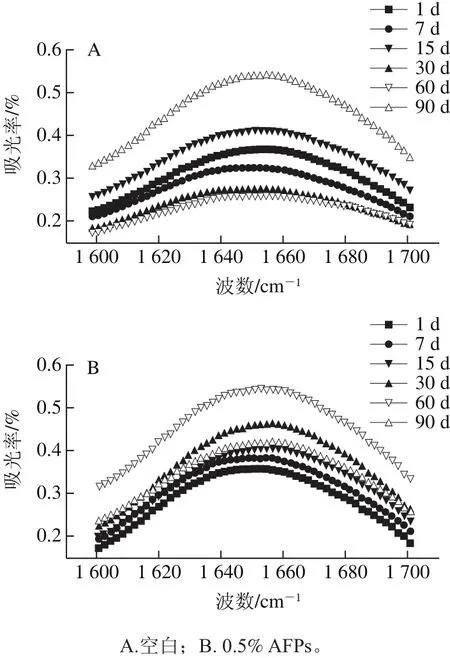
图5 冻藏条件下冷冻面团FTIR图Fig.5 FTIR spectra of frozen dough during frozen storage
2.5 冻融循环条件下AFPs对冷冻面团蛋白质二级结构的影响
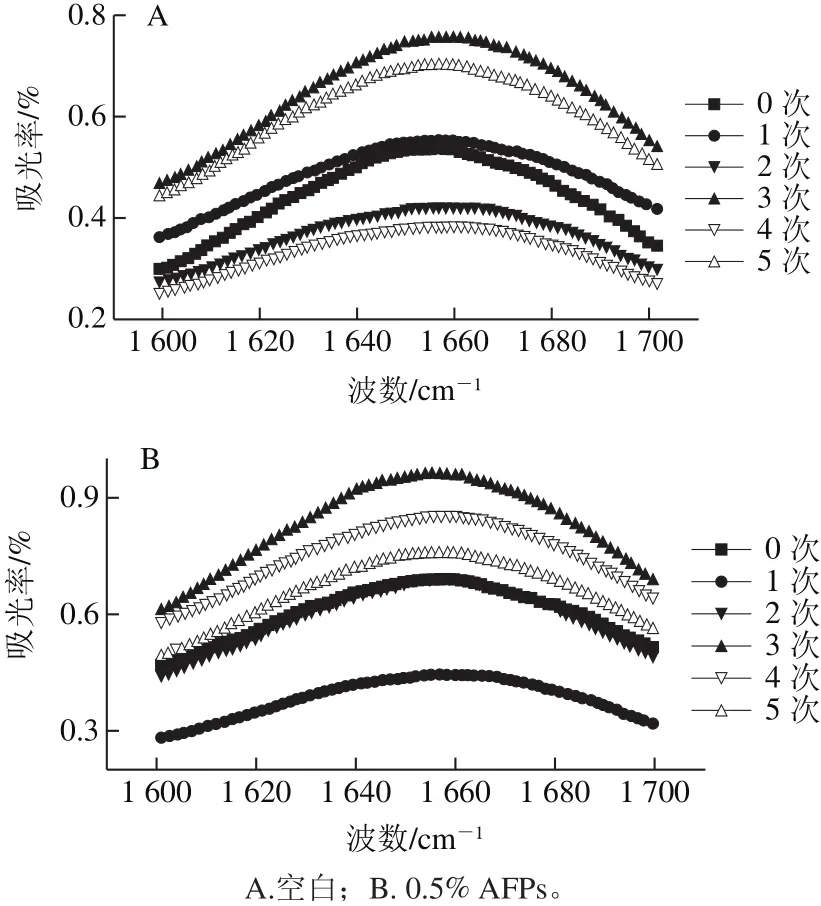
图6 冻融循环条件下冷冻面团FTIR图Fig.6 FTIR spectra of frozen dough during freeze-thaw treatment
由图6可知,冻融循环过程中2 种面团的β-折叠含量均呈上升趋势,β-转角含量呈下降趋势,这与冷冻面团在冻藏条件下二级结构变化趋势一样,但冻融循环条件下2 种二级结构的变化幅度明显大于冻藏过程,AFPs冷冻面团β-折叠降低幅度较空白组小。与冻藏过程不同的是,冻融循环过程中α-螺旋含量呈下降趋势。冻融过程由于温度的不断波动及外界压力的变化,导致水分迁移及重结晶,大冰晶数量增多,对蛋白质中的氢键起到破坏作用,使得蛋白质的亲水和疏水残基暴露出来,蛋白质分子间和分子内出现新的分子交联,从而改变了蛋白质的二级结构。李学红等[25]研究有同样的结论。而AFPs的加入能够增大面筋蛋白的分子内氢键作用,同时通过促使被破坏的分子间氢键的再次形成使面筋蛋白二级结构保持稳定状态。
2.6 冻藏期间AFPs对冷冻面团失水率的影响
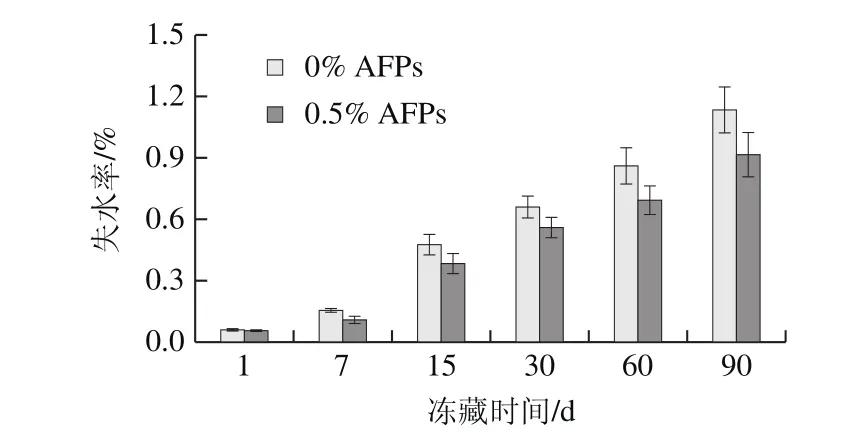
图7 冻藏条件下AFPs对冷冻面团失水率的影响Fig.7 Effect of AFPs on water loss of frozen dough during frozen storage
由图7可知,预发酵冷冻面团随着冻藏时间的延长失水率显著提高,冻藏15 d后,空白组失水率显著增加。这是因为冷冻面团在冻藏时,冻藏室与面团之间的蒸汽压差,以及冷冻面团表面水分不断以冰晶升华方式减少,使得冷冻面团内部水分不断向外迁移[26],冷冻面团中的水分持续减少。对比可知,AFPs冷冻面团失水率升高趋势明显缓于空白组,说明在冻藏过程中,AFPs可以提高面团的持水力,有效地减少冷冻面团水分的减少,说明AFPs在一定程度上可以减少面团中可冻结水的含量,从而抑制水分的散失[27]。
2.7 冻融循环条件下AFPs对冷冻面团失水率的影响
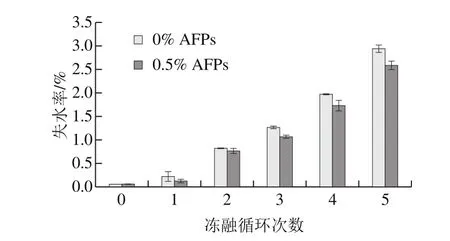
图8 冻融循环条件下AFPs对冷冻面团失水率的影响Fig.8 Effect of AFPs on water loss of frozen dough during freeze-thaw treatment
由图8可知,随着冻融循环次数的增加,预发酵冷冻面团的失水率显著提高。这是因为在冻融循过程中,加速了面团中水分的迁移及重结晶,使得冰晶逐渐增大[28-29],大冰晶进一步破坏了面团的面筋网络结构,降低面团持水能力。多次冻融处理后,AFPs冷冻面团失水率均低于空白组,说明AFPs的加入能够减缓冻融循环中冷冻面团水分的流失,可能是由于AFPs能够抑制面团中冰晶的重结晶现象,降低大冰晶的产生,维持面团的持水能力,从而降低面团水分流失的速率。
2.8 冻藏条件下AFPs对冷冻面团水分分布状态的影响
采用NMR技术测定冷冻面团中水分分布状态,运用CPMG序列测定冻藏条件下AFPs对冷冻面团体系中自旋-自旋弛豫时间T2变化影响。由表1可知,在弛豫图谱上有2 个拟合峰,其中第1个峰T21在1~3 ms之间,表征的是与蛋白质、淀粉等大分子物质紧密结合的水分,这部分水的流动性最弱,称为结合水;第2个峰T22在8~13 ms之间,这部分通常被认为是直接与强结合水以氢键结合、间接与大分子结合的弱结水层,相比T21流动性更大,为半结合水[30],说明面团中水分主要以结合水和半结合水状态存在,A21、A22表示对应类型氢质子密度,质子密度越大,说明该类型水分含量越高。但在冷冻面团冻藏30 d后,图谱中的峰1和峰2部分重叠,说明在此横向弛豫时间区间内,冷冻面团中的1H的运动呈连续地变化[31]。
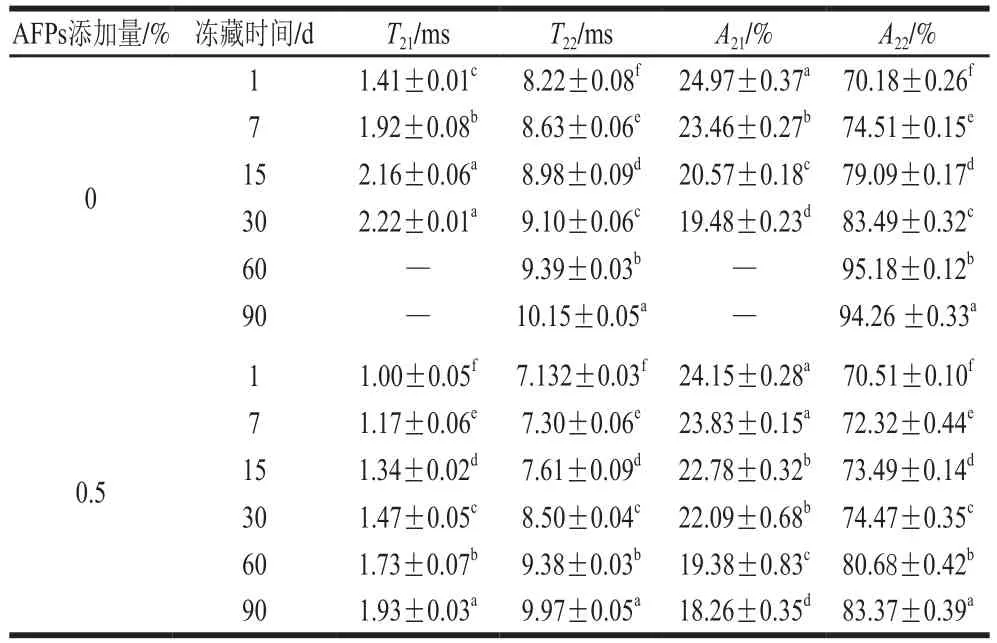
表1 冻藏条件下AFPs对冷冻面团弛豫时间T2变化Table1 Effect of AFPs on the changes in T2 of frozen dough during frozen storage
由表1可知,冷冻面团T2值随着冻藏时间的延长逐渐增大,水分流动性增强,说明冻藏过程加速了冷冻面团中水分的移动。在冻藏30 d后,横向弛豫时间明显增大(P<0.05),其中结合水含量下降,半结合水含量升高,冻藏60 d后,结合水与半结合水峰几乎重合,半结合水含量明显增加。这是由于冻藏过程中产生的冰晶破坏面团面筋网络结构,造成面团持水能力降低,水分流动性增强。AFPs冷冻面团与空白组变化趋势相同,与空白组相比,添加AFPs的豫驰时间T2值有所下降,冻藏60 d后还能检测到结合水峰,说明AFPs可以有效抑制面团中水分的迁移,提高冷冻面团在冻藏期间的稳定性。
2.9 冻融循环条件下AFPs对冷冻面团水分分布状态的影响
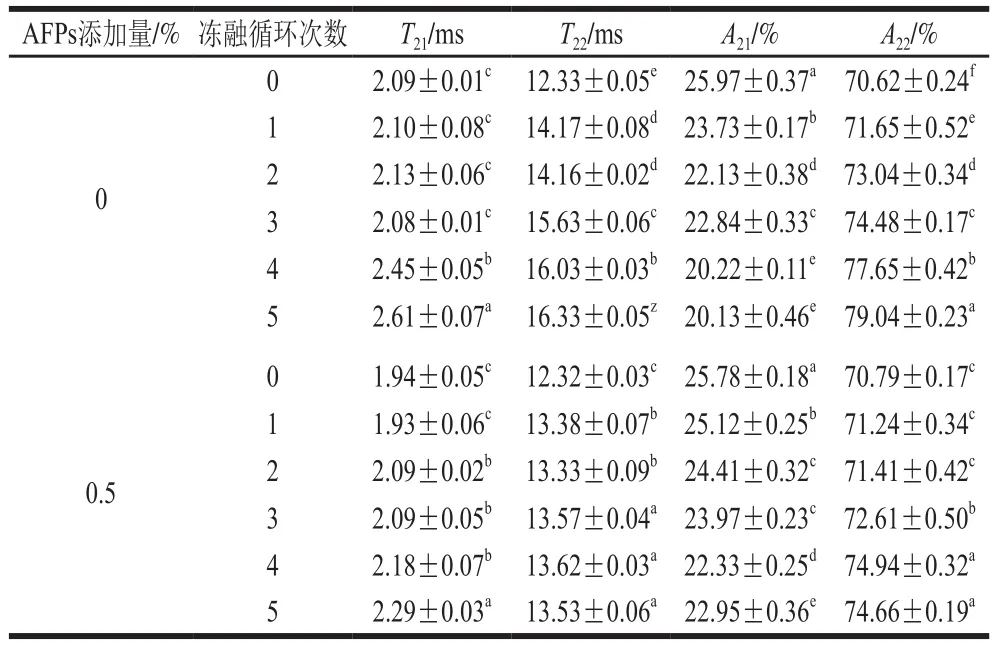
表2 冻融循环条件下AFPs对冷冻面团弛豫时间T2变化Table2 Effect of AFPs on the changes in T2 of frozen dough during freeze-thaw treatment
由表2可知,冻融循环3 次后,两组冷冻面团T21和T22的峰位置基本没有发生变化,冻融循环4 次后,空白组T22值明显增大,面团中水分流动性显著提高,添加AFPs后,T22值基本不变,表明AFPs能够减弱冻融循环对冷冻面团水分流动性的影响。
此外,随着冻融循环次数的增加,冷冻面团中结合水含量逐渐减少,半结合水含量显著增加(P<0.05),表明冻融循环过程中面团中结合水含量下降、半结合水含量上升,半结合水在表面不断生长和重结晶,大冰晶的增多及对面团产生的机械力导致面团持水力下降,水分散失。而与空白组相比,添加AFPs后,面团结合水和半结合水含量变化较空白组小,这说明AFPs可以降低冻融循环过程中面团水分的流动性,减少水分的迁移。
3 结 论
经冻藏和冻融循环后,冷冻面团中游离巯基含量上升,二硫键含量下降。随着冻藏时间的延长,二级结构中分子间β-折叠含量增大,β-转角含量减小,冻融循环还会使得α-螺旋结构含量下降,添加AFPs组的冷冻面团蛋白质特性变化均小于无添加组,因此,在冻藏和冻融循环过程中,AFPs能够抑制二硫键的断裂和二级结构的变化;SDS-PAGE图谱显示,冻藏和冻融循环对于冷冻面团蛋白质的亚基无明显影响,且添加AFPs对冷冻面团亚基无影响。
经冻藏和冻融循环后,冷冻面团的失水率明显升高,驰豫时间T21和T22值变大,结合水含量减少,半结合水增多,表明冻藏和冻融过程增强了面团水分的流动性,导致面团持水性降低,体系中的水分子从结合态向半结合态转变。添加AFPs后冷冻面团失水现象有所改善,冻藏期T21和T22值有所减小,冻融循环下T21和T22值基本不变,结合水含量上升,降低了冻融过程中面团水分的流动性,有效地提高了面团的持水能力,AFPs能够改善冻藏和冻融过程中冷冻面团馒头的品质。
[1] WANG P, XU L, NIKOO M, et al. Effect of frozen storage on the conformational, thermal and microscopic properties of gluten: comparative studies on gluten-, glutenin- and gliadin-rich fractions[J]. Food Hydrocolloids, 2014, 35: 238-246. DOI:10.1016/j.foodhyd.2013.05.015.
[2] 王文果. 冷冻面团的研究与发展[J]. 食品与发酵科技, 2006, 42(3):55-55. DOI:10.3969/j.issn.1674-506X.2006.03.005.
[3] 李书国, 陈辉, 李雪梅, 等. 复合添加剂改善面包冷冻面团质量的试验研究[J]. 中国粮油学报, 2003, 18(3): 24-27. DOI:10.3321/j.issn:1003-0174.2003.03.008.
[4] 赵雷. 冻藏对面筋蛋白分子量、链结构及聚集态影响的研究[D].广州: 华南理工大学, 2012: 104-106.
[5] 王沛. 冷冻面团中小麦面筋蛋白品质劣变机理及改良研究[D].无锡: 江南大学, 2016: 20-22.
[6] 刘国琴, 阎乃珺, 赵雷, 等. 冻藏对面筋蛋白二级结构的影响[J]. 华南理工大学学报(自然科学版), 2012, 40(5): 115-120. DOI:10.3969/j.issn.1000-565X.2012.05.020.
[7] RIBOTTA P D, LEÓN A E, AŇÓN M C. Effect of freezing and frozen storage of doughs on bread quality[J]. Journal of Agricultural &Food Chemistry, 2001, 49(2): 913-918. DOI:10.1021/jf000905w.
[8] DEEPN Y, PRAKASHE P, MOHAMMADA K, et al. Effect of freeze-thaw cycles and additives on rheological and sensory properties of ready to bake frozen chapaties[J]. International Journal of Food Science & Technology, 2008, 43(9): 1714-1720. DOI:10.1111/j.1365-2621.2008.01763.x.
[9] NAITO S, FUKAMI S, MIZOKAMI Y, et al. Effect of freeze-thaw cycles on the gluten fibrils and crumb grain structures of breads made from frozen doughs[J]. Cereal Chemistry, 2004, 81(1): 80-86.DOI:10.1094/CCHEM.2004.81.1.80.
[10] CHEN G, ÖHGREN C, LANGTON M, et al. Impact of long-term frozen storage on the dynamics of water and ice in wheat bread[J].Journal of Cereal Science, 2013, 57(1): 120-124. DOI:10.1016/j.jcs.2012.10.009.
[11] RONDA F, QUILEZ J, PANDO V, et al. Fermentation time and fi ber effects on recrystallization of starch components and staling of bread from frozen part-baked bread[J]. Journal of Food Engineering, 2014,131(2): 116-123. DOI:10.1016/j.jfoodeng.2014.01.023.
[12] PHIMOLSIRIPOL Y, SIRIOATRAWAN U, CLELAND D J.Weight loss of frozen bread dough under isothermal and fl uctuating temperature storage conditions[J]. Journal of Food Engineering, 2011,106(2): 134-143. DOI:10.1016/j.jfoodeng.2011.04.020.
[13] 黄卫宁. 冰结构蛋白: GB2760新成员[N]. 中国食品报, 2006-08-22(6).
[14] 杜浩冉, 郑学玲, 韩小贤, 等. 响应面法优化混合发酵制作冷冻面团馒头的复合食品添加剂配方[J]. 食品科学, 2015, 36(12): 36-43.DOI:10.7506/spkx1002-6630-201512007.
[15] 杜浩冉, 郑学玲, 韩小贤, 等. 响应面法优化酵母冷冻面团馒头生产工艺[J]. 粮油食品科技, 2014(6): 11-16. DOI:10.3969/j.issn.1007-7561.2014.06.003.
[16] DANIEL A, LACY I, OLDROYD J R. Ice confection: US,US6503548[P]. 2003.
[17] PAYNE S R, SANDFORD D, HARRIS A, et al. The effects of antifreeze proteins on chilled and frozen meat[J]. Meat Science, 1994,37(3): 429-438. DOI:10.1016/0309-1740(94)90058-2.
[18] ZHANG C, ZHANG H, WANG L, et al. Effect of carrot (Daucus carota) antifreeze proteins on texture properties of frozen dough and volatile compounds of crumb[J]. LWT-Food Science and Technology,2008, 41(6): 1029-1036. DOI:10.1016/j.lwt.2007.07.010.
[19] 叶晓枫, 韩永斌, 赵黎平, 等. 冻融循环下冷冻非发酵面团品质的变化及机理[J]. 农业工程学报, 2013, 29(21): 271-278. DOI:10.3969/j.issn.1002-6819.2013.21.034.
[20] 罗明江, 罗春霞, 吴赣香. Ellman’s试剂比色法测定食品中蛋白质的巯基和二硫键[J]. 河南工业大学学报(自然科学版), 1986(1): 96-99.
[21] 王晶. 专用馒头粉中高分子量麦谷蛋白亚基组成和含量与面粉品质关系[J]. 粮食科技与经济, 2009, 34(6): 53-56. DOI:10.3969/j.issn.1007-1458.2009.06.020.
[22] ZHAO L, LI L, LIU G Q, et al. Effect of frozen storage on molecular weight, size distribution and conformation of gluten by SAXS and SEC-MALLS[J]. Molecules, 2012, 17(6): 7169-7182. DOI:10.3390/molecules17067169.
[23] 李玲玲, 贾春利, 黄卫宁, 等. 冰结构蛋白对湿面筋蛋白冻藏稳定性的影响[J]. 食品科学, 2010, 31(19): 25-28.
[24] 冯蕾, 李梦琴, 李超然, 等. SPI挂面特性与其蛋白质结构特征的相关性[J]. 现代食品科技, 2014(1): 55-62. DOI:10.13982/j.mfst.1673-9078.2014.01.027.
[25] 李学红, 胡钟毓, 陆勇, 等. 冻藏时间对麦谷蛋白和麦醇溶蛋白二级结构及面团性能的影响研究[J]. 食品工业科技, 2014, 35(1): 83-86.DOI:10.13386/j.issn1002-0306.2014.01.059.
[26] 潘振兴. 冷冻保护剂影响冷冻面团发酵与烘焙特性的研究[D].无锡: 江南大学, 2008: 27.
[27] 柳小军. 冻藏对面筋蛋白性能的影响及脱水机理研究[D]. 郑州:河南工业大学, 2011: 29-33.
[28] 丁香丽. 大麦籽粒抗冻蛋白的制备及抗冻机制的研究[D]. 无锡: 江南大学, 2015: 56-58.
[29] 李绍虹. 冷冻面团品质改良技术研究[D]. 郑州: 河南工业大学,2010: 59-61.
[30] 叶晓枫. 冻融循环下非发酵面团品质变化机理及其改良应用研究[D].南京: 南京农业大学, 2014: 19-20.
[31] 吴酉芝, 刘宝林, 樊海涛. 低场核磁共振分析仪研究添加剂对冷冻面团持水性的影响[J]. 食品科学, 2012, 33(13): 21-25.

