牵伸倍率分配对纤维素/丝素蛋白共混纤维形态结构的影响
姚勇波, 颜志勇, 李 喆, 易洪雷, 张玉梅, 王华平
(1. 嘉兴学院 材料与纺织工程学院, 浙江 嘉兴 314001; 2. 东华大学 纤维材料改性国家重点实验室, 上海 201620)
纤维素和蛋白质都是可再生的天然高分子资源。人类利用棉、麻等天然纤维素纤维已有几千年的历史。以纤维素为原料制备的粘胶纤维、Lyocell纤维等再生纤维素纤维也获得巨大成功[1]。羊毛、蚕丝等天然蛋白质纤维由氨基酸组成,与人体结构类似,因此,蛋白质纤维具有良好的亲肤性。但是蛋白质资源的再生利用未见突破[2],这是由于蛋白质溶解易造成分子链断裂[3],使得再生纯蛋白纤维的力学性能不能满足实际应用需求[4]。
为更加有效地利用这2类天然高分子材料,可通过溶液共混的方式制备纤维素/蛋白质纤维。共溶解法是一种溶液共混方法,即将不同高分子共溶解于同种溶剂,可提高高分子材料的分散均匀性[5]。已有研究采用离子液体1-丁基-3-甲基咪唑氯盐([BMIM]Cl)为共溶剂,制备了纤维素/丝素蛋白共混纤维[6]。虽然丝素蛋白质量分数的增加会造成纤维力学性能的下降,但是丝素蛋白质量分数达到37.2%时,共混纤维的力学性能依然满足服用要求。
相比于湿法纺丝,干喷湿法纺丝的显著特点是纺丝液黏度大,纺丝速度高,能承受多倍的喷丝头拉伸,因此,常规干喷湿法再生纤维素纤维生产过程不设置后拉伸工序。但是干喷湿法制备纤维素/丝素蛋白共混纤维过程存在问题,即丝素蛋白/[BMIM]Cl黏度略高于[BMIM]Cl,高倍的喷丝头牵伸使纤维直径快速减小,易造成丝素蛋白随溶剂进入凝固浴而流失,且沿纤维径向的分布不均匀[6]。
针对上述问题,本文研究了2道牵伸倍率的分配对共混纤维形态结构与性能的影响,即在凝固浴槽后设置塑化拉伸槽,研究喷丝头牵伸和塑化浴牵伸对丝素蛋白流失量、形态结构及性能的影响,并探讨了纤维素/丝素蛋白共混纤维的成形机制。
1 实验部分
1.1 材 料
纤维素浆粕(聚合度为500),恒天海龙股份有限公司;丝素蛋白与[BMIM]Cl根据文献[7-8]的方法在实验室自制。
1.2 溶液的制备
将蚕茧放入质量比为1∶50、温度为100 ℃、质量分数为0.5%的Na2CO3溶液中脱胶,制得丝素蛋白,然后在80 ℃、真空条件下干燥纤维素与丝素蛋白。采用捏合机将上述2种物质与[BMIM]Cl混合均匀制得纺丝液,溶解温度为90 ℃。所制备的纤维素/丝素蛋白/[BMIM]Cl溶液中纤维素/丝素蛋白的质量分数为8%,质量比为4∶1。
1.3 纺丝实验
采用干喷湿法纺丝装置制备纤维:将脱泡的纺丝液在85 ℃条件下通过喷丝口挤出,纺丝细流穿过长度为5 cm的空气段,继而进入温度为5 ℃的乙醇凝固浴,通过卷绕辊进行1道牵伸,即喷丝头拉伸;出凝固浴后进入温度为5 ℃的乙醇塑化拉伸浴,通过卷绕辊进行2道牵伸,即塑化拉伸。纺丝示意图如图1所示,纺丝工艺参数列于表1中。

图1 共混纤维纺丝示意图Fig.1 Schematic spinning process of blend fibers

样品编号挤出速度 第1辊速度第1道牵伸倍率第2辊速度第2道牵伸倍率CS1-3.02.36.93.0——CS2-1.72.36.93.011.91.7CS1-4.02.39.24.0——CS2-1.32.39.24.011.91.3CS1-5.02.311.55.0——CS2-1.02.311.55.011.91.0
注:表中速度单位为m/min。
1.4 测试方法
1.4.1共混纤维丝素蛋白含量测试
共混纤维的氮元素含量通过德国Elementar公司 Vario EL III型元素分析仪测得,并通过下式换算得到蛋白质的含量[9]:
PSF=5.97PN
式中:PSF表示丝素蛋白含量,%;PN表示氮元素含量,%。
1.4.2共混纤维分子结构测试
通过美国尼高力公司Nicolet Nexus 670 型傅里叶红外光谱仪(FT-IR),采用单点衰减全反射模式获得纤维的红外光谱图。
1.4.3共混纤维形貌观察
采用日本日立公司SU8010型扫描电子显微镜观察纤维断面的形貌。观察前通过哈氏切片器切断纤维并对纤维断面进行喷金处理。采用扫描电子显微镜附件英国牛津仪器公司EDS Inca X-Max型能谱仪对纤维进行氮元素分布的扫描,以此分析纤维的蛋白质分布。采用德国莱卡TCS SP5激光共聚焦显微镜,激发波长设置为488 nm,在接收波长为 500~550 nm的范围内收集丝素蛋白的自发荧光。
1.4.4共混纤维力学性能测试
采用东华大学XQ-2型纤维强伸度仪进行测试。夹持间距为2 cm,拉伸速度为2 cm/min。测量20次,取平均值。
2 结果与讨论
2.1 共混纤维的丝素蛋白含量
表2示出共混纤维的丝素蛋白含量。可知,纺丝液中纤维素与丝素蛋白的质量比为4∶1,成形过程中丝素蛋白有一定程度的流失,其流失质量占比为12.0%~19.5%。分析表2发现,仅经过凝固浴槽的样品(CS1-3.0、CS1-4.0、CS1-5.0),丝素蛋白的流失比略小于经凝固槽与塑化浴共同处理的样品(CS2-1.7、CS2-1.3、CS-1.0),因此,丝素蛋白的流失主要发生在凝固浴槽,且随着喷丝头牵伸倍率的增加而递增。原因在于凝固过程发生溶剂与非溶剂的双扩散,纺丝细流中的[BMIM]Cl快速进入凝固浴乙醇中,而丝素蛋白/[BMIM]Cl的黏度与 [BMIM]Cl处于同一数量级[10],部分丝素蛋白随[BMIM]Cl进入凝固槽。随着喷丝头牵伸倍率的增加,纤维直径变小,比表面积增加,双扩散更剧烈,丝素蛋白流失量也更大。在塑化浴阶段,纤维素与丝素蛋白基本凝固,[BMIM]Cl的扩散大幅减弱,因此,仅有少量丝素蛋白进一步流失。

表2 共混纤维的丝素蛋白含量Tab.2 Silk fibroin content in blend fibers
2.2 共混纤维的分子结构
通过FT-IR研究共混纤维的分子结构,其红外谱图如图2所示。纤维素大分子链每个葡萄糖基环上有3个羟基,在分子链内与分子链间形成氢键,所以在波长3 400 cm-1处出现较宽的羟基特征峰。丝素蛋白具有3种不同的构象,分别是无定型、α-螺旋和β-折叠[11]。由图2可看出,在1 626 和1 530 cm-1处出现丝素蛋白β-折叠构象的特征峰,其结构稳定,不溶于水。在波长为3 288 cm-1处出现的尖锐峰是由纤维素分子链C2、C3位置的羟基与丝素蛋白氨基形成的氢键相互作用产生[12],说明2种高分子存在相互作用。
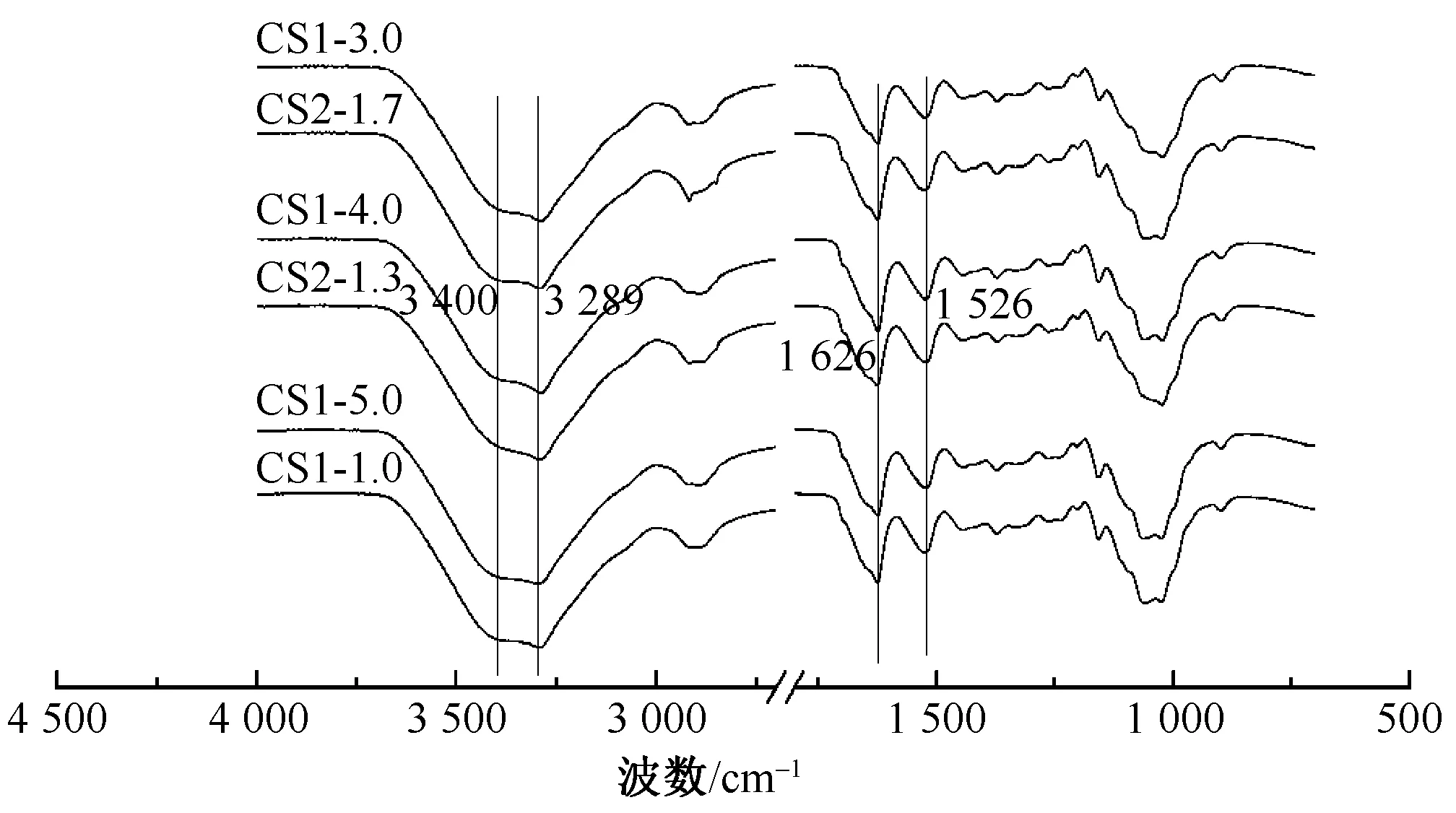
图2 纤维素/丝素蛋白共混纤维FT-IR图谱Fig.2 FT-IR of cellulose/silk fibroin blend fibers
2.3 共混纤维的形态结构
对于高分子共混材料来说,相形态与性能密切相关。纤维素/丝素蛋白共混纤维的扫描电子显微镜(SEM)照片如图3所示。可知,纤维断面结构致密,说明纤维素与丝素蛋白分子间的相互作用有助于两相的均匀分散。

图3 共混纤维截面的SEM照片Fig.3 SEM images of cross-section of blend fibers
由于纤维素与丝素蛋白的原子序数衬度相似,SEM无法分辨纤维素与丝素蛋白,但纤维素分子不含氮元素,而丝素蛋白的氨基酸结构含有氮元素,因此,通过能谱分析(EDS)面扫描技术探测纤维表面氮元素的分布,可以证明丝素蛋白的存在。图4示出共混纤维的EDS照片。可看出,纤维表面存在丝素蛋白的富集区,表明共混纤维以纤维素为连续相,丝素蛋白为分散相的形态结构。

注:纤维表面方框内为面扫描区域;左边黑色区域中的白点表示面扫描区域的N元素分布。图4 共混纤维的EDS照片Fig.4 EDS images of blend fibers
为研究共混纤维的相态结构,需要采用更加有效的纤维素、丝素蛋白相形态观察手段。激光共聚焦显微镜(LSCM)在细胞生物学领域具有重要用途,常用于观察细胞结构。Rice等[13]研究丝素蛋白溶液、膜、凝胶和支架等的结构时,利用其自发荧光特性[14],采用LSCM观察到了丝素蛋白的形态特征。在此基础上,本文将LSCM用于共混纤维的研究。
图5示出共混纤维表面的LSCM照片。可知:当喷丝头牵伸倍率为3时(CS1-3.0),丝素蛋白以微纤状连续、均匀地沿纤维轴向分布;当喷丝头牵伸倍率增加至5时(CS1-5.0),丝素蛋白沿纤维轴向呈现出正弦波动式分布,为藕节状。不相容高分子共混材料的相形态是分散相的聚集与液滴变形-碎裂竞争的结果。已有研究证明拉伸流动能引起共混材料分散相液滴-纤维状形态的转变[15]。纤维素/丝素蛋白/[BMIM]Cl纺丝液出喷丝口后即经受纺丝张力的作用,属于典型的拉伸流动。拉伸流动使丝素蛋白从液滴转变为纤维状,并沿纤维轴向连续分布。随着牵伸倍率的增加,产生了毛细管不稳定现象。毛细管不稳定性是指线性流体受到扰动时,在另一种流体流动中产生正弦式波动。根据Tomotika方程,扰动的增长速率可通过下式进行计算[16]:
式中:q表示扰动的增长速率,m/s;δ为界面张力,N/m;Ω(λ,p)为取决于两组分黏度比的函数;ηm为基体聚合物的零切黏度,Pa·s;R0为流线的初始半径,m。
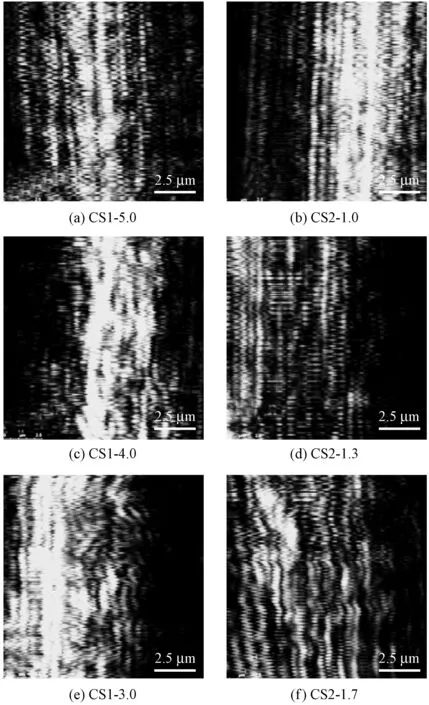
注:白色为丝素蛋白。图5 共混纤维表面的LSCM照片Fig.5 LSCM images of blend fibers
从公式可知,当牵伸作用于出喷丝口后的纺丝细流时,分散相丝素蛋白从液滴状变为沿纤维轴向连续分布的微纤状。随着牵伸倍率的进一步增加,分散相半径减小,扰动的增长速率增加,从而产生正弦式扰动,出现如图5中样品CS1-5.0、CS2-1.0的形态。牵伸倍率分配对丝素蛋白相形态变化的影响如图6所示。可知,在凝固浴中经过3倍喷丝头牵伸的纤维,丝素蛋白的相形态是连续的微纤状结构。经塑化浴中继续牵伸1.7倍(CS2-1.7)时,丝素蛋白分散相未发生明显的变化,依旧是连续均匀的,因为纤维素/丝素蛋白在凝固浴中的牵伸是溶液的牵伸,经流场作用下纤维素与丝素蛋白的相态结构发生变化。而在塑化浴中的拉伸是对初生纤维的拉伸,进入塑化浴的初生纤维已基本凝固,丝素蛋白分散相难以发生明显的扰动,因此形态未发生变化。

图6 牵伸倍率分配对共混纤维中丝素蛋白沿轴向分布的影响Fig.6 Effect of distribution of drawing ratios on phase morphology of silk fibroin along longitudinal axes for cellulose/silk fibroin blend fibers.(a) Drafting ratio of spinneret; (b)Drawing ratio of plasticizing bath
图7示出纤维素/丝素蛋白共混纤维断面的LSCM照片。当喷丝头牵伸倍数为3时,丝素蛋白在纤维径向的分布比较均匀。随着牵伸倍数的增加,丝素蛋白沿纤维径向的分布变得不规则,但是未出现熔融纺丝制备共混纤维时发生的低黏度分散相富集在纤维外层的现象,说明湿法纺与熔融纺丝共混纤维的相态结构存在差异。原因在于湿法纺丝过程纺丝细流进入凝固浴,发生相分离并形成皮芯结构,凝固是由外到内的过程,减弱了丝素蛋白向纤维外层的流动趋势。成形过程丝素蛋白沿纤维径向的相态变化为:当牵伸倍数较低时,纤维直径较粗,丝素蛋白的流失率较小,丝素蛋白沿纤维径向的流动不明显;而随喷丝头牵伸倍数的增加,导致纤维直径变小,丝素蛋白流失率增加,沿纤维径向的流动明显,使得丝素蛋白在纤维径向的分布不均匀。

注:白色为丝素蛋白。图7 共混纤维截面LSCM照片Fig.7 LSCM cross-section images of of blend fibers
2.4 共混纤维的力学性能
共混纤维的力学性能如表3所示。凝固浴阶段,断裂强度随喷丝头牵伸倍数的增加而增强,断裂伸长率逐渐减小。经过凝固浴与塑化浴2道牵伸的纤维,断裂强度的范围为378.0~389.8 MPa,初始模量范围为17.6~18.0 GPa,断裂伸长率为 4.76~6.11%,2道牵伸倍率的分配能够减少丝素蛋白的流失,但对纤维力学性能的影响较小。可见影响纤维力学性能的是总牵伸倍数,牵伸作用使纤维素、丝素蛋白的结晶度、取向度提高,力学性能增强。

表3 纤维素/丝素蛋白共混纤维力学性能Tab.3 Mechanical properties of cellulose/silk fibroin blend fibers
3 结 论
以[BMIM]Cl为共溶剂,通过干喷湿法纺丝方法制备了纤维素/丝素蛋白共混纤维。以纤维素与丝素蛋白质量比为4∶1的纺丝液,成形过程的相形态变化遵循液滴形变与破裂理论,丝素蛋白分散相的分散模式为液滴-纤维态。当总牵伸倍率为5,喷丝头牵伸倍率为3时,丝素蛋白相形态是沿轴向的连续微纤状;随着喷丝头牵伸倍数的进一步提高,丝素蛋白沿轴向分布出现正弦波动,形态为藕节状。经凝固浴得到的初生纤维,相形态基本固定,塑化浴牵伸不改变相形态结构,但是增加塑化浴工艺可减少丝素蛋白的流失。研究还发现,第1道喷丝头牵伸与第2道塑化牵伸对共混纤维力学性能的作用相同,而总牵伸倍数明显影响共混纤维的断裂强度。
参考文献:
[1] FINK H P, WEIGEL P, PURZ H J, et al. Structure formation of regenerated cellulose materials from NMMO-solutions[J]. Progress in Polymer Science, 2001, 26(9): 1473-1524.
[2] KOLLER D, HALMERBAUER G, BÖCK A, et al. Action of a silk fabric treated with AEGISTM in children with atopic dermatitis: a 3-month trial[J]. Pediatric Allergy and Immunology, 2007, 18(4): 335-345.
[3] HESLOT H. Artificial fibrous proteins: a review[J]. Biochimie, 1998, 80(1): 19-31.
[4] VOLLRATH F, HOLLAND C, TERRY A E, et al. Natural and unnatural silks[J]. Polymer, 2007, 48(12): 3388-2292.
[5] MACOSKO C W. Morphology development and control in immiscible polymer blends[J]. Macromolecular Symposia, 2000, 149(1): 171-184.
[6] YAO Y, ZHANG E, XIA X, et al. Morphology and properties of cellulose/silk fibroin blend fiber prepared with 1-butyl-3-methylimidazolium chloride as solvent[J]. Cellulose, 2014, 22(1): 625-635.
[7] CAO H, CHEN X, HUANG L, et al. Electrospinning of reconstituted silk fiber from aqueous silk fibroin solution[J]. Materials Science & Engineering C: Materials for Biological Applications, 2009, 29(7): 2270-2274.
[8] CSIHONY S, FISCHMEISTER C, BRUNEAU C, et al. First ring-opening metathesis polymerization in an ionic liquid. Efficient recycling of a catalyst generated from a cationic ruthenium allenylidene complex[J]. New Journal of Chemistry, 2002, 26(11): 1667-1670.
[9] YANG G, ZHANG L N, CAO X D, et al. Structure and microporous formation of cellulose/silk fibroin blend membranes: part II: effect of post-treatment by alkali[J]. Journal of Membrane Science, 2002, 210(2): 379-387.
[10] YAO Y, MUKUZE K S, ZHANG Y, et al. Rheological behavior of cellulose/silk fibroin blend solutions with ionic liquid as solvent[J]. Cellulose, 2014, 21(1): 675-684.
[11] HYOUNGJOON J, PARK J, KARAGEORGIOU V, et al. Water-stable silk films with reduced beta-sheet content[J]. Advanced Functional Materials, 2005, 15(8): 1241-1247.
[12] KONDO T, SAWATARI C, MANLEY R S, et al. Characterization of hydrogen-bonding in cellulose synthetic-polymer blend systems with regioselectively substituted methylcellulose[J]. Macromolecules, 1994, 27(1): 210-215.
[13] RICE W L, FIRDOUS S, GUPTA S, et al. Non-invasive characterization of structure and morphology of silk fibroin biomaterials using non-linear micro-scopy[J]. Biomaterials, 2008, 29(13): 2015-2024.
[14] GEORGAKOUDI I, TSAI I, GREINER C, et al. Intrinsic fluorescence changes associated with the conformational state of silk fibroin in biomaterial matrices[J]. Optics Express, 2007, 15(3): 1043-1053.
[15] LEE J K, CHANG D H. Evolution of polymer blend morphology during compounding in a twin-screw ex-truder[J]. Polymer, 2000, 41(5): 1799-1815.
[16] PAUL D R, BUCKNALL C B. Polymer Blends: Formulation and Performance, Two-Volume Set [M]. New Jersey: John Wiley & Sons, 2000: 52-54.

