NH4+对次生铁矿物形成及重金属去除的影响
宋永伟,王鹤茹,曹艳晓,朱祎涵,周立祥 (.中南财经政法大学环境科学与工程系,湖北 武汉 430073;.南京农业大学环境工程系,江苏 南京 0095)
酸性矿山废水(AMD)具有酸度高且含有大量 Fe、SO42–及重(类)金属元素的特点[1-4].AMD主要采用石灰中和法治理[5-7],但其处理成本高且中和效率低,并会导致大量Fe(OH)3、Fe(OH)2、CaSO4等废渣产生.嗜酸性氧化亚铁硫杆菌(A.ferrooxidans)能高效催化酸性环境中 Fe2+向Fe3+转化,并伴随Fe3+水解产生施氏矿物、黄铁矾等次生铁矿物[8-9].施氏矿物化学组成可表示为Fe8O8(OH)8-2x(SO4)x(1≤x≤1.75)[10],呈管状隧道结构,含有活性较强的—OH,SO42–与Fe配位壳层络合,同时矿物表面吸附有大量的、对其结构起稳定作用的 SO42–[11-13].隧道内 SO42–可以被离子半径相当、但与 Fe配位能力更强的阴离子(如CrO42–等)所取代[14].黄铁矾化学组成可表示为MFe3(SO4)2(OH)6(M 通常指 K+、Na+、NH4+等),为黄色或淡黄色晶体[15],具有易沉淀和过滤脱水等优点,是性能优异、稀有昂贵的赭黄色无机颜料[16],且作为固定化载体时有助于A.ferrooxidans生物膜的形成[17-20].已经证实,施氏矿物和黄铁矾对重(类)金属元素均有较大的吸附或共沉淀作用,是较为理想的吸附材料[21-24],对含重金属废水(如酸性矿山废水、电镀废水、制革厂含铬废水等)的治理具有潜在应用价值.
次生铁矿物形成的影响因素主要包括反应时间、温度、体系酸度、能源物质Fe2+浓度、阳(阳)离子种类/浓度等[25-30].次生铁矿物形成的实质是 Fe2+氧化(耗酸)和 Fe3+水解(产酸)过程,Fe3+供应速率决定了其合成行为.本课题组推测,A.ferrooxidans介导的次生铁矿物矿相和矿量可能主要受体系中酸效应、Fe2+浓度、以及 Fe与M(K+、Na+、NH4+等)的比例 3 因素的调控.已有研究表明,提高K+浓度有助于黄钾铁矾的形成而不利于施氏矿物生成[31-33].Fe2+=160mmol/L体系中,Fe/Na物质的量比在1.0~2.0范围内所获得次生铁矿物均为纯净施氏矿物;当 Fe/Na物质的量比降至 0.5时,次生铁矿物合成途径开始向黄钠铁矾转移,且其特征衍射峰随着 Na+浓度提高愈加显著[34].但通过考察K+、NH4+、Na+共存体系下的生物成矿效果,只收集到黄钾铁矾和施氏矿物的混合物,并未发现黄铵铁矾和黄钠铁矾[35].可见,3种一价阳离子促进Fe向次生铁矿物转变的能力迥异.然而,在矿物生物合成及矿相转变报道中,关于黄铵铁矾的资料相对较少.那么,NH4+促进Fe成矿能力、次生铁矿物相与矿物量关系、施氏矿物和黄铵铁矾之间的转变和调控等科学问题尚需进一步证实.
基于上述疑问,本研究通过A.ferrooxidans介导的生物矿化法,研究不同 AMD酸性环境下NH4+对体系中Fe2+氧化率、总Fe沉淀率、次生铁矿物矿相/矿量等的影响,并比较分析次生铁矿物对Cr(VI)、As(III)的去除效果及机理.以期为促使AMD中Fe向次生铁矿物的生物转变和调控提供必要的理论依据.
1 材料与方法
1.1 供试材料
改良 9K液体培养基:(NH4)2SO43.5g、KCl 0.119g、K2HPO40.058g、Ca(NO3)24H2O 0.0168g、MgSO47H2O 0.583g,蒸馏水 1000mL, pH=2.50,121℃灭菌30min.
A. ferrooxidans休止细胞:将A. ferrooxidans接种在改良 9K培养基中,置于 28℃、180r/min摇床中振荡扩培,待指数生长后期停止培养.将培养液经定性滤纸过滤以除去生成的沉淀物,滤液以 10000×g离心力(4℃、10min)收集菌体,并用pH=1.5的H2SO4清洗3次,除去各种杂离子.将这些菌体悬浮于pH=2.5的H2SO4溶液中.采用双层平板计数法测得菌液密度为5×108cell/mL.
1.2 NH4+对A. ferrooxidans介导的次生铁矿物合成的影响研究
在系列500mL三角瓶中加入改良9K液体培养基,按20,80,160mmol/L的Fe2+浓度梯度准确加入 FeSO4·7H2O.采用(NH4)2SO4作为 NH4+来源进行调节,设置 Fe/NH4+物质的量比梯度分别为0.1,0.5,1.0,2.0.用 1:1的 H2SO4调上述所有体系pH值至2.6,2.3,2.0,依此共设置36个处理.随后接种A. ferrooxidans休止细胞,并补充去离子水,使体系有效容积为 250mL,A. ferrooxidans密度约为 5×107cells/mL.将上述三角瓶置于 28℃、180r/min摇床中进行生物氧化和水解成矿反应.定期取样过0.22µm滤膜(三角瓶预先静置5min,然后取上清液),测定和计算Fe2+浓度、总Fe沉淀率.培养终点时,用中速定性滤纸收集合成的次生铁矿物,并用去离子水润洗 2次以去除矿物表面吸附的离子.60℃烘干后进行称重和矿物相鉴定.不同处理均设3个重复.
1.3 生物成因次生铁矿物对 Cr(VI)、As(III)的去除效果比较研究
在250mL三角瓶中加入Fe2+=160mmol/L、Fe/NH4+=2.0时,各pH值下获得次生铁矿物0.05g和一定浓度的 Cr(VI)溶液(由 K2Cr2O7配制)或As(III)溶液(由As2O3配制).采用去离子水稀释至95mL,然后用1mol/L的HNO3调节pH值分别至1.0,2.0,3.0,4.0,5.0,以模拟不同酸度水平的矿山废水,最后用去离子水补充至总有效体积为100mL,使溶液中Cr(VI)或As(III)浓度分别为10,1mg/L.将三角瓶置于28℃、180r/min摇床中振荡6h,过滤测定液相中 Cr(VI)或 As(III)含量.同时设置pH=7.0作为对照,每个处理重复3次.
1.4 测定方法
Fe2+和总Fe浓度采用邻啡罗啉比色法测定;矿物相采用X射线衍射仪测定(Bruker D8A25);SEM采用SU8010型扫描电镜观察;XPS采用VG Multilab 2000光电子能谱仪测定;用二苯碳酰二肼比色法测定Cr(VI);As(III)采用AFS-9730型原子荧光光谱仪测定;用BET吸附法测定次生铁矿物的比表面积(Micromeritic ASAP 2020).
1.5 数据处理与统计分析
以Origin 8.0软件作图,采用SPSS软件统计分析,方差分析后通过SNK方法进行多重比较.
2 结果与讨论
2.1 酸性体系Fe2+、总Fe浓度变化情况
以初始 pH=2.0为例,考察了 Fe2+浓度和Fe/NH4物质的量比对Fe2+氧化和总Fe沉淀的综合影响.当NH4+浓度在A. ferrooxidans耐受范围内时,160,80,20mmol/LFe2+分别在 72,48,24h内被完全氧化(图 1).Fe/NH4+=0.1、Fe2+=80~160mmol/L和Fe/NH4+=0.5、Fe2+=160mmol/L系列处理中,A. ferrooxidans氧化活性均受到抑制,表现在 Fe2+平均氧化率不到 5%.分析认为,(NH4)2SO4作为中性盐,过高 NH4+浓度可能导致体系渗透压变化以致菌体水分流失而失活.根据Fe/NH4+=0.5、Fe2+= 80mmol/L 和 Fe/NH4+=1.0、Fe2+=160mmol/L处理可知(NH4+=160mmol/L),虽然Fe2+分别能够在48h和72h内被氧化完全,但其生物氧化过程相对延缓.通过比较可初步判断,A. ferrooxidans对NH4+的耐受浓度临界值在80~160mmol/L范围内,被完全抑制浓度临界值在160~320mmol/L之间.
根据次生铁矿物的生化反应式(如下所示),在 NH4+存在条件下,Fe2+氧化过程往往会伴随着产物 Fe3+的水解形成施氏矿物或黄铵铁矾,从而促使溶液中可溶性Fe有效沉淀.
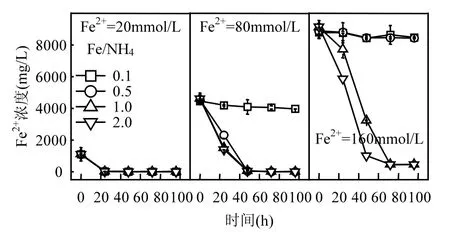
图1 初始pH=2.0时Fe2+浓度变化Fig.1 Change of Fe2+ concentration in each treatment system when initial pH value was 2.0

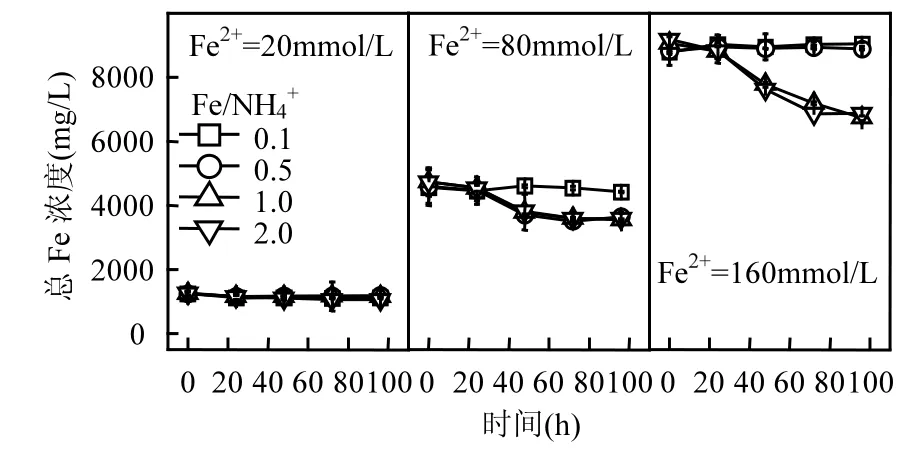
图2 初始pH=2.0时总Fe浓度变化Fig.2 Change of total Fe concentration in each treatment system when initial pH value was 2.0
结合图1、图2可知,当酸性体系初始pH值和Fe2+浓度一定时,若A. ferrooxidans生物氧化活性未受抑制,则Fe/NH4+物质的量比对总Fe浓度影响较小,这与同为一价阳离子的K+存在一定差异.柏双友等发现,当 Fe2+=80mmol/L、Fe/K=25~200时均能够促使约31%的总Fe沉淀,当提高K+浓度至 Fe/K=10时,总 Fe累积沉淀率则超过40%[36].从培养时间角度观察,160,80,20mmol/L的Fe2+体系总Fe浓度分别在72,48,24h基本趋于稳定,至培养终点时平均总 Fe沉淀率分别为24.03%,19.46%,8.13%.可见,初始 Fe2+浓度越高,Fe3+供应速率越快,越有利于体系总 Fe沉淀.在Fe2+完全生物氧化期间,160,80,20mmol/L体系所对应的 Fe3+供应速率分别为 2.22,1.67,0.83mmol/(L·h),这也为上述推断提供合理的解释.进一步分析表明,总 Fe沉淀率变化趋势与Fe2+氧化过程基本一致,说明 Fe3+水解可能伴随Fe2+生物氧化才能进行,若 Fe2+氧化完全,则次生铁矿物合成也随即终止.
2.2 生物成因次生铁矿物质量比较
总Fe浓度变化只能表征酸性体系中可溶性Fe的沉淀情况,而次生铁矿物质量则可更直观地反映A. ferrooxidans对Fe2+的生物矿化效果.如图3所示,次生铁矿物质量随初始pH值降低而出现减少的现象,这可能与次生铁矿物特性有一定的关系.由于 NH4+成矾能力较弱,反应过程可能更倾向于易扩散和溶解的施氏矿物合成[37-39].刘奋武等研究表明,当酸性体系 pH值从 3.0下调至2.0后,施氏矿物 72h内的溶解率从 3.34%增至61.46%[40].依此可知,要促使总Fe沉淀率提高,对反应体系pH值的适当调控至关重要.

图3 培养终点收集矿物质量比较Fig.3 The comparison of mineral mass at the culture end of each treatment system
从 Fe2+浓度来看,提高体系初始 Fe2+浓度有助于矿物的大量合成,这与图2结果相吻合.但从Fe/NH4+物质的量比变量分析,发现图2与图3之间存在“矛盾”.前已述及,NH4+在A. ferrooxidans耐受范围内时,Fe/NH4+物质的量比对体系总 Fe浓度影响较小,总Fe沉淀率曲线基本重合.而由图3可知,在Fe/NH4+=0.5或1.0时能够获取更多的次生铁矿物(pH=2.0~2.3),随着 Fe/NH4+继续提高(NH4+浓度降低)而呈下降趋势.分析认为,这与次生铁矿物的形成途径具有一定关系,当体系中 NH4+适量时,更有利于成矿过程倾向黄铵铁矾的合成.由反应式(2)、(3)来看,若次生铁矿物按单一路径发生,则单位Fe3+所生成纯黄铵铁矾质量应为纯施氏矿物的1.5倍以上,这也为次生铁矿物产量的增加提供可能.综上,虽然NH4+成矾能力较弱,其浓度变化对总 Fe沉淀去除的“贡献”较小,适量NH4+仍有助于次生铁矿物的生物合成.
2.3 生物成因次生铁矿物XRD图谱
图4为Fe2+=160mmol/L体系培养终点收集次生铁矿物XRD图谱.参考JCPDS黄铵铁矾和施氏矿物标准图谱可知[41],当 NH4+浓度满足要求时,较低初始 pH值有利于黄铵铁矾形成,表现为黄铵铁矾部分衍射峰随着pH值的下降而出现并逐渐增强(如 2θ=17.31°,28.72°,38.82°,45.59°等).根据反应式(2)、(3)可知,1mol Fe3+水解生成施氏矿物可释放出2.75mol的H+,而水解生成黄铵铁矾却只能释放出2mol的H+.相比之下,过低初始pH值可能对施氏矿物合成行为的抑制作用更大,从而导致黄铵铁矾更易形成.王长秋等在用化学方法合成黄钾铁矾时也报道过相似现象[42].根据衍射峰位及强度(2θ=35.16°)判断[43],Fe/NH4+=2.0、pH=2.6处理所获得次生铁矿物中为纯净施氏矿物.当 NH4+浓度上升至 160mmol/L(Fe/NH4+=1.0)或酸性体系初始 pH值下调至 2.3时,次生铁矿物合成途径开始向黄铵铁矾转变,收集产物为施氏矿物和黄铵铁矾混合物.Fe/NH4=0.1~0.5时,施氏矿物特征峰基本消失,黄铵铁矾关键峰位与标准图谱基本重合,其相对强度随着NH4+浓度提高愈加显著,说明该条件有利于纯黄铵铁矾的形成.Bai等[44]研究表明,初始 Fe2+=160mmol/L溶液中,Fe/K≤100时就开始出现黄钾铁矾衍射峰.本研究中,Fe/NH4物质的量比则需下调至 1.0~2.0才能出现黄铵铁矾,说明 NH4+成矾能力远小于K+.

图4 Fe2+浓度为160mmol/L时收集矿物XRD图谱Fig.4 The XRD of minerals when Fe2+ initial concentration was 160mmol/L
2.4 生物成因次生铁矿物对 Cr(VI)、As(III)的去除效果比较及分析
为比较 NH4+存在下次生铁矿物对酸性矿山废水中Cr(VI)、As(III)的去除效果,根据XRD图谱(图 4)的差异分析,选择 Fe/NH4+=2.0时,初始pH=2.6,2.3,2.0对应3个成矿体系获得的次生铁矿物作为对象进行考察.结果如图5所示,不同酸性体系获得次生铁矿物对Cr(VI)、As(III)去除效果存在明显差别,表现为有毒元素去除率依次为pH=2.6>pH=2.3>pH=2.0.例如,pH=2.6,2.3,2.0 体系收集次生铁矿物对pH=4.0模拟酸性矿山废水Cr(VI)和As(III)去除率为74.23%,51.57%,33.56%和 71.56%,49.65%,41.14%;对照处理 Cr(VI)和As(III)去除率分别达到 95.34%,85.24%,75.23%和94.23%,87.27%,71.09%.
受溶液 pH值的影响,不同酸性矿山废水中Cr(VI)、As(III)也表现为多种形态共存,其理化性质也随之发生变化.因此,同一矿物对不同形态金属离子的吸附去除也存在较大差异[45].已知Cr(VI)和 As(III)受溶液酸碱度影响而引起各形态之间的转化过程如下所示:

在此,选择Fe/NH4+=2.0、pH=2.6处理获得纯施氏矿物,结合不同酸度条件下 Cr(VI)和 As(III)离子形态来比较和分析各自吸附过程.施氏矿物作为一种结晶度较差的羟基硫酸高铁矿物,其晶格构造的管道直径与AsO33-、CrO42-相当,且结构内的 SO42-与 Fe配位络合,同时矿物表面还结合了大量起到稳定结构的SO42-和高活性-OH基团,这些都为重(类)金属离子的去除提供了有利条件[46].以 Cr(VI)为例,当 pH<3.0 时,随着酸度的增大,Cr(VI)趋于中性的 H2Cr2O7,不利于施氏矿物的吸附;当 3.0<pH <6.0,其主要存在形式为HCrO4-,易与 Fe(III)发生络合而去除[47];当pH>6.0 时,Cr(VI)以 CrO42-的形式存在,可与施氏矿物表面结构中的 SO42-发生交换,亦可与 SO42-通过配位体交换被固定到矿物内部结构中,因此能够获得较好的去除效果[11,47].另外,由As(III)离子形态转换可知,当溶液酸度较高时,主要以呈电中性的 H3AsO3分子形态存在,其很难取代施氏矿物结构中的 HSO4-和 SO42-基团,从而影响As(III)的去除效率[48].

图5 pH值对次生铁矿物吸附去除Cr(VI)和As(III)的影响Fig.5 Effecet of pH value on removal of Cr(VI) and As(III) by secondary iron minerals
为考察该施氏矿物对 Cr(VI)或 As(III)的吸附特点,选择模拟酸性矿山废水pH=3.0时经吸附处理后的施氏矿物进行XPS能谱分析.虽然本研究中监测到施氏矿物对 Cr(VI)的去除率接近60%,但并未发现明显的 Cr(VI)强度峰.分析认为HCrO4-可能与施氏矿物内部的 Fe(III)发生了络合而被固定到内部结构中,但XPS只能做表面分析,对内部的化学组分、结构及价态等信息难以检测.另外,分析表明施氏矿物表面吸附As(III)的存在形态为 As2O3.根据 As(III)在不同酸度溶液中的形态来看,应以 H3AsO3为主.笔者认为,在检测XPS前,施氏矿物预先经过烘干处理, 可能导致吸附的H3AsO3失水而形成As2O3.结合前人研究结果,推断该酸性环境下 As(III)的少量去除可能通过与矿物表面的-OH发生取代反应来实现(M-OH+H3AsO3↔ M-H2AsO3+H2O)[49].


图6 不同处理下生物成因施氏矿物SEM照片Fig.6 SEM images of schwertmannite under different treatments
为进一步分析图5中3种矿物表现出的有毒元素吸附去除能力显著差异的原因,通过扫描电镜、比表面积等方法对其进行了测试比较.由图6扫描电镜照片可以发现,3种矿物均为球体或椭圆体结构并凝聚成团,但三者表观结构存在明显差异.pH=2.0处理所得矿物表面相对光滑,颗粒大小不一,比表面积8.22m2/g;pH=2.3培养体系获得矿物呈“毛线团”、“蚕茧”形状,表面粗糙并含有大量微孔结构,测定颗粒比表面积14.28m2/g.XRD图谱分析表明,pH=2.0,2.3体系合成矿物为施氏矿物和黄铵铁矾的混合物,虽然通过扫描电镜照片也可以观察到少量不规则颗粒存在,但混合产物仍以施氏矿物为主.与前两个处理相比,pH=2.6条件下合成纯施氏矿物的表观结构差异更加显著,颗粒构成“海胆”、“板栗壳”形状,表面布满针状毛刺,孔隙较大、孔洞较深,测定颗粒比表面积达 24.47m2/g.Loan等观察也表明,酸性矿山废水中形成的施氏矿物多数呈球型“海胆”结构,但直径只有 300~500nm,表面布满长约60~90nm 的针状毛刺[38,41,50-51].众所周知,矿物颗粒比表面积越大,其吸附性能越强.因此,从表观结构和比表面积两个方面都能够合理解释 3种次生铁矿物对Cr(VI)、As(III)吸附去除能力存在较大差异性的原因.
3 结论
3.1 NH4+浓度在A. ferrooxidans耐受范围内时,不影响 Fe2+氧化及总 Fe沉淀去除效果.初始160,80,20mmol/L的Fe2+分别能够在72,48,24h内被完全生物氧化,培养终点时(96h)平均总 Fe沉淀率分别为24.03%,19.46%,8.13%.
3.2 初始 Fe2+=160mmol/L体系中,Fe/NH4+=2.0、pH=2.6处理获得次生铁矿物为纯净施氏矿物;当 Fe/NH4+≤1.0、pH≤2.3 时,矿物的生物合成途径开始向黄铵铁矾转移,且其特征衍射峰随着NH4+浓度提高表现地愈加明显.
3.3 初始 Fe2+=160mmol/L、Fe/NH4+=2.0时,pH=2.6,2.3,2.0体系下获得的次生铁矿物对Cr(VI)或 As(III)的吸附去除效果存在显著差异,表现在去除率依次为 pH=2.6>pH=2.3>pH=2.0.分析表明,矿物的表观结构和比表面积是引起有毒元素去除能力存在较大差异性的主要原因.
[1]Wei X, Wolfe F A. Minerals and mine drainage [J]. Water Environment Research, 2013,85(10):1515-1547.
[2]Vhahangwele M. A novel technology for neutralizing acidity and attenuating toxic chemical species from acid mine drainage using cryptocrystalline magnesite tailings [J]. Journal of Water Process Engineering, 2016,10(6):67-77.
[3]Wu Z L, Zou L C, Chen J H, et al. Column bioleaching characteristic of copper and iron from Zijinshan sulfide ores by acid mine drainage [J]. International Journal of Mineral Processing, 2016,149:18-24.
[4]Liu G W, Bai R C. Development of the acidic mining wastewater treatment technology [J]. Applied Mechanics and Materials,2013,295-298:1372-1375.
[5]Song Y W, Wang M, Liang J R, et al. High-rate precipitation of iron as jarosite by using a combination process of electrolytic reduction and biological oxidation [J]. Hydrometallurgy, 2014,143(3):23-27.
[6]Meschke K, Herdegen V, Aubel T, et al. Treatment of opencast lignite mining induced acid mine drainage (AMD) using a rotating microfiltration system [J]. Journal of Environmental Chemical Engineering, 2015,4(4):2848-2856.
[7]Lee W C, Lee S W, Yun S T, et al. A novel method of utilizing permeable reactive kiddle (PRK) for the remediation of acid mine drainage [J]. Journal of Hazardous Materials, 2016,301:332-341.
[8]宋永伟,赵博文,霍敏波,等.温度对嗜酸性硫杆菌活性和生物成因次生铁矿物形成的影响 [J]. 环境科学, 2013,34(8):3264-3271.
[9]Zhu J Y, Gan M, Zhang D, et al. The nature of Schwertmannite and Jarosite mediated by two strains of Acidithiobacillus ferrooxidans with different ferrous oxidation ability [J]. Materials Science and Engineering C, 2013,33(5):2679-2685.
[10]Schwertmann U, Bigham J M, Murad E. The first occurrence of schwertmannite in a natural stream environment [J]. European Journal of Mineralogy, 1995,7:547-552.
[11]Bigham J M, Schwertmann U, Carlson L. A poorly crystallized xyhydoxysulfate of iron formed by bacterial oxidation of Fe(II) in acid mine waters [J]. Geochimica et Cosmochimica Acta, 1990,54:2743-2758.
[12]Regenspurg S, Göbner A, Peiffer S, et al. Potential remobilization of toxic anions during reduction of arsenate and chromated schwertmannite by the dissimilatory Fe(III)-reducing bacterium Acidiphilium Cryptum JF-5 [J]. Water, Air, and Soil Pollution,2002,2(3):57-67.
[13]Gagliano W B, Brill M R, Bigham J M, et al. Chemistry and mineralogy of ochreous sediments in a constructed mine drainage wetland [J]. Geochimica et Cosmochimica Acta, 2004,68:2119-2128.
[14]Regenspurg S, Brand A, Peiffer S. Formation and stability of schwertmannite in acid mining lakes [J]. Geochimica et Cosmochimica Acta, 2004,68:1185-1197.
[15]Bigham J M, Nordstrom D K. Iron and aluminum hydroxysulfates from acid sulfate waters [J]. Reviews in Mineralogy and Geochemistry, 2000,40,351-403.
[16]周顺桂,周立祥,黄焕忠.黄钾铁矾的生物合成与鉴定 [J]. 光谱学与光谱分析, 2004,24(9):1140-1143.
[17]Karamanev D G. Model of the biofilm structure of Thiobacillus ferrooxidans [J]. Journal of Biotechnology, 1991,20(1):51-64.
[18]Elgersma F, Witkamp G J, Van Rosmalen G M. Simultaneous dissolution of zinc ferrite and precipitation of ammonium jarosite[J]. Hydrometallurgy, 1993,34:23-47.
[19]Dutrizac J E. The effect of seeding on the rate of precipitation of ammonium jarosite and sodium jarosite [J]. Hydrometallurgy,1996,42:293-312.
[20]Gómez J M, Cantero D, Webb C. Immobilisation of Thiobacillus ferrooxidans cells on nickel alloy fibre for ferrous sulphate oxidation [J]. Applied Microbiology and Biotechnology, 2000,54:335-340.
[21]陈福星,周立祥.生物催化合成的施氏矿物对废水中Cr(VI)的吸附 [J]. 中国环境科学, 2006,26(1):11-15.
[22]Gan M, Sun S G, Zheng Z H, et al. Adsorption of Cr(VI) and Cu(II) by AlPO4modified biosynthetic schwertmannite [J].Applied Surface Science, 2015,356(30):986-997.
[23]Mihone K M, Hana F, Sanda R, et al. Assessment of metal risks from different depths of jarosite tailing waste of Trepça Zinc Industry, Kosovo based on BCR procedure [J]. Journal of Geochemical Exploration, 2015,148:161-168.
[24]Zhang S L, Jia S Y, Yu B, et al. Sulfidization of As(V)-containing schwertmannite and its impact on arsenic mobilization [J].Chemical Geology, 2016,420(20):270-279.
[25]刘奋武,高诗颖,王 敏,等.镁离子对氧化亚铁硫杆菌生物合成次生铁矿物的影响 [J]. 中国环境科学, 2014,34(3):713-719.
[26]刘奋武,高诗颖,崔春红,等.Ca2+对酸性硫酸盐环境中次生铁矿物合成的影响 [J]. 中国环境科学, 2015,35(4):1142-1148.
[27]Dutrizac J E, Kaiman S. Synthesis and properties of jarosite-type compounds [J]. Canadian Mineralogist, 1976,14:151-158.
[28]Dutrizac J E. The effectiveness of jarosite species for precipitating sodium jarosite [J]. Journal of the Minerals, Metals and Materials Society, 1999,51(12):30-32.
[29]邓志明,周正华.湿法炼锌浸出沉铁探讨 [J]. 湖南有色金属,2002,18(1):23-25,45.
[30]宋永伟,陈 婷,王鹤茹,等.阴离子对 Acidithiobacillus ferrooxidans氧化活性及次生铁矿物形成影响 [J]. 中国环境科学, 2018,38(2):574-580.
[31]Bigham J M, Schwertmann U, Traina S J, et al. Schwertmannite and the chemical modeling of iron in acid sulfate waters [J].Geochimica et Cosmochimica Acta, 1996,60(12):2111-2121.
[32]Gramp J P, Sandy Jones F, Bigham J M, et al. Monovalent cation concentrations determine the types of Fe(III) hydroxysulfate precipitates formed in bioleach solutions [J]. Hydrometallurgy,2008,94(1-4):29-33.
[33]Liao Y, Zhou L, Liang J, et al. Biosynthesis of schwertmannite by Acidithiobacillus ferrooxidans cell suspensions under different pH condition [J]. Materials Science and Engineering C, 2009,29(1):211-215.
[34]宋永伟,王鹤茹,梁剑茹,等.嗜酸性氧化亚铁硫杆菌介导的次生铁矿物形成的影响因素分析:pH、Fe2+、Fe/Na [J]. 环境科学学报, 2017,DOI:10.13671/j.hjkxxb.2017.0360.
[35]柏双友,梁剑茹,周立祥.一价阳离子和水溶性有机质对生物沥浸中次生铁矿物形成的影响 [J]. 矿物学报, 2011,31(1):118-125.
[36]柏双友,梁剑茹,周立祥.FeSO4-K2SO4-H2O体系中Fe/K摩尔比对生物成因羟基硫酸铁矿物质量的影响及环境意义 [J]. 环境科学学报, 2010,30(8):1601-1607.
[37]Dold B. Dissolution kinetics of schwertmannite and ferrihydrite in oxidized mine samples and their detection by differential X-ray diffraction (DXRD) [J]. Applied Geochemistry, 2003,18(10):1531-1540.
[38]Loan M, Richmond W R, Parkinson G M. On the crystal growth of nanoscale schwertmannite [J]. Journal of Crystal Growth,2005,275(1/2):1875-1881.
[39]李浙英,梁剑茹,柏双友,等.生物成因与化学成因施氏矿物的合成、表征及其对As(Ⅲ)的吸附 [J]. 环境科学学报, 2011,31(3):460-467.
[40]刘奋武,卜玉山,田国举.温度与pH对生物合成施氏矿物在酸性环境中溶解行为及对 Cu2+吸附效果的影响 [J]. 环境科学学报,2013,33(9):2445-2451.
[41]Jönsson J, Persson P, Sjöberg S, et al. Schwertmannite precipitated from acid mine drainage: phase transformation,sulfate release and surface properties [J]. Applied Geochemistry,2005,20:179-191.
[42]王长秋,马生凤,鲁安怀.黄钾铁矾类矿物沉淀去除 Cr(VI)的初步研究 [J]. 矿物岩石地球化学通报, 2006,25(4):335-338.
[43]Bigham J M, Carlson L, Murad E, et al. Schwertmannite, a new iron oxyhydroxysulfate from Pyhasalmi, Finland, and other localities [J]. Acta Archaeologica, 1994,80(393):190-192.
[44]Bai S Y, Xu Z H, Wang M, et al. Both initial concentrations of Fe(II) and monovalent cations jointly determine the formation of biogenic iron hydroxysulfate precipitates in acidic sulfate-rich environments [J]. Materials Sciences and Engineering C, 2012,32(8):2323-2329.
[45]Kedar N G, Katsutoshi I. Adsorptive separation of arsenate and arsenite anions from aqueous medium byusing orange waste [J].Water Research, 2003,37:4945-4953.
[46]廖岳华.施氏矿物的生物合成及去除水中砷的效果与机理研究[D]. 南京:南京农业大学, 2008.
[47]Regenspurg S, Peiffer S. Arsenate and chromate incorporation in schwertmannite [J]. Applied Geochemistry, 2005,20:1226-1239.
[48]Duquesne K, Lebrun S. Immobilization of arsensite and ferric iron by Acidithiobacillus ferrooxidans and its relevance to acid mine drainage [J]. Applied and Environmental Microbiology,2003,69(10):6165-6173.
[49]Jain A, Raven K P, Loeppert R H. Arsenite and Arsenate adsorption on ferrihydrite: surface charge reduction and net OH-release stoichiometry [J]. Environmental Science &Technology, 1999,33:1179-1184.
[50]Šubrt J, Boháček J, Štengl V, et al. Uniform particles with a large surface area formed by hydrolysis of Fe2(SO4)3with urea [J].Materials Research Bulletin, 1999,34(6):905-914.
[51]孙红福,赵峰华,丛志远,等.在我国发现的 Schwertmannite矿物及其特征 [J]. 矿物学报, 2006,26(1):38-42.

