猪圆环病毒Ⅱ型 (PCV2)分离培养与鉴定
李思佳 张鹤
(1,北京市第一七一中学 100013;2,中国科学院微生物研究所 100080)
2013年3月,黄浦江松江段水域发生漂浮死猪事件,上海市动物疫病预防控制中心现场采集了死猪内脏样品进行检测,从一份样品中检出猪圆环病毒。我国自从2000年郎洪武首次报道检测出PCV2抗原以来,浙江、北京、四川、黑龙江等省也报道有PCV2的感染[1]。
猪圆环病毒 (Porcine Circovirus,PCV)是迄今发现的最小的动物病毒之一。现已知PCV有两个血清型,猪圆环病毒I型 (PCV1)和Ⅱ型 (PCV2)。PCV1为非致病性病毒,PCV2为致病性病毒,本实验对象为PCV2。PCV2与猪群中发生的多种疾病相关,其可引起奶仔猪多系统衰竭综合征 (PMWS)、猪皮炎与肾病综合征 (PDNS)、猪呼吸道疾病综合征 (RDC)、猪先天性振颤等疾病[1]。目前,猪圆环病毒病及其相关性疾病在我国猪病中所占的主导地位愈发明显。因PCV2具有免疫抑制特性,从而使感染猪不能对其他疫苗或病原体产生有效的免疫应答,对其他疾病的易感性增强,易诱发混合感染,导致症状更为复杂。为减少猪圆环病毒Ⅱ型 (PCV2)的发生,降低养殖户经济损失,对PCV2的研究尤为重要。
1 材料
实验材料:细胞培养液 (90%DMEM+10%胎牛血清+0.1%抗生素)、无血清培养液 (100%DMEM)、PBS缓冲液(1LH2O: 8gNaC1+0.2gKC1+3.58gNa2HPO4·12H2O+0.24gKH2PO4)、病猪的肺脏组织、胰酶、DNA提取盒、5%CO2培养箱、电泳仪,PCR扩增仪
2 PCV2病毒
PCV2病毒是国际病毒分类委员会 (ICTV)第六次分类学术报告新增的圆环病毒科 (Circoviridae),圆环病毒属 (Circovirus)的成员,PCV2是圆环病毒属的代表种,是目前发现的最小的脊椎动物病毒[1]。PCV是己知的能在哺乳动物细胞中进行自我复制的最小病毒,是一种无囊膜、单链环状DNA病毒[2]。
3 PK-15细胞
3.1 PK-15细胞
PK-15细胞为猪肾上皮细胞,来源于猪肾,该细胞对多种病毒比较敏感,如PCV、猪细小病毒 (PPV)、猪瘟病毒(CSFV) 等。
PK-15细胞系是体外培养PCV2的良好宿主细胞,把PCV2接种到没有污染的单层PK-15细胞上可以获得良好的病毒增殖[1]。病毒在细胞中的复制需依赖细胞生长周期S期的细胞表达蛋白,同时组织细胞的增殖为PCV2复制及扩散提供最佳条件,病毒的体外增殖实验中,只有当细胞已经过有丝分裂期后病毒才开始复制。病毒在感染PCV的PK-15细胞内主要以胞浆内包涵体形式存在,少数感染细胞内还可观察到核内包涵体[3]。
3.2 PK-15细胞传代培养
提前15~20min在37℃温水中加热细胞培养液、PBS缓冲液、胰酶;点燃酒精灯;从37℃5%CO2培养箱中拿出已培养48h PK-15细胞的培养皿,弃掉原有的培养液;培养皿中加入5m1PBS,稍微摇动,弃掉液体;再加入5m1胰酶,放入37℃5%CO2培养箱中3min,弃掉胰酶,再放入37℃5%CO2培养箱中2~3min,拿出并轻拍皿沿 (观察PK-15细胞掉落情况);加6m1培养液,用吸管轻轻吹打并吹散细胞,分为3份,取一份放入新培养皿 (已提前放入8m1培养液)中培养,放入37℃5%CO2培养箱继续培养48h。
4 PCV2病毒PCR检测
4.1 提取病料的DNA
猪肺脏组织先打碎后研磨成匀浆,加入生理盐水,制成组织悬液,离心,取上清液进行DNA提取。
(1)上清液中加入 20μ1Proteinase K溶液,混匀,加200μ1缓冲液GB,充分颠倒混匀,70℃放置10min,溶液应变清亮,简短离心以去除管盖内壁的水珠。
(2)加入200μ1无水乙醇,充分振荡混匀15s,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠。
(3)将上一步所得溶液和絮状沉淀都加入一个吸附柱CB3中 (吸附柱CB3放入收集管中),12000r/min离心30s,倒掉收集管中的废液,将吸附柱CB3放入收集管中。
(4)向吸附柱CB3中加入500μ1缓冲液GD,12000r/min离心30s,倒掉废液,将吸附柱CB3放入收集管中。
(5)向吸附柱CB3中加入600μ1漂洗液PW,12000r/min离心30s,倒掉废液,将吸附柱CB3放入收集管中 (此操作重复2遍)。
(6)将吸附柱 CB3放回收集管中,12000r/min离心2min,倒掉废液,将吸附柱CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
(7)将吸附柱CB3转入一个干净的离心管中,向吸附膜中间部位悬空滴加60μ1洗脱缓冲液TE,室温放置2~5min,12000r/min离心2min,将溶液收集到离心管中。
4.2 PCR检测
(1)PCV2型病毒检测引物:Forward:5’-AGTGAGCG GGAAAATGCAGA-3’; Reverse: 5’ -TCCTCCGTGGATTGTT CTGT-3’,此引物可以扩增出PCV2ORF1(开放式阅读框,Open Reading Frame)中大小为391bp的DNA片段。
(2)检测3组样品,分别为病毒组、对照组和水。
20μ1PCR扩增反应体系:

(3)PCR扩增程序如下:
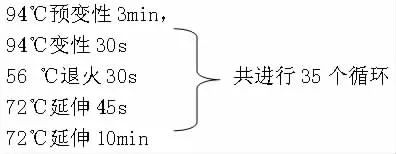
反应完毕后,用1%琼脂糖凝胶电泳检测PCR产物,根据扩增片段大小,判定病毒感染情况。
5 PCV2病毒分离与鉴定
5.1 PK-15细胞传代
按照3.2进行PK-15细胞传代。
5.2 病毒接种
将PCR检测结果为阳性的病料研磨后冻融3次,上清用0.22μm的细菌滤器过滤除菌。将已生长24h的PK-15细胞弃去原有培养液,加入5m1无血清培养液,将培养液与病毒滤液按体积比25∶1的比例进行混合,即5m1无血清培养液中加入200μ1病毒滤液,于37℃条件下培养2h,期间每半小时摇一次培养皿,帮助病毒附着到细胞上。2h后再加入无血清生长液继续培养72h。培养过程中同时设立不接毒的细胞培养物作为阴性对照。
5.3 收集病毒
将接毒并培养72h后的PK-15细胞在-80℃反复冻融2次,20000r/min离心10min取上清液。
5.4 病毒传代
5.4.1 传代步骤
(1)用0.22μm细菌过滤器过滤病毒,放入新的离心管。
(2)吸出两个PK-15细胞培养皿中的培养液,用PBS清洗一遍。
(3)两个PK-15细胞培养皿中各加5m1无血清培养液,取200μL病毒滤液接入其中一皿中,晃匀,放入37℃ 5%CO2培养箱中,每30min拿出摇一次。
(4)接入病毒2h后,弃掉培养液,重新加10m1无血清培养液,无病毒则直接再加5m1无血清培养液,放入37℃5%CO2培养箱中。
72h后,取第一代培养物 (F1),再接种处于分裂期的PK-15细胞,同时设不接种病毒的PK-15细胞作阴性空白对照,连传3代。传代过程中PCR检测PK-15细胞中PCV2增殖情况。
5.4.2 出现的问题及改进措施
实验过程中,由于 (3)中接入的病毒滤液体积过少,导致病毒增殖较少,因此将 (3)中的200μ1病毒滤液改为500μ1病毒滤液。
5.5 PCV2病毒DNA的提取
按照步骤4.1.2提取PCV2病毒DNA。
5.6 PCR鉴定
以提取病毒DNA为模板,用PCV2型特异性检测引物Forword/Reverse进行PCR鉴定。病毒通过电泳图像显示病原是否为阳性。
5.7 基因序列测定
PCV2 ORF1基因序列测定由北京诺赛基因组研究中心有限公司完成。结合相关文献资料,分析PCV2 ORF1基因的序列及所编码的核苷酸,与己发表的基因序列比较同源性。
6 病毒提纯
将收获的病毒培养液在12000g离心30min,除去细胞碎片和较大的杂质。将上清液加入盛有300g/L蔗糖垫的离心管中,150000g离心3h;弃去上清液,用0.01mmo1/L pH8.0的TE缓冲液重悬并收集病毒。
7 实验结果
7.1 PK-15细胞的培养结果
经过多次传代的PK-15细胞生长状况良好,增殖率高,参见图1。

图1 PK-15
7.2 接种病毒体积对于病毒增殖的影响
在病毒传代时,最初无血清培养液与病毒滤液的体积比为25∶1,即5m1无血清培养液中接入200μ1病毒滤液,结果病毒增殖情况不理想。后改为无血清培养液与病毒滤液体积比为10∶1,即5m1无血清培养液中接入 500μ1病毒滤液,改变病毒滤液接入量后病毒增殖情况良好。
7.3 PCV2型特异性DNA片段的PCR检测结果
采用病料中提取的DNA作为模板,用Forward,Reverse引物进行PCR扩增,经1%琼脂糖凝胶电泳检查扩增的PCR产物,结果获得一条长度为417bp的电泳条带,扩增产物结果与预期片段大小相符,说明病料组织中含有PCV2,参见图2。

7.4 病毒分离培养结果
将PCR检测阳性的组织匀浆接种于PK-15细胞,进行3次传代。结果表明,F1~F3病毒用PCV2型特异性引物均可扩增获得PCV2的特异性目的片段,说明病毒已在PK-15细胞中增殖。病毒通过电泳图像均显示阳性,见图3,说明病毒培养成功。

图3 病毒电泳条带结果


7.5 序列测定与分析结果
7.5.1 PCV2毒株ORF1基因的测序结果
PCV2毒株ORF1基因的测序结果见下。经测序:PCV2的ORF1基因序列为391个碱基组成,大小和预期结果一致。
7.5.2 PCV2毒株核苷酸序列比较结果 (相同核苷酸用 “……”表示)。
结果显示,PCV2的ORF1基因核苷酸序列和国内己发表毒株ORF1基因相比较,核苷酸序列同源性为94.6%。
8 结论
PK-15细胞是体外培养PCV2病毒的敏感细胞,把PCV2接种到无PCV感染的PK-15细胞上能获得最好的病毒增殖,但不产生细胞病变。在病毒传代时通过改变无血
清培养液与病毒滤液的比例,得出无血清培养液与病毒滤液体积比为10∶1时病毒增殖情况较好。
将PCR检测呈阳性的病料接种到PK-15细胞连续传代,接种后1~3代细胞培养物用PCV2型特异性引物检测结果呈阳性,说明PCV2病毒己在PK-15细胞中增殖。最后将病毒纯化分离,进行测序鉴定,从而确定其为PCV2分离株。
本实验根据PCV2的培养特性,使其在适应细胞PK-15上成功繁殖并传代,达到从原始病料中分离病毒的目的。
9 研究前景
PCV2感染和引起的疾病己成为全球养猪生产中的大问题。目前,各国对PCV2感染没有有效的防治方法,普遍采取的措施是控制继发感染,在做好猪场的卫生消毒工作、降低或避免应激因素、提高饲养管理水平和断奶仔猪营养水平的基础上,重点控制继发感染,最大限度地降低死亡率,减少经济损失。本实验通过PK-15细胞分离鉴定了一株PCV2病毒株,用此病毒株再进行数次传代培养,不断弱化其毒性,可作为活疫苗使用,为以后开发PCV2的弱毒活疫苗奠定基础。
[1]丁婷婷.猪圆环病毒2型的分离鉴定及其人工感染试验[D].扬州:扬州大学,2012.
[2]卢权威,郭官鹏,崔保安,等.2株猪圆环病毒2型的分离鉴定及全基因组序列分析[J].西北农林科技大学学报(自然科学版),2013,9(3):44-48.
[3]王永祥.猪圆环病毒2型山东株的分离鉴定及其DRF2基因的克隆与表达[D],济南:山东农业大学,2008.

