解磷微生物修复土壤重金属污染研究进展
李 敏,滕泽栋,朱 静,宋明阳
北京林业大学环境科学与工程学院,水体污染源控制技术北京市重点实验室,北京 100083
随着社会经济快速发展,我国土壤污染问题日益凸显,尤其是土壤重金属污染问题亟待解决。土壤中的重金属污染主要来自矿物母质的风化和人类生产活动中废水、废气、废渣的直接排放,具有普遍性、隐蔽性、表聚性、不可逆性等特点。首次全国土壤污染状况调查(2005年4月—2013年12月)结果显示,Cd、Hg、As、Cu、Pb、Cr、Zn、Ni 8种重金属污染点位超标率分别为7.0%、1.6%、2.7%、2.1%、1.5%、1.1%、0.9%、4.8%,严重影响了我国土壤生态环境和粮食生产安全[1]。因此,重金属污染已经成为目前最为严峻的环境问题之一,如何治理已受到极大关注,成为科学研究的热点和难点。
植物修复重金属污染土壤是一种非常有前途、生态良性的方法,近年来得到了广泛关注。但是,超累积植物通常都生物量低、生长缓慢,尤其是当重金属浓度过高时,植物的生理活动受到阻碍,重金属抗性机制被削弱,植物易受病原体攻击,大大降低了修复效率[2]。解磷微生物作为土壤微生物的重要组成部分,能够依靠自身的代谢产物(有机酸、磷酸酶)或通过与其他生物的协同作用,将土壤中难溶态磷(如铁磷、钙磷、中稳定性有机磷、高稳定性有机磷等)转化为可供植物吸收利用的磷,不仅可大幅提高土壤中磷的利用率,改善植物磷营养状态,促进植物生长,而且可以改变重金属的形态,提高修复效率。
关于解磷微生物修复土壤重金属污染的研究主要有:重金属污染土壤中解磷微生物的分离、筛选、鉴定,解磷微生物对土壤重金属污染的修复能力、修复机制以及强化技术措施等。但重金属压力下解磷微生物的解磷功能和重金属抗性功能基因表达差异,解磷微生物对重金属形态的影响规律及其对重金属固定/活化机理等方面的研究鲜有报道,而这些正是制约重金属污染土壤修复的重要因素。因此本文即从这几个方面对目前的研究进行了总结和展望,为提高土壤重金属污染修复效率、改善我国土壤环境质量、保障土壤生态安全提供理论意义和实际价值。
1 解磷微生物概况
解磷微生物的种类多而且复杂,根据微生物的种类可以分为解磷细菌、解磷真菌、解磷放线菌。土壤中的解磷微生物群落中,解磷细菌占1%—50%,而解磷真菌仅占0.1%—0.5%。其中常见的解磷微生物如表1所示:
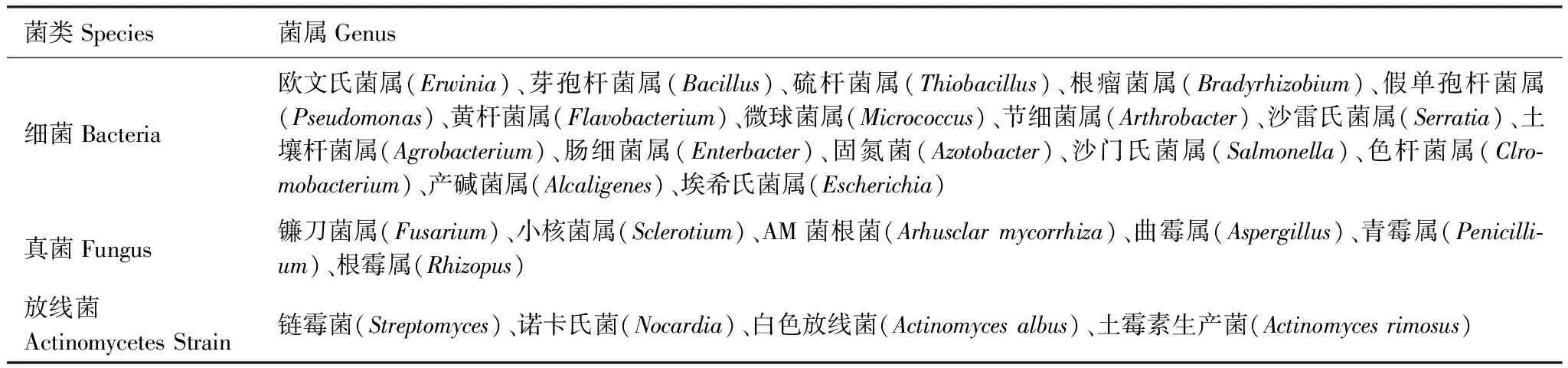
表1 常见的解磷微生物
有学者根据解磷微生物分解底物的不同将它们划分为能够溶解有机磷的有机磷微生物和能够溶解无机磷的无机磷微生物[3],但是由于某些菌株既可以分解无机磷也可以分解有机磷,所以实际操作过程中很难区分。
迄今为止,见诸报道的解磷微生物已有39个属,89种以及数以万计的解磷菌株[4- 5]。其中假单胞菌属作为植物促生菌已经被广泛的研究[6],这是已知的能够合成激素,作为生物防治剂和解磷菌剂的菌属[7]。Azziz等[8]从免耕土壤中分离出12株解磷菌株,进行TP-RAPD指纹识别后发现,其中10株为假单胞菌属,1株为洋葱伯克霍尔德菌,剩余1株为不动杆菌属。由此可见,解磷微生物的种类繁多,这为土壤磷素转化提供了足够的菌源。
2 解磷微生物对土壤重金属污染的修复能力
2.1 解磷微生物的解磷能力
解磷微生物的解磷能力与其对重金属的修复效果有直接的联系,解磷能力越强,其释放磷酸盐的能力就越强。研究表明,解磷微生物释放的磷素,既可以降低土壤中重金属活性,避免因外界使用的含磷物质而造成污染;还可以促进植物生长,有利于植物修复重金属污染[9]。解磷圈直径(D)与菌落生长直径(d)的比值可以表征解磷菌的相对溶磷能力。陈倩等[10]从山西矿区土壤中分离的菌株Y14 经过鉴定确认为泛菌属,其 D/d 值和解磷率均达到较高值,无机磷与有机磷平板的D/d值分别为3.28与1.59,降解磷酸钙、磷矿粉、卵磷脂的解磷率分别为12.61%、1.21%、3.07%。但单纯从透明圈直径与菌落直径的比值来判断菌株解磷能力并不可靠,忽略菌体自身吸收的有效磷会低估某些解磷菌的解磷能力,单纯从培养液中测定有效磷的含量也不能准确反映菌体的解磷能力。研究表明,赵小蓉等[11]采用熏蒸、消煮方法测定砂培过程中微生物分解出来的磷,这种测定方法能准确测定微生物解磷能力。田江等[12]从铅锌矿表层土壤中分离的嗜麦芽寡养单胞菌和唐菖蒲伯克霍尔德菌,解磷量最高分别达到402.9 mg/L和589.9 mg/L,解磷率分别达到19.7%和28.8%。Park等[13]研究表明,阴沟肠杆菌可以溶解加入的6.46 mmol/L磷矿石的17.5%,表现出溶磷能力和对铅的抗性。不同解磷菌种解磷能力差异较大,所以筛选高效解磷菌株就显得尤为重要。
2.2 解磷微生物的重金属抗性
高浓度的重金属是土壤重金属污染修复过程中最重要的限制性因素,因此,筛选具有金属抗性的微生物极为重要。通常解磷微生物对重金属的耐受能力与菌株的分离环境有关。如田江等[12]从铅锌矿区表层土壤中筛选到的两株解磷细菌,除了具有很强的解磷能力之外,对于重金属Pb2+、Zn2+和Cr2+的抗性也非常强,抗性浓度最高达到了2000 mg/L。Jiang等[14]从重金属污染土壤中分离的具有解磷能力的伯克氏菌J62,对重金属的最大耐受浓度为分别为Cd(2000 mg/L)、 Pb(1000 mg/L)、Cu(100mg/L)、Zn(400 mg/L)、Ni(50 mg/L)、Cr(20 mg/L),由此可见菌株J62具有很强的铅、镉耐性。因此,重金属污染地区是重金属抗性解磷微生物菌株的重要来源,从矿区分离的重金属耐受解磷微生物在重金属污染土壤修复方面具有很大应用潜力。通常植物根系土壤微生物含量很高[15],故可以从一些植物根系土壤中获得解磷菌。Misra等[16]从木犀属植物根际分离的6株解无机磷菌株,具有良好的溶磷特性,同时对高浓度的硫酸锌也表现出很强的耐性。
解磷微生物之所以具有金属抗性,是因为其金属抗性基因起作用。汞抗性基因是目前研究较深入的一类基因,包括汞还原酶基因MerA、有机汞裂解酶基因MerB以及其他转运系统基因MerT、MerP、MerC[17]。有解磷功能的无色杆菌和假单胞杆菌能使亚砷酸盐氧化成砷酸盐而降低砷的毒性[18]。微生物体内有控制砷毒性的功能基因ArsC,该基因可将As(Ⅴ)还原为毒性更强的As(Ⅲ),而ArsA和ArsB基因控制着As(Ⅲ)从细胞质中释放[19-20]。此外,丁香假单胞菌和大肠杆菌均含抗Cu基因CopA[21],芽孢杆菌含有抗Cd基因CadA,菌株可通过该基因编码的酶将镉转移出菌体外,从而达到解毒的作用[22],绿脓杆菌含有抗Zn基因Czr[23],产碱菌含抗重金属基因CzcD,其编码的蛋白质是离子泵出系统的一员,赋予宿主菌一定的Cd、Ni及Co抗性[24]。细菌的重金属抗性基因存在很高的多样性,不同的重金属有不同的抗性基因,同一种金属的抗性基因在不同的细菌中存在于不同的操纵子上[25]。文献中只是单纯的报道有关重金属抗性基因,或者解磷功能基因研究,但很少有把解磷微生物的重金属抗性基因和解磷功能基因联合起来研究,这将影响对解磷微生物修复重金属污染机理的深入理解。
2.3 环境因子对解磷微生物重金属修复能力的影响
土壤溶液中数量众多的根分泌物、营养物质、有机降解产物及微生物等,尤其是土壤性质如温度、pH、Eh、营养条件(P、碳水化合物和氨基酸)、重金属元素的浓度都会影响解磷微生物对土壤重金属的修复能力[26]。重金属污染区,溶磷细菌数量与综合污染指数呈正相关,污染区中有效磷含量影响溶磷微生物种群丰度[27],有机质可以激活土壤解磷微生物的代谢,同时也会影响重金属的生物可利用性[28]。pH值是影响磷酸铅沉淀形成的重要因素[13],同时也可以促进土壤中原生矿物重金属的风化溶解。芽孢杆菌通过分泌有机酸而降低土壤pH,增加溶解性磷的含量,能够固定大量的铅和锌[29]。土壤有效磷的含量增加,可以暂时促进土壤重金属的固定,降低高浓度重金属对解磷微生物的毒害作用。Cu胁迫下,从枝菌根真菌(AMF菌)可以降低土壤有机酸的总含量,尤其是草酸和丙二酸的含量,导致海州香薷根际pH值升高[30]。
3 解磷微生物修复土壤重金属污染的主要作用机制
3.1 解磷微生物对土壤重金属的转化作用
3.1.1 解磷微生物对土壤重金属的甲基化作用
某些解磷微生物能够把钴胺素转化为甲基钴胺素,在ATP及特定的还原剂存在的条件下,甲基钴胺素作为甲基供体,使金属离子与甲基结合而生成甲基汞、甲基砷、甲基铅。但是有些金属离子被甲基化后,其毒性反而增强,这是在微生物修复过程中要避免的[30]。假单胞菌属在金属及类金属离子的甲基化作用中具有重要贡献,他们能够使许多金属或类金属离子发生甲基化反应。合适的pH和Eh能使微生物对砷的甲基化速率最优[31]。
3.1.2 解磷微生物对土壤重金属的氧化还原作用
解磷微生物可以通过自身的代谢作用,改变重金属的价态,从而达到解毒的目的。研究表明,细菌可以在细胞外沉积铁和锰的氧化物或氢氧化物并可以调节Zn2+、Pb2+和其他金属的氧化还原反应[32]。Hg、Pb、Sn、Se、As等金属或类金属离子都能在微生物作用下通过氧化还原作用而失去毒性。芽孢杆菌PSB10有溶解无机磷的能力,可以在增强植物分泌激素,促进植物生长的同时降低重金属Cr的毒性[29]。在重金属污染的土壤中施用铜绿假单胞杆菌菌剂,鹰嘴豆的根、芽、种子对重金属Cr的吸收分别减少了36%、38%、40%[33]。解磷毕赤酵母P.farinoseFL7在 Ni(NO3)2或 Ni3(PO4)2污染土壤中均表现出解磷活性,并且能够将 Ni(NO3)2污染土壤中存在的大部分Ni2+转化为无效态Ni[34]。
3.2 解磷微生物对土壤重金属的溶解与螯合作用
3.2.1 解磷微生物对土壤重金属的溶解作用
解磷微生物对重金属的溶解主要是通过各种代谢活动直接或间接地进行的,其代谢作用能产生多种低分子量的有机酸,如甲酸、乙酸、丙酸、丁酸、柠檬酸、苹果酸、延胡索酸、琥珀酸和乳酸等[35]。这些有机酸在环境中解离成质子和低分子有机酸根,质子能引起土壤pH值以及氧化还原电位的变化,促进土壤中重金属原生矿物的风化溶解过程。研究表明,解磷微生物可以溶解生物难以利用的难溶态Ni[36]、Cu[37]、Zn[38],提高重金属生物有效性。将巨大芽孢杆菌(Bacillusmegaterium)用于Cd污染土壤,能够增加Cd 的流动性并提高其生物有效性,使植物提取率增加了2倍[39]。接种AM真菌可以降低盆栽土壤pH值,提高土壤中有效态铜的含量,促进植物对Cu的吸收[40]。通过对溶磷细菌溶解不同磷矿粉以及连续发酵磷矿粉的溶磷效果的研究发现,磷矿粉中的部分伴生性金属元素会随着磷的释放而溶出,其溶出的难易程度随伴生性金属元素在磷矿粉中的位置而不同[27]。
3.2.2 解磷微生物对土壤重金属的络合与螯合作用
细菌表面的羧基和磷酸盐基团可以与重金属离子配位生成内圈络合物[41],提高植物磷利用率的同时也提高了对Cu、Cd、Zn的吸收,其含量与土壤溶液中溶解性有机物呈正相关,因为形成了有机物金属络合物[42]。低分子有机酸根对重金属有很强的亲和力,能络合和螯合重金属阳离子而形成重金属有机结合体,在环境中,低分子有机酸根与固体颗粒之间形成对重金属离子的竞争结合,可见低分子有机酸的存在有利于重金属的迁移[43]。菌根真菌通过分泌柠檬酸和苹果酸螯合作用,以提高不溶性ZnO和Zn3(PO4)2中Zn释放[44]。铁载体能与重金属离子结合,形成金属-铁载体螯合物,提高植物根际环境中重金属的活性,增加植物对重金属的吸收和累积[45]。肠杆菌属的铁载体高产突变解磷微生物NBRI K28 SD1不仅可以增加植物的生物量,而且加强了芥菜对Ni、Cr的吸收[46]。
3.3 解磷微生物对土壤重金属的吸附与沉淀作用
3.3.1 解磷微生物对土壤重金属的吸附与累积作用
重金属污染土壤中的微生物通过各种机制来抵抗重金属的危害,微生物对重金属吸附可分为三类:胞外吸附,表面吸附和胞内吸收[47]。细胞壁是细菌个体与重金属接触最早的部分,富含羧基阴离子和磷酸阴离子,使得细菌表面具有阴离子的性质,很容易与金属发生反应,因而金属很容易结合到细菌的表面[48]。芽孢杆菌和铜绿假单胞杆菌在修复土壤Pb污染的过程中,可以通过生物的吸附作用,与细胞表面的官能团或细胞壁上的酸性物质相互作用形成铅化合物,降低Pb的移动性[49]。生物积累主要依赖微生物的新陈代谢[50],研究表明,在重金属培养基中培养的蜡状芽孢杆菌和枯草芽孢杆菌细胞内的重金属浓度远高于培养基中的浓度[51]。芽孢杆菌(Bacillus)对Cd的富集可以达到其生物量(干重)的21.4%,对Pb的富集可高达61%[52]。
3.3.2 解磷微生物对土壤重金属的沉淀作用
解磷微生物将土壤矿物磷或有机磷中的磷酸根释放,与重金属结合形成磷酸盐沉淀,降低重金属在土壤环境中的移动性和生物可利用性,起到固定或钝化的作用[53]。具有解磷活性的阴沟肠杆菌(Enterobactercloacae)能够溶解土壤中的磷酸盐并形成磷酸铅复合物从而降低土壤中Pb的流动性[13]。解磷菌对Pb污染土壤修复不仅使土壤中游离态的Pb得到了固定,从而有效抑制了植物对重金属Pb的吸收[54]。接种G.mosseae菌,抑制了Cd、Zn从地下部分向地上部分的转移,可以降低锌对植物的毒害作用,同时加强Zn在土壤中的固定作用[40]。
革兰氏阴性细菌Citrobacter通过磷酸酶分泌大量磷酸氢根离子在细菌表面与重金属形成矿物[55]。柠檬酸杆菌等能分泌酸性磷酸酶,催化2-磷酸甘油水解,释放无机磷酸盐,无机磷酸盐在细胞表面大量积累,与细胞表面的金属发生沉淀反应,形成金属磷酸盐沉淀。解磷微生物对重金属的沉淀主要是释放的磷酸盐起作用,伴随着微生物自身的富集作用,使土壤中的重金属固定在土壤中,而不被农作物吸收。
3.4 解磷微生物对重金属超累积植物的促生作用
解磷微生物在土壤和植物根际大量存在,具有多重植物促生作用,如图1所示。重金属污染条件下,由于应对环境胁迫的需要,解磷微生物更多提供植物吸收生存所需的矿质元素,改善宿主植物N、P等矿质营养状况,提高营养元素(P、N、S等)与重金属元素(As、Cd、Pb等)含量之比,被认为有助于增强重金属超累积植物耐受重金属的能力,提高植物对重金属的累积量。通过接种AMF菌增加植物组织中的磷含量,使得植物依赖ATP提取Mn或形成低溶解性的P-Mn化合物,从而降低Mn对植物组织的毒害作用[56]。盆栽试验研究发现,接种AMF显著提高万寿菊对Cd的吸收,增加Cd向地上部的转运;在各种Cd处理水平下,万寿菊地上部分的吸收量都远远高于根系的吸收量,表现出促进植物提取的应用潜力[57]。
铁载体能为重金属胁迫下的植物提供营养物质(尤其是铁元素),缓解胁迫产生的毒害,促进植物生长[58-59]。研究表明,解磷微生物能够增加植物对K、Ca、Mg、Fe、Zn等营养元素的吸收。Cu、Zn污染的土壤中接种AMF可以显著的促进咖啡苗的生长,可能是由于根外菌丝的作用增加了根系表面土壤中可溶性磷的含量[60]。许多植物根部土壤中的解磷微生物能够分泌生长素(IAA),增加植物生长素含量,从而促进植物生长[61]。目前具有产铁载体能力的微生物强化植物重金属修复的研究仍处于初步阶段,铁载体产生菌如何影响植物获取重金属的确切机制仍不清楚。
除了上述植物促生作用,解磷微生物产生的细胞壁溶解酶、抗生素等能够抵抗植物病毒,减缓病毒对植物的侵害[62-63]。解磷微生物还可以产生抗病原菌代谢产物、1-氨基环丙烷- 1-羧酸(ACC)脱氨酶等物质,增加植物抗病能力,可以降低乙烯含量[46]提高植物对重金属污染的修复效率。从Cd污染土壤中分离的抗镉性菌株铜绿假单胞菌MKRh3,不但具有溶磷特性,而且还可以产生铁载体,提高1-氨基环丙烷羧酸脱氨酶的活性,促进植物的生长[64]。具有汞抗性的荧光假单胞菌表现出了较高的溶磷能力,并且可以产生吲哚乙酸(IAA)和铁载体。从镍超富集植物庭荠属植物(Alyssumserpyllifolium)根茎叶组织内部分离的内生细菌对重金属镍的耐受性高达750—1000 mg/kg,并具有分泌ACC脱氨酶、铁载体、植物激素以及溶磷等特性,从而显著地促进植物对镍的提取和吸收[65]。
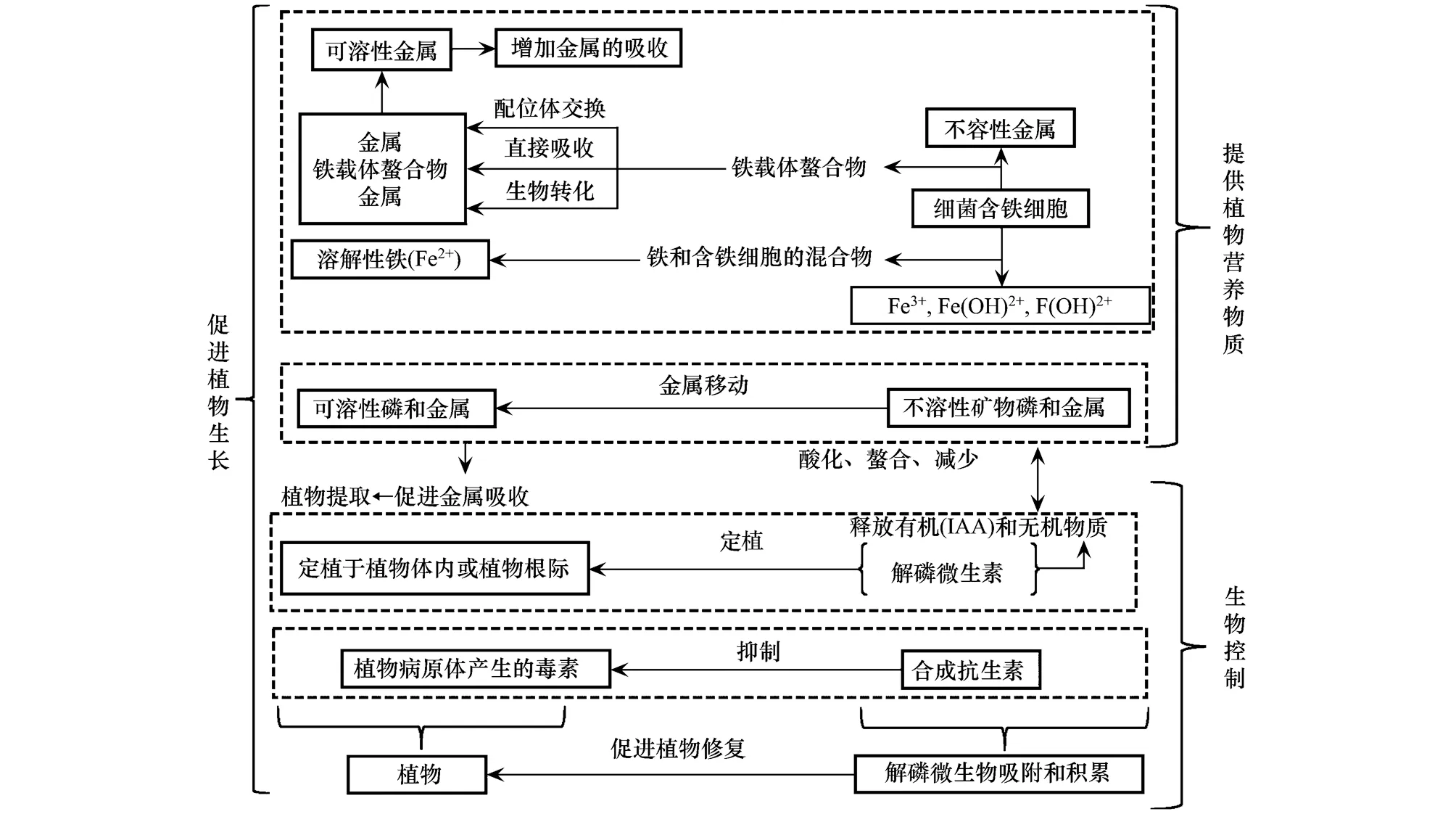
图1 解磷微生物对重金属超累积植物的促生作用Fig.1 Growth promoting effect of phosphate solubilizing microorganisms on heavy metal accumulation in plants
3.5 解磷微生物对土壤重金属的固定/活化双向作用及修复措施
近年来,具有重金属解毒能力和促进植物生长功能的解磷微生物在土壤重金属污染修复中被应用和探索[32],如表2所示。

表2 重金属污染土壤中常见的解磷微生物及其修复重金属种类
综上,不同种类的解磷微生物对不同重金属作用机制不同,但综合起来可以分为两个方面,首先,解磷微生物可将土壤难溶矿物磷或有机磷中的磷酸根释放,与重金属结合形成磷酸盐沉淀,同时通过生物吸附、积累等作用,降低重金属在土壤中的移动性和生物可利用性,对重金属起到固定或钝化的作用。其次,解磷微生物也可以通过分泌有机酸、铁载体、吲哚乙酸、金属还原酶、HCN等作用,与重金属形成络合物或改变重金属的形态和价态,提高重金属生物有效性和植物抗病性,从而增加植物对重金属吸收。其作用机理如图2所示。

图2 解磷微生物修复土壤重金属污染作用机理Fig.2 Mechanisms of phosphate solubilizing microorganisms in remediation of heavy metal contaminated soils
因此,解磷微生物对土壤中的重金属起到双向调节的作用,相对应的就有两种修复机制:①生物固定,包括微生物本身对重金属的生物沉淀、吸附、细胞内累积以及促进重金属的植物固定;②生物活化,通过提高重金属的生物有效性,促进重金属的转移并积累在植物组织中。但是生物固定仅改变了重金属污染物在土壤中的赋存形式,并不能减少重金属总量,而且稳定剂联合使用会对土壤理化性质、微生物群落带来一定的负面效应。因此,解磷微生物与植物的联合修复是一种被公众认可的环境友好型、生态可持续的修复方式,具有良好的应用前景。
4 存在的问题及展望
综上所述,土壤重金属污染修复依然是一个世界性问题,解磷微生物在土壤重金属污染修复中发挥着重大作用,但目前研究还存在很多不足。
(1)解磷微生物增加和降低重金属活性的研究结论都有,很少从微观层面研究解磷微生物及其胞外代谢产物与重金属的作用方式。重金属浓度、土壤环境因子、解磷微生物代谢产物、相关功能基因等对解磷微生物固定或活化重金属的影响及其双向作用机制尚不明确,严重阻碍了重金属修复效率的提高。
(2)目前,关于解磷微生物参与化学钝化修复方面的研究不多。解磷微生物有可能会减弱磷酸盐原位固定重金属长时间尺度的修复效果,从而质疑解磷微生物在长期化学钝化修复重金属污染方面的应用潜力,因此,应加强研究不同土壤环境条件下,解磷微生物对重金属钝化的应用效果和修复机理。
(3)缺乏对解磷微生物代谢产物、解磷功能及重金属抗性等功能基因的深入研究,没有从宏基因组的层面研究重金属压力下,解磷功能基因的多样性及对解磷能力的影响,关于解磷功能基因在修复重金属中的调控策略则尚未涉及。
因此,针对不同区域的重金属污染状况,研究施加解磷菌株后土壤微生物群落的变化情况,解磷微生物与植物的协同作用对土著微生物菌群的多样性和结构的影响,分析植物根际不同形态重金属含量,结合重金属抗性基因的变化,从代谢产物和功能基因角度阐明解磷微生物对土壤重金属固定或活化的双向作用机制,可为改善我国土壤环境质量、保障土壤生态安全提供有力支撑。
参考文献(References):
[1] 王厚杰. 马关县矿区土壤重金属污染及植物修复特性的研究——以小白河流域为例[D]. 成都: 成都理工大学, 2012.
[2] Ahemad M. Phosphate-solubilizing bacteria-assisted phytoremediation of metalliferous soils: a review. 3 Biotech, 2015, 5(2): 111- 121.
[3] 赵小蓉, 林启美, 孙焱鑫, 张有山, 张美庆. 玉米根际与非根际解磷细菌的分布特点. 生态学杂志, 2001, 20(6): 62- 64.
[4] Mander C, Wakelin S, Young S, Condron L, O′Callaghan M. Incidence and diversity of phosphate-solubilising bacteria are linked to phosphorus status in grassland soils. Soil Biology and Biochemistry, 2012, 44(1): 93- 101.
[5] Behera B C, Singdevsachan S K, Mishra R R, Dutta S K, Thatoi H N. Diversity, mechanism and biotechnology of phosphate solubilising microorganism in mangrove——a review. Biocatalysis and Agricultural Biotechnology, 2014, 3(2): 97- 110.
[6] Rivas R, Trujillo M E, Sánchez M, Mateos P F, Martínez-Molina E, Velázquez E.Microbacteriumulmisp. nov., a xylanolytic, phosphate-solubilizing bacterium isolated from sawdust ofUlmusnigra. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(Pt 2): 513- 517.
[7] Mustapha M U, Halimoon N. Microorganisms and biosorption of heavy metals in the environment-a review paper. Microbial & Biochemical Technology, 2015, 7(5): 253- 256.
[8] Azziz G, Bajsa N, Haghjou T, Taulé C, Valverde, Igual J M, Arias A. Abundance, diversity and prospecting of culturable phosphate solubilizing bacteria on soils under crop-pasture rotations in a no-tillage regime in Uruguay. Applied Soil Ecology, 2012, 61: 320- 326.
[9] He L Y, Zhang Y F, Ma H Y, Su L N, Chen Z J, Wang Q Y, Qian M, Sheng X F. Characterization of copper-resistant bacteria and assessment of bacterial communities in rhizosphere soils of copper-tolerant plants. Applied Soil Ecology, 2010, 44(1): 49- 55.
[10] 陈倩, 刘善江, 白杨, 李亚星, 郜春花, 张强, 李建华. 山西矿区复垦土壤中解磷细菌的筛选及鉴定. 植物营养与肥料学报, 2014, 20(6): 1505- 1516.
[11] 赵小蓉, 林启美, 孙焱鑫, 张有山, 王幼姗. 小麦根际与非根际解磷细菌的分布. 华北农学报, 2001, 16(1): 111- 115.
[12] 田江, 彭霞薇, 李霞, 孙雅君, 冯红梅, 江泽平. 重金属抗性解磷细菌的磷溶解特性研究. 环境科学, 2014, 35(6): 2334- 2340.
[13] Park J H, Bolan N, Megharaj M, Naidu R. Concomitant rock phosphate dissolution and lead immobilization by phosphate solubilizing bacteria(Enterobactersp.). Journal of Environmental Management, 2011, 92(4): 1115- 1120.
[14] Jiang C Y, Sheng X F, Qian M, Wang Q Y. Isolation and characterization of a heavy metal-resistantBurkholderiasp. from heavy metal-contaminated paddy field soil and its potential in promoting plant growth and heavy metal accumulation in metal-polluted soil. Chemosphere, 2008, 72(2): 157- 164.
[15] Bokhorst S, Kardol P, Bellingham P J, Kooyman R M, Richardson S J, Schmidt S, Wardle D A. Responses of communities of soil organisms and plants to soil aging at two contrasting long-term chronosequences. Soil Biology and Biochemistry, 2017, 106: 69- 79.
[16] Misra N, Gupta G, Jha P N. Assessment of mineral phosphate-solubilizing properties and molecular characterization of zinc-tolerant bacteria. Journal of Basic Microbiology, 2012, 52(5): 549- 558.
[17] 周向军. 重金属超富集植物环境修复技术研究进展. 安徽农业科学, 2010, 38(3): 1408- 1410.
[18] 杨伯杰, 林创发. 土壤重金属污染现状及其修复技术方法概述. 能源与环境, 2015,(1): 60- 61.
[19] Vaxevanidou K, Christou C, Kremmydas G F, Georgakopoulos D G, Papassiopi N. Role of indigenous arsenate and iron(III) respiring microorganisms in controlling the mobilization of arsenic in a contaminated soil sample. Bulletin of Environmental Contamination and Toxicology, 2015, 94(3): 282- 288.
[20] Huang J H. Impact of microorganisms on arsenic biogeochemistry: a review. Water, Air, & Soil Pollution, 2014, 225(2): 1848- 1848.
[21] 张真真. 重金属对嗜酸氧化亚铁硫杆菌菌株活性及金属抗性相关基因转录表达的影响[D]. 长沙: 中南大学, 2014.
[22] 曾艳, 孙建光, 王敏, 陈强, 高俊莲. 一株高抗镉细菌KCd1的分离鉴定及其抗性基因初步研究. 四川农业大学学报, 2010, 28(1): 46- 51.
[23] 郝秀丽. 刺槐内共生细菌的重金属抗性机制及其与植物的联合修复作用[D]. 咸阳: 西北农林科技大学, 2013.
[24] 毛娟. 产碱杆菌CzcD基因的克隆、表达以及功能的初步研究[D]. 兰州: 兰州大学, 2008.
[25] 曾远, 罗立强. 土壤中特异性微生物与重金属相互作用机制与应用研究进展. 岩矿测试, 2017, 36(3): 209- 221.
[26] Mani D, Kumar C. Biotechnological advances in bioremediation of heavy metals contaminated ecosystems: an overview with special reference to phytoremediation. International Journal of Environmental Science and Technology, 2014, 11(3): 843- 872.
[27] 易艳梅. 细菌溶磷作用及其对磷矿粉重金属释放和小麦盐胁迫的缓解[D]. 南京: 南京农业大学, 2007.
[28] Vassileva M, Serrano M, Bravo V, Jurado E, Nikolaeva I, Martos V, Vassilev N. Multifunctional properties of phosphate-solubilizing microorganisms grown on agro-industrial wastes in fermentation and soil conditions. Applied Microbiology and Biotechnology, 2010, 85(5): 1287- 1299.
[29] Wani P A, Khan M S.Bacillusspecies enhance growth parameters of chickpea(CicerarietinumL.) in chromium stressed soils. Food and Chemical Toxicology, 2010, 48(11): 3262- 3267.
[30] 曾加会, 李元媛, 阮迪申, 晁元卿, 仇荣亮, 杨燕花, 王诗忠. 植物根际促生菌及丛枝菌根真菌协助植物修复重金属污染土壤的机制. 微生物学通报, 2017, 44(5): 1214- 1221.
[31] Bentley R, Chasteen T G. Microbial methylation of metalloids: arsenic, antimony, and bismuth. Microbiology and Molecular Biology Reviews, 2002, 66(2): 250- 271.
[32] Wu S C, Luo Y M, Cheung K C, Wong M H. Influence of bacteria on Pb and Zn speciation, mobility and bioavailability in soil: A laboratory study. Environmental Pollution, 2006, 144(3): 765- 773.
[33] Oves M, Khan M S, Zaidi A. Chromium reducing and plant growth promoting novel strainPseudomonasaeruginosaOSG41 enhance chickpea growth in chromium amended soils. European Journal of Soil Biology, 2013, 56: 72- 83.
[34] 胡宗福, 朱宏吉. 解磷酵母PichiafarinoseFL7用于镍污染土壤植物提取的研究. 中国生物工程杂志, 2015, 35(11): 36- 45.
[35] Gupta P, Kumar V. Value added phytoremediation of metal stressed soils using phosphate solubilizing microbial consortium. World Journal of Microbiology and Biotechnology, 2017, 33(1): 9- 9.
[36] Becerra-Castro C, Prieto-Fernández A,lvarez-Lopez V, Monterroso C, Cabello-Conejo M I, Acea M J, Kidd P S. Nickel solubilizing capacity and characterization of rhizobacteria isolated from hyperaccumulating and non-hyperaccumulating subspecies ofAlyssumserpyllifolium. International Journal of Phytoremediation, 2011, 13(S1): 229- 244.
[37] Li K F, Ramakrishna W. Effect of multiple metal resistant bacteria from contaminated lake sediments on metal accumulation and plant growth. Journal of Hazardous Materials, 2011, 189(1/2): 531- 539.
[38] He H D, Ye Z H, Yang D J, Yan J L, Xiao L, Zhong T, Yuan M, Cai X D, Fang Z Q, Jing Y X. Characterization of endophyticRahnellasp. JN6 fromPolygonumpubescensand its potential in promoting growth and Cd, Pb, Zn uptake byBrassicanapus. Chemosphere, 2013, 90(6): 1960- 1965.
[39] Jeong S, Moon H S, Nam K, Kim J Y, Kim T S. Application of phosphate-solubilizing bacteria for enhancing bioavailability and phytoextraction of cadmium(Cd) from polluted soil. Chemosphere, 2012, 88(2): 204- 210.
[40] 陈秀华. 丛枝菌根真菌对重金属、稀土元素污染土壤生物修复研究[D]. 武汉: 华中农业大学, 2007
[41] Chiapello M, Martino E, Perotto S. Common and metal-specific proteomic responses to cadmium and zinc in the metal tolerant ericoid mycorrhizal fungusOidiodendronmaiusZn. Metallomics, 2015, 7(5): 805- 815.
[42] Zhang M K, Zhang H M. Co-transport of dissolved organic matter and heavy metals in soils induced by excessive phosphorus applications. Journal of Environmental Sciences, 2010, 22(4): 598- 606.
[43] 刘坤.有机酸对土壤重金属Pb、Cd的活化及蚯蚓诱导植物修复作用的研究[D]. 泰安: 山东农业大学, 2008.
[44] Daghino S, Martino E, Perotto S. Model systems to unravel the molecular mechanisms of heavy metal tolerance in the ericoid mycorrhizal symbiosis. Mycorrhiza, 2016, 26(4): 263- 274.
[46] Kumar K V, Srivastava S, Singh N, Behl H M. Role of metal resistant plant growth promoting bacteria in ameliorating fly ash to the growth ofBrassicajuncea. Journal of Hazardous Materials, 2009, 170(1): 51- 57.
[47] Babu A G, Shea P J, Sudhakar D, Jung I B, Oh B T. Potential use ofPseudomonaskoreensisAGB- 1 in association withMiscanthussinensisto remediate heavy metal(loid)-contaminated mining site soil. Journal of Environmental Manarement, 2015, 151: 160- 166.
[48] Rodríguez-Sánchez V, Guzmán-Moreno J, Rodríguez-González V, Flores-de la Torre J A, Ramírez-Santoyo R M, Vidales-Rodríguez L E. Biosorption of lead phosphates by lead-tolerant bacteria as a mechanism for lead immobilization. World Journal Microbiology and Biotechnology, 2017, 33(8): 150.
[49] Çabuk A, Akar T, Tunali S, Tabak Ö. Biosorption characteristics ofBacillussp. ATS- 2 immobilized in silica gel for removal of Pb(II). Journal of Hazardous Materials, 2006, 136(2): 317- 323.
[50] Rai U N, Dubey S, Shukla O P, Dwivedi S, Tripathi R D. Screening and identification of early warning algal species for metal contamination in fresh water bodies polluted from point and non-point sources. Environmental Monitoring and Assessment, 2008, 144(1/3): 469- 481.
[51] Martins da Costa E, de Lima W, Oliveira-Longatti S M, de Souza F M. Phosphate-solubilising bacteria enhanceOryzasativagrowth and nutrient accumulation in an oxisol fertilized with rock phosphate. Ecological Engineering, 2015, 83: 380- 385.
[52] 孙嘉龙, 李梅, 曾德华. 微生物对重金属的吸附、转化作用. 贵州农业科学, 2007, 35(5): 147- 150.
[53] Ahemad M, Kibret M. Recent trends in microbial biosorption of heavy metals: a review. Biochemistry & Molecular Biology, 2013, 1(1): 19- 26.
[54] 董立萍. 解磷菌修复土壤铅污染效应优化及机理探索[D]. 西安: 西北大学, 2014.
[55] 任永霞. 陕北矿区重金属污染土壤的微生物——植物联合修复技术研究[D]. 西安: 西北大学, 2011.
[56] Brito I, Cárvalho M, Alho L, Goss M J. Managing arbuscular mycorrhizal fungi for bioprotection: Mn toxicity. Soil Biology and Biochemistry, 2014, 68: 78- 84.
[57] 刘灵芝, 张玉龙, 李培军, 巩宗强. 铅锌矿区分离丛枝菌根真菌对万寿菊生长与吸镉的影响. 土壤学报, 2012, 49(1): 43- 49.
[58] Praburaman L, Park S H, Cho M, Lee K J, Ko J A, Han S S, Lee S H, Kamala-Kannan S, Oh B T. Significance of diazotrophic plant growth-promotingHerbaspirillumsp. GW103 on phytoextraction of Pb and Zn byZeamaysL. Environmental Science and Pollution Research, 2017, 24(3): 3172- 3180.
[59] Kumar K V, Patra D D. Effect of metal tolerant plant growth promoting bacteria on growth and metal accumulation in Zea mays plants grown in fly ash amended soil. International Journal of Phytoremediation, 2013, 15(8): 743- 755.
[60] De Oliveira M V, Intorne A C, Vespoli Lde S, Madureira H C, Leandro M R, Pereira T N S, Olivares F L, Berbert-Molina M A, De Souza Filho G A. Differential effects of salinity and osmotic stress on the plant growth-promoting bacteriumGluconacetobacterdiazotrophicusPAL5. Archives of Microbiology, 2016, 198(3): 287- 294.
[61] Hassan W, Bashir S, Ali F, Ijaz M, Hussain M, David J. Role of ACC-deaminase and/or nitrogen fixing rhizobacteria in growth promotion of wheat(TriticumaestivumL.) under cadmium pollution. Environmental Earth Sciences, 2016: 75(3): 267.
[62] de Souza E M, Granada C E, Sperotto R A. Plant pathogens affecting the establishment of plant-symbiont interaction. Frontiers in Plant Science, 2016, 7: 15.
[63] Wood J L, Tang C X, Franks A E. Microbial associated plant growth and heavy metal accumulation to improve phytoextraction of contaminated soils. Soil Biology and Biochemistry, 2016, 103: 131- 137.
[64] Ma Y, Oliveira R S, Wu L, Luo Y, Rajkumar M, Rocha I, Freitas H. Inoculation with metal-mobilizing plant-growth-promoting rhizobacteriumBacillussp. SC2b and its role in rhizoremediation. Journal of toxicology and environmental health, Part A: Current Issues, 2015, 78(13/14): 931- 944.
[65] Ma Y, Prasad M N V, Rajkumar M, Freitas H. Plant growth promoting rhizobacteria and endophytes accelerate phytoremediation of metalliferous soils. Biotechnology Advances, 2011, 29(2): 248- 258.
[66] Chatterjee S, Sau G B, Mukherjee S K. Plant growth promotion by a hexavalent chromium reducing bacterial strain,CellulosimicrobiumcellulansKUCr3. World Journal of Microbiology and Biotechnology, 2009, 25(10): 1829- 1836.
[67] Nogueira M A, Nehls U, Hampp R, Poralla K, Cardoso E J B N. Mycorrhiza and soil bacteria influence extractable iron and manganese in soil and uptake by soybean. Plant and Soil, 2007, 298(1/2): 273- 284.
[68] 李志超. 微生物对甲基汞的降解作用.环境科学, 1984, 5(3): 61- 64.
[69] Saravanan V S, Madhaiyan M, Thangaraju M. Solubilization of zinc compounds by the diazotrophic, plant growth promoting bacteriumGluconacetobacterdiazotrophicus. Chemosphere, 2007, 66(9): 1794- 1798.
[70] Zaidi S, Usmani S, Singh B R, Musarrat J. Significance ofBacillussubtilisstrainSJ- 101 as a bioinoculant for concurrent plant growth promotion and nickel accumulation inBrassicajuncea. Chemosphere, 2006, 64(6): 991- 997.

