小儿主动脉缩窄围术期泛素羧基末端水解酶L1的变化与临床意义
童 峰 李 磊 赵 涛 李晓峰 刘迎龙*
(1.首都医科大学附属北京儿童医院心外科,北京 100056;2.首都医科大学附属北京安贞医院小儿心脏中心, 北京 100029)
体外循环(cardiopulmonary bypass,CPB)引起脑损伤可导致住院时间延长、住院费用增加、病死率和其他合并症增加[1]。监测脑损伤标志物有利于婴幼儿CPB相关脑损伤的早期诊断和治疗。神经元特异性烯醇化酶(neuron specific enolase,NSE),胶质蛋白S-100β和髓鞘碱性蛋白等脑损伤标志物由于敏感度和/或特异性不高,使其临床应用仍受限[2]。泛素羧基末端水解酶L1(ubiquitin carboxyl-terminal esterase-L1,UCH-L1)在神经元中表达丰富,是泛素蛋白酶体系统中一种重要的去泛素化酶,对维持神经轴突功能的稳定起重要作用[3]。本研究关注小儿主动脉缩窄围术期血清UCH-L1变化特点,初步评估UCH-L1在小儿中度低温停循环(moderate hypothermia circulatory arrest,MHCA)/选择性脑灌注(selective cerebral perfusion,SCP)相关的脑损伤中是否是一种有效的血清标志物。
1 对象与方法
1.1 研究对象
纳入标准:诊断为单纯主动脉缩窄(aortic coarctation,CoA)或合并心内畸形的CoA患儿,并同意参与研究。排除标准:年龄>6岁,生后Apgar评分<7分,术前有明显神经系统异常表现,术前左室射血分数<35%,染色体异常,二次手术,术前肾功能不全。根据纳入和排除标准,在2012年1月-2013年6月在首都医科大学附属北京安贞医院小儿心脏中心住院手术的患儿共43例。其中4例血液样本显示明显异常或溶血必须丢弃,最终共纳入39例。将研究对象分为2组:A组为单发主动脉缩窄的患者,未行CPB;B组包括合并室间隔缺损或其他心内畸形的主动脉缩窄患者,需要进行中度低温停循环联合SCP操作。本研究经医院医学伦理委员会批准并获得所有参与者父母的同意。
1.2 麻醉、灌注技术
所有患儿采取相同的麻醉管理策略。B组患儿CPB平均灌注压维持在40~60 mmHg(1 mmHg=0.133 kPa);在主动脉阻断后,鼻咽温降至23~26 ℃,直肠温降至24~28 ℃行SCP,调整动脉灌注流量为20~30 mL·kg-1·min-1,SCP期间严格按照安贞医院常规操作[4]。手术期间不应用负压吸引而采用节血过滤装置,手术结束后不进行自体输血。
1.3 手术操作
两组均采取标准的外科操作技术:所有患儿的手术通过典型的左胸后外侧切口或胸部正中切口进行,根据主动脉弓形态决定主动脉弓和降主动脉吻合方法[5]。
1.4 监护与数据采集
患儿麻醉诱导后将近红外光谱探头(Niro200; Hamamatsu Photonics公司,日本)置放在患儿的双侧前额处记录脑组织氧饱和度(brain tissue oxygen saturation,ScO2),B组在手术中的6个不同时点记录,A组仅记录t1和t6时点ScO2值(t1: 麻醉诱导后,t2: CPB后5 min, t3:SCP后5 min,t4: SCP停止后5 min, t5:CPB停止后5 min, t6:外科关胸)。
在另外6个不同时点(T1:麻醉诱导后,T2:外科关胸,T3:术后2 h,T4:术后8 h,T5:术后24 h,T6:术后48 h),从中心静脉导管取血并离心(离心半径13.5 cm,3 000 r/min,15 min)分离血清。使用相应商品化试剂盒酶联免疫吸附测定法测定血清UCH-L1,S100β和NSE浓度[5]。
术后患儿被转送到ICU;所有患者在术后8 h,脱离呼吸机后6 h及出院前进行改良格拉斯哥昏迷评分(James’ adaptation of Glasgow coma scale,JGCS)测定,评估脑损伤的严重程度。神经系统合并症被定义术后新出现的神经症状或体征,在出院后30 d内或住院期间的死亡定义为早期死亡。
1.5 统计学方法
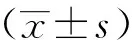
2 结果
2.1 术前分组资料
两组间性别和年龄与术前比较,差异无统计学意义(P>0.05),B组手术时体质量与A组比较,差异有统计学意义(P<0.05)。其中A组合并畸形:主动脉发育不良1例,主动脉二瓣化畸形1例,卵圆孔未闭1例,动脉导管未闭10例,二尖瓣狭窄2例,气管狭窄1例;B组合并畸形:主动脉发育不良3例,主动脉二瓣化畸形5例,室间隔缺损14例,房间隔缺损6例,动脉导管未闭11例,部分心内膜垫缺损1例,主动脉瓣下隔膜2例,肺动脉吊带1例,二尖瓣狭窄1例,腭裂1例,气管狭窄2例。
A组降主动脉阻断时间(23.76±5.94)min与B组(34.27±8.74)min比较,差异有统计学意义(P<0.05)。B组CPB和主动脉阻断时间分别为(137.50±26.99) min,(71.32±12.71) min。B组术后呼吸机辅助通气时间和住院时间较A组明显延长(t=9.403,P=0.034)。两组患儿术后均无死亡,详见表1。
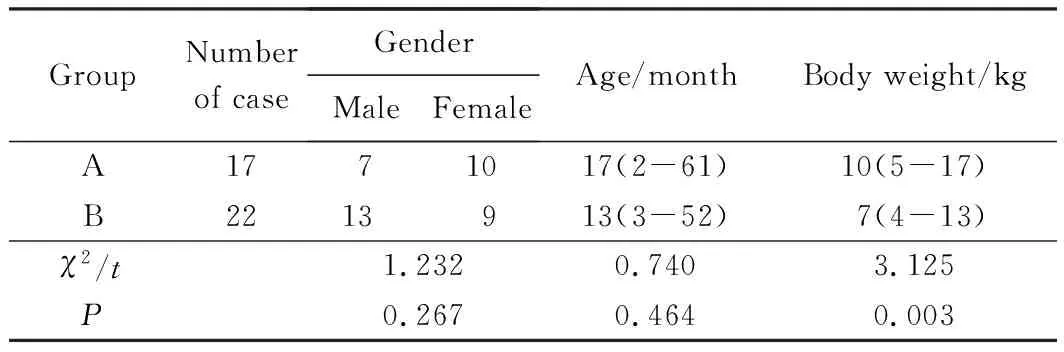
表1 术前两组主动脉缩窄患儿临床资料Tab.1 Clinical data of patients with aorticcoarctation in two groups
groupA: CoA patients without CPB;groupB: CoA patients with SCP combined with intracardiac malformations;CoA:aortic coarctation;SCP:selective cerebral perfusion.
2.2 两组ScO2浓度变化
两组间麻醉诱导后ScO2差异无统计学意义(P=0.939)。B组ScO2在CPB开始后有增加,并在降温期间保持在同一较高水平,在复温阶段ScO2逐渐下降到最低点。另一方面,A组患者在整个手术操作过程ScO2没有显著的变化 (图 1)。
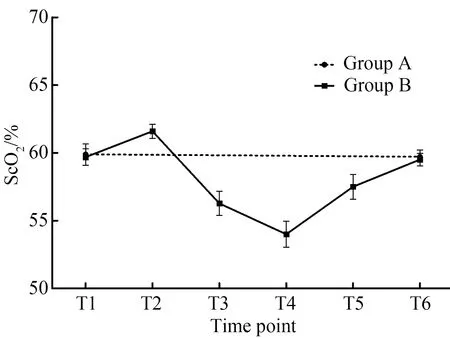
图1 两组不同时点ScO2变化
ScO2:cerebral tissue oxygen saturation;t1:induction of anesthesia;t2: 5 min after cardiopulmonary bypass;t3: 5 min after selective cerebral perfusion;t4: 5 min after selective cerebral perfusion;t5: 5 min after stopping cardiopulmonary bypass;t6: surgical closure.
2.3 两组血清UCH-L1,S-100β和NSE的浓度变化
麻醉诱导后2组患者血清生物化学指标间差异无统计学意义(P>0.05)。A组术前、术后不同时点的血清S100β浓度差异无统计学意义(t=9.003,P=0.690),而术后2 h的血清NSE浓度和术后2 h,8 h血清UCH-L1浓度较术前升高,差异有统计学意义(P<0.05)。B组术后UCH-L1,S-100β蛋白和NSE浓度较术前显著增加(P<0.01);NSE和S100β蛋白血清浓度峰值在术后2 h,而UCH-L1血清峰值浓度出现在术后8 h。在B组中血清UCH-L1蛋白水平从基线时间到手术后8 h持续增加,但术后24 h即基本恢复基线水平,术后24 h两组间UCH-L1水平差异无统计学意义(t=11.841,P=0.791;F组间=8.9,P组间=0.005)(图2)。两组间比较,B组术后S100β蛋白有显著升高,差异有统计学意义(t=8.355,P=0.003);B组S100β蛋白水平自术后2 h下降,至术后48 h恢复至基线水平,术后24 h两组间差异无统计学意义(t=7.416,P=0.750;F组间=17.4,P组间<0.001) (图3)。B组NSE水平术后波动较大,且术后48 h均值低于A组水平(F组间=1.153,P组间=0.29)(图4)。
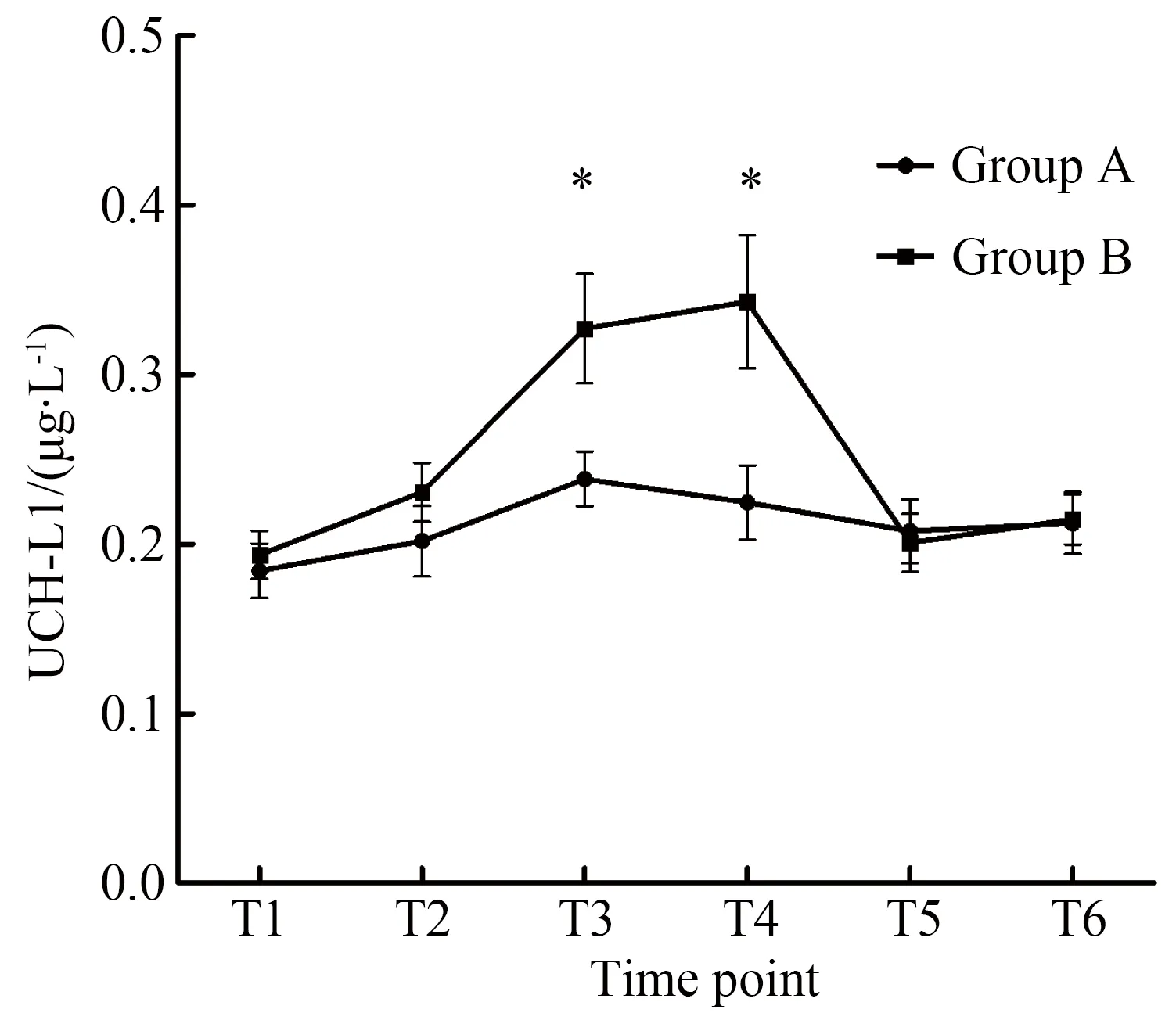
图2 不同检测时点血清UCH-L1浓度变化Fig.2 Changes in serum UCH-L1 concentration atdifferent points
*P<0.05vsgroup A;UCH-L1:ubiquitin carboxyl-terminal hydrolase L1;T1: induction of anesthesia;T2:surgical closure;T3:2 h after the operation;T4:8 h after the operation;T5:24 h after the operation;T6:48 h after the operation.
2.4 2组血清UCH-L1和S-100β蛋白与CPB时间相关性分析
B组中UCH-L1和血清S-100β蛋白的峰值水平与CPB时间长短相关(r=0.575,P=0.005),(r=0.453,P=0.034),与降主动脉阻断时间不相关。
2.5 2组患儿JGCS评分及预后
两组术前JGCS评分均为15分,术后8 h JGCS A组为(14.06±0.83)分,B组为(13.82±1.18)分,2组间差异无统计学意义(P>0.05);其中在B组中4例患者JGCS评分<12分,而在A组中没有患者的得分低于12分。在患者脱离呼吸机后6 h, 2组JGCS评分差异无统计学意义(P=0.205),出院前评分均达到15分。所有患者未出现抽搐,偏瘫等严重神经系统症状体征,而B组中3例患者术后发生谵妄状态,所有患者未遗留不可逆转的神经系统功能障碍。
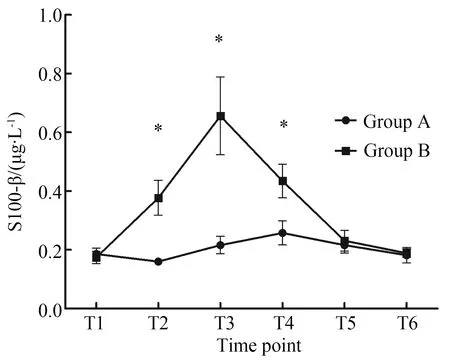
图3 不同检测时点血清S100-β浓度变化Fig.3 Changes in serum S100-β concentration atdifferent detection points
*P<0.05vsgroup A;T1: induction of anesthesia;T2:surgical closure;T3:2 h after the operation;T4:8 h after the operation;T5:24 h after the operation;T6:48 h after the operation.
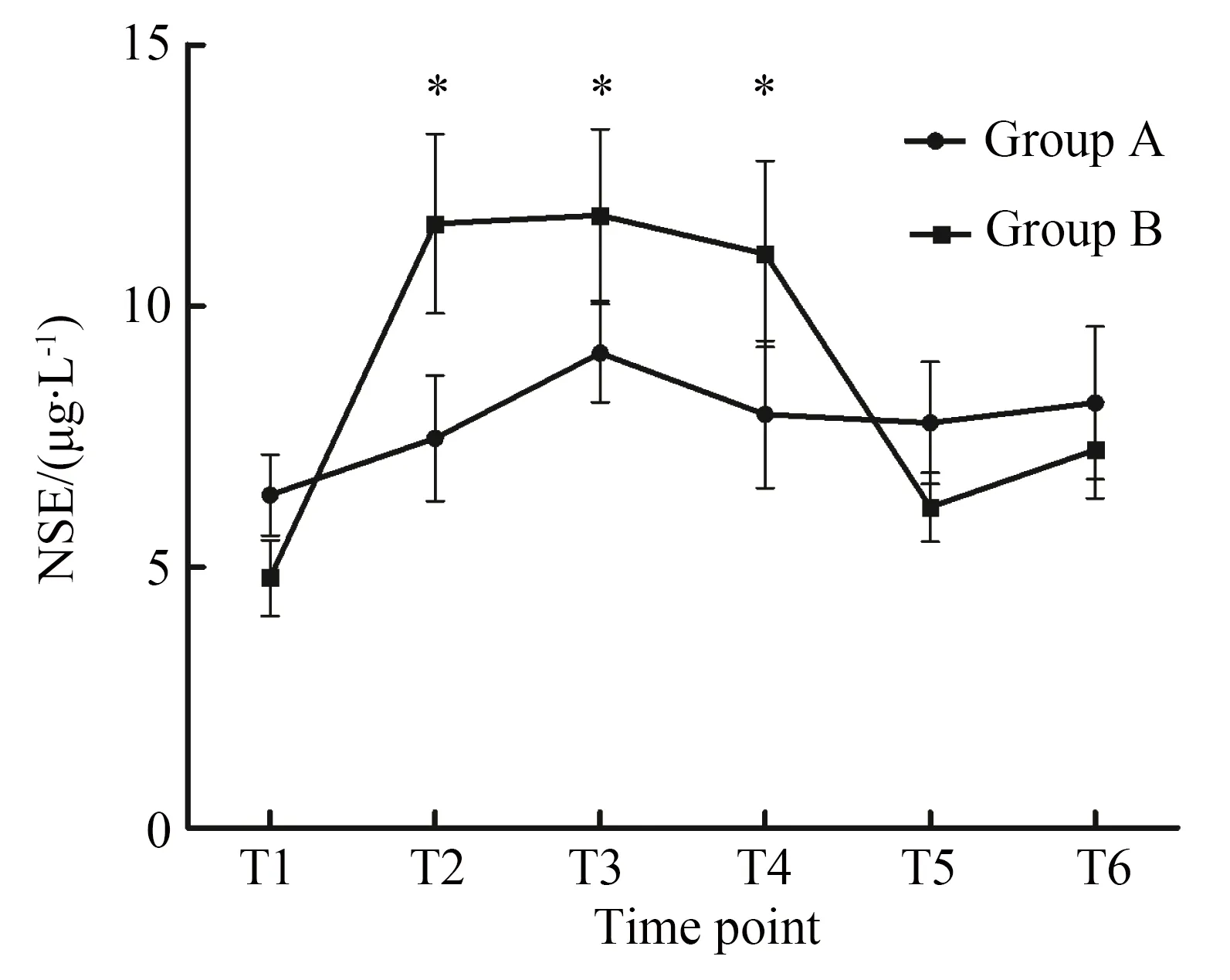
图4 不同检测时点血清NSE浓度变化Fig.4 Changes in serum NSE concentration at different points
*P<0.05vsgroup A;NSE:neuron specific enolase;T1: induction of anesthesia;T2:surgical closure;T3:2 h after the operation;T4:8 h after the operation;T5:24 h after the operation;T6:48 h after the operation.
3 讨论
CPB造成的脑组织损伤与CPB的低灌注状态、全身炎性反应、脑血管栓塞、缺血/再灌注损伤, 代谢物积聚及兴奋性氨基酸(excitatory amino acids,EAA)增加等因素有关[6]。而小儿神经细胞的树突和轴突少而短,更易受缺血、缺氧等影响而发生不可逆性凋亡坏死,所以先天性心脏病术后如注意力,行为问题、学习困难、高级整合功能障碍等仍然常见[7]。心脏手术患儿术中及术后早期大多处于全身麻醉或镇静状态,且需呼吸、循环支持,常规影像学检查如头部CT等往往难以实现,使得CPB相关脑损伤的早期诊断很困难。从受损的脑组织中释放的生物标志物在脑脊液中的监测较准确,干扰因素少,但临床获取标本较困难,而血清相对容易获取。监测血清中S-100β蛋白,髓鞘碱性蛋白(myelin basic protein, MBP),NSE等临床应用较多,但易受多种因素干扰,致其特异度和/或敏感度有限。
相关研究[5,8]发现脑损伤后UCH-L1可大量释放到外周血或脑脊液中,脑脊液中UCH-L1升高与脑缺血再灌注损伤相关,同时其升高的水平可反映颅脑损伤后血脑屏障损伤程度。Arnaoutakis等[9]在CPB动物模型中发现深低温停循环(deep hypothermia circulatory arrest,DHCA)后血清中UCH-L1明显升高,升高幅度与DHCA时间相关,术后8 h风险预测临界值为3.9 ng/mg。而血清UCH-L1水平与SCP后脑损伤的关系,以及和其他常用指标的相关性研究仍鲜有报道。本研究分析了血清UCH-L1水平与多种临床因素(包括CPB时间,术中脑氧饱和度等)和其他脑损伤生物标志物间的关系。结果表明,术后血清UCH-L1水平在B组患者明显高于A组,其变化趋势与常用脑损伤生物标志物有趋同性;并且其升高幅度和CPB时间等呈正相关。B组血清 UCH-L1水平升高可能是在CPB过程中神经细胞损伤和脑毛细血管通透性增加使其释放到外周血液。这种变化与CPB手术围术期诸多脑损伤因素有关[10]。A组中血清UCH-L1和S-100β水平始终保持在术前正常范围,仅血清NSE浓度与术前相比有显著升高。这样的研究结果表明,非CPB手术是一种更符合生理而且创伤小的过程,符合临床实际。而与A组患者相比, B组患者UCH-L1的升高则反映了长时间的CPB可引起脑损伤;同时在B组中手术后各种血清标志物浓度随着时间变化的过程是不同于A组的。这些变化可能基于脑部的解剖基础。胶质细胞终足与毛细血管内皮紧密相连参与血-脑脊液屏障的组成,脑组织受到缺血、缺氧打击后,血-脑脊液屏障破坏,此时星形胶质细胞中的S100β释放入血。同时胶质细胞作为神经元与血管之间代谢物质的转运站,使存在于神经元细胞中的UCH-L1和NSE需经过它释放入血。本研究结果中B组血清UCH-L1峰值浓度出现在术后8 h,而为NSE和S100β血清峰值浓度出现在术后2 h。NSE的血清峰值浓度较UCH-L1提前出现考虑可能与外源性污染有关。
目前研究[11-13]已表明血清S-100β和NSE水平的升高可以由外源性污染引起。为减少其他来源的S-100β蛋白污染,本研究在手术中不用心内吸引而采用血液回收过滤系统,以减少对检测结果的干扰。CPB不可避免引起一定程度的溶血,为了减少溶血对研究结果的影响,所有患者均未进行自体输血,术后出现明显溶血时也被排除在研究之外。虽然UCH-L1在卵巢,睾丸和神经内分泌细胞中可以检测到,但其在大脑中的含量更丰富,且特异性更高[3];同时大脑较其他器官对缺血、缺氧的耐受力差,所以心脏手术后早期血清UCH-L1浓度的升高更可能是由脑组织损伤引起的[14-15]。
在这项研究中手术后血清UCH-L1水平和术后神经功能评分之间的相关性不大,考虑与研究样本较小和GCS对轻度脑损伤的诊断效率有关。由于时间和研究条件限制没有进行中远期神经认知功能评估,但进一步完善相关神经系统检查很有必要。综上所述,在本研究中小儿主动脉缩窄患者行MHCA/SCP后可出现血清UCH-L1浓度的升高,其与S100β,NSE等的变化有一定的趋同性,其可能成为一具更好特异性敏感性的脑损伤血清标志物。
[1] 李稼.体外循环术对先天性心脏病患儿手术前后神经系统发育障碍的影响[J].中华实用儿科临床杂志,2014,29(18):1368-1371.
[2] Laterza O F, Modur V R, Crimmins D L,et al.Identification of novel brain biomarkers[J]. Clin Chem, 2006, 52(9), 1713-1721.
[3] Day I N M, Thompson R J. UCHL1 (PGP 9.5): neuronal biomarker and ubiquitin system protein[J]. Prog Neurobiol, 2010, 90(3): 327-362.
[4] Tong F, Li Z Q, Li L, et al.The follow-up surgical results of coarctation of the aorta procedures in a cohort of Chinese children from a single institution[J].Heart Lung Circ, 2014,23(4):339-46.
[5] Mondello S, Linnet A, Buki A, et al. Clinical utility of serum levels of ubiquitin C-terminal hydrolase as a biomarker for severe traumatic brain injury[J]. Neurosurgery, 2012,70(3): 666-675.
[6] Beca J, Gunn J K, Coleman L,et al. New white matter brain injury after infant heart surgery is associated with diagnostic group and the use of circulatory arrest clinical perspective[J]. Circulation, 2013, 127(9): 971-979.
[7] von Rhein M, Dimitropoulos A, Valsangiacomo Buechel ER,et al. Risk factors for neurodevelopmental impairments in school-age children after cardiac surgery with full-flow cardiopulmonary bypass[J]. The Journal of Thoracic and Cardiovascul Surg, 2012, 144(3): 577-583.
[8] Blyth B J, Farahvar A, He H, et al. Elevated serum ubiquitin carboxy-terminal hydrolase L1 is associated with abnormal blood-brain barrier function after traumatic brain injury[J]. J Neurotrauma, 2011, 28(12): 2453-2462.
[9] Arnaoutakis G J, George T J, Wang K K,et al. Serum levels of neuron-specific ubiquitin carboxyl-terminal esterase-L1 predict brain injury in a canine model of hypothermic circulatory arrest[J]. J Thoracic Cardiovasc Surg, 2011, 142(4): 902-910.
[10] Dabrowski W, Rzecki Z, Pilat J,et al. Brain damage in cardiac surgery patients[J]. Current Opin Pharmacol, 2012, 12(2): 189-194.
[11] 邱银燕,金秀峰,许尚栋.心脏术后麻醉合并症及相关处理[J].首都医科大学学报,2015,36(3):382-387.
[12] 尹彦玲. 围麻醉期乌司他丁对体外循环下行心脏手术患者全身及脑部炎性反应的影响及其脑保护作用[J].中国煤炭工业医学,2015,18(2):259-262.
[13] 张意, 杨义光,李忠生,等.NSE、S-100β和COX-2在1-溴丙烷大鼠亚急性神经损伤中的变化[J].中国煤炭工业医学杂志,2017,20(6):701-706.
[14] 徐平湘,齐特,陆莉,等.原代大鼠脑微血管内皮细胞培养方法的改进[J].首都医科大学学报,2016,37(5):693-698.
[15] 任思颖,伍国锋,杨勤,等.病灶区灌注罗格列酮对脑出血家兔血肿周围咬合蛋白和闭合小环蛋白1 mRNA表达水平及血-脑屏障通透性的影响[J].中国脑血管病杂志,2017,14(11):580-584,593.

