三氧化二砷对慢性粒细胞白血病Hedgehog信号转导通路分子蛋白表达的影响
马咏歌,宋鹏,叶向梅,赵辉,刘志宇,张丽坤,刚宏林,3,杨东光*(.黑龙江中医药大学, 黑龙江 哈尔滨 50040;.哈尔滨医科大学附属第一医院中心血液实验室,黑龙江 哈尔滨 5000;3.哈尔滨食品药品检验检测中心, 黑龙江 哈尔滨 5005)
三氧化二砷(Arsenic trioxide, ATO),又名亚砷酸,为中药砒霜提取物,有剧毒,用于治疗慢性粒细胞白血病(chronic myeloid leukemia,CML)历史悠久,是最早的抗CML药物。Hedgehog(Hh)通路是胚胎发育过程中的关键信号通路之一,但是Hedgehog通路成分的改变往往与人类恶性肿瘤的发展有关[1]。研究表明Hh通路在部分CML患者中异常活化,CML的靶向性治疗药物伊马替尼(Imatinib mesylate,IM)对该通路无抑制作用,因此,该通路是IM耐药细胞赖以生存的重要信号转导通路。
目前,研究的Hh信号抑制剂均以Smoothened(Smo)为靶点,其药理活性较Smo的天然抑制剂环巴胺(Cyclopamine)有所提高,在治疗CML的临床前研究中获得了满意的疗效[2]。但作为新研发的小分子药物,在其走向临床之前,需要进行临床前研究以评价其安全性。其次, Smo抑制剂的应用诱发患者和鼠模型编码Smo蛋白的基因发生突变,这些突变严重阻碍了Smo抑制剂与该蛋白的结合能力,导致患者对该疗法耐药[3]。此外,Smo下游分子Gli2 和cyclin D1的直接活化,可以绕过Smo抑制剂的作用靶点,是Smo抑制剂耐药的另外一个原因[4]。所以,由于缺乏临床应用经验及以Smo为靶点,目前的Hh通路抑制剂尚无法在CML患者中广泛应用。
近年来随着医学水平的提高以及分子生物学的进展,ATO已经较为普遍地运用于肿瘤疾病的治疗上,并展现出较好的治疗效果。而且我们发现,ATO的应用可预防IM耐药的发生。ATO 在2010年被认定为Hh通路的靶向性抑制剂,我们率先在应用ATO治疗并获得满意疗效的急性早幼粒细胞白血病(Acute promyelocytic leukemia,APL)患者上进行了ATO对Hh通路抑制作用的验证。这为ATO应用于CML的IM耐药的治疗提供了理论上的可能性。但ATO对CML干细胞及其Hh通路的抑制作用及靶点尚未阐明。本研究以CML细胞株K562为模型,初步探讨ATO对CML细胞Hh通路关键蛋白表达的抑制作用及机制,为该药应用于CML的临床治疗提供理论基础。
1 材料与方法
1.1 材料
人类CML细胞株K562,为本实验室长期培养。ATO注射液(10 mg/10 mL),由哈尔滨伊达药业提供。TRIzol,invitrogen公司。逆转录试剂盒,PROMEGA公司。Fast Start Universal SYBR Green PCR Master实时定量PCR试剂盒,罗氏公司。RIPA强裂解液,碧云天公司。抗c-Abl抗体(sc-56887),Santa Cruz公司。碱磷显色二抗,Amersham公司。
1.2 方法
1.2.1 人类CML细胞株K562培养与处理
K562细胞使用含10%胎牛血清(杭州四季青)和浓度为100 IU/M青链霉素(Invitrogen)的1640培养基中(Gibco),置于37℃细胞培养箱中长期培养。ATO注射液(10 mg/10mL),由哈尔滨伊达药业提供。实验时,使用不同浓度的ATO溶液连续作用于K562细胞48 h,并收集细胞,做下一步检测。
1.2.2 Annexin-V/PI双染检测细胞调亡
收集经过浓度分别为0、1、2、4、8μM的ATO处理的K562细胞,经用PBS洗涤、AnnexinV-FITC染色后,在室温避光静止15 min后每管再加入1×binding buffer 400 μL,在1 h内上流式细胞仪进行凋亡检测。每份样品同设3份,求平均值和标准差。
1.2.3 免疫印迹
收集经过浓度分别为0、1、2、4 μM的ATO处理的K562细胞,采用RIPA强裂解液(150 mM NaCl, 1% w NP-40, 0.5%[w/v]sodium deoxycholate, 0.1%[w/v]sodium dodecyl sulfate (SDS), 50 mM Tris HCl [pH=8], 10 mM EDTA, and 1 mM PMSF)(碧云天)提取蛋白后进行SDS-PAGE电泳,电泳结束后,用蛋白转移装置将蛋白转移到硝酸纤维素膜上,按转移蛋白的常规方法进行。转移结束后,进行免疫印迹、碱磷显色及灰度分析。采用抗体为抗Gli2抗体(C-10)(Santa Cruz),抗Gli1抗体(Abcam), 抗Smoothened抗体(Abcam),抗Patched/PTCH 抗体(Abcam)and抗-actin抗体 (Santa Cruz),及碱磷显色二抗 (Amersham)。
1.2.4 统计学处理
2 结果
2.1 ATO对K562细胞的诱导凋亡作用
经不同浓度的ATO处理后,CML细胞K562逐渐出现了凋亡现象,ATO诱导K562细胞出现凋亡呈药物剂量依赖性(见图1)。但值得注意的是,K562对ATO的敏感性较低,2 μM的ATO仅能诱导少量CML细胞发生凋亡。
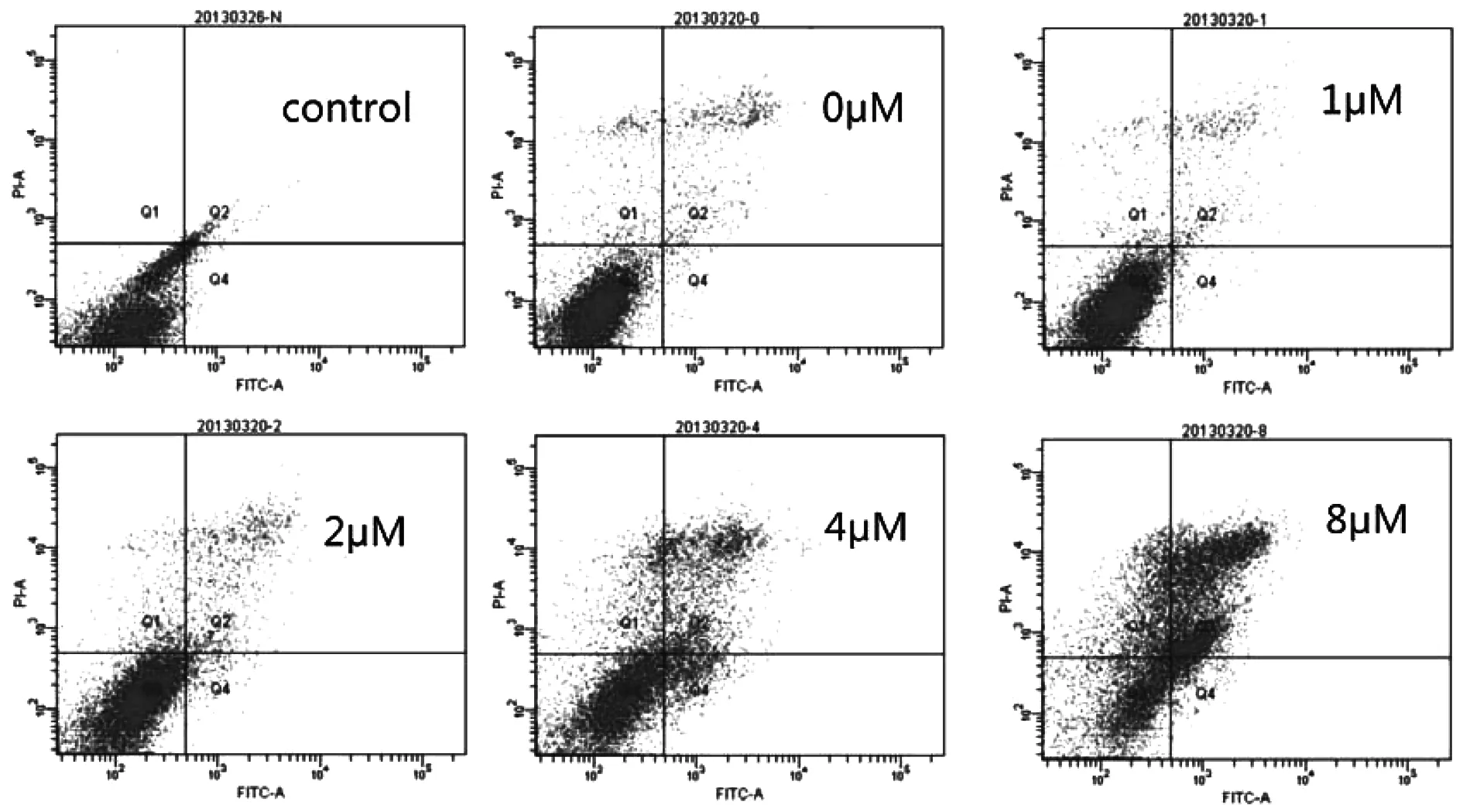
图1 在48 h内不同浓度ATO诱导K562细胞凋亡效果
2.2 ATO对K562细胞Hh信号转导通路分子蛋白水平的影响
经不同浓度的ATO连续作用于K562细胞株48 h后,我们检测了K562细胞Hh信号转导通路分子的蛋白表达情况。结果发现,ATO 对Hh通路的核心蛋白Gli2蛋白表达具有显著的抑制作用,其抑制作用呈剂量依赖性(P<0.05)(见图2)。ATO对于Hh通路的抑制因子ptch2的表达具有一定的促进作用(高剂量呈抑制作用),但无剂量依赖性(P>0.05)。但ATO对于Gli1蛋白,无论何种剂量,在48 h的作用时间内,均未对其蛋白表达水平产生显著的抑制作用(P>0.05)(见图3)。
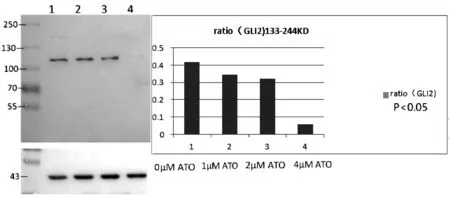
图2 在ATO处理组和对照组中Gli2蛋白的表达情况注:与对照组比较,P<0.05
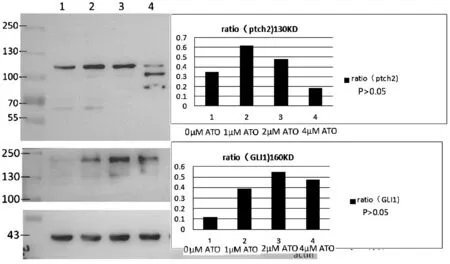
图3 在ATO处理组和对照组中ptch2、Gli1蛋白的表达情况注:与对照组比较,P>0.05
3 讨论
《本草图经》云:“砒霜,旧不着所出郡县,今近铜山处亦有之,惟信州者佳。其块有甚大者,色如鹅子黄,明澈不杂。此类本处自是难得之物,每一两大块,真者人竞珍之,市之不啻金价。古服食方亦或用之,必得此类,乃可入药。其市肆所蓄,片如细屑,亦夹土石,入药服之,为害不浅。误中,解之用冷水研绿豆浆饮之。”砒霜主要成分为三氧化二砷 (ATO),白色,八面体状结晶,三氧化二砷加高热可以升华,故精制比较容易,升华物普通名砒霜。上世纪70年代哈尔滨医科大学创用“癌灵1号”(氧化砷注射液)治疗APL患者,说明砷剂对某些髓系恶性增殖性疾病有确切的疗效,含砷中药对白血病的治疗效果,再一次引起了国际肿瘤学界的关注[5]。ATO应用于临床治疗APL患者多年,现已被公认为是APL的标准治疗方案[6]。最近几年的研究表明,ATO具有广泛的抑瘤作用,不仅可以抑制恶性血液肿瘤细胞增殖,对于肺癌、胃癌、肝癌、结肠癌等其他肿瘤细胞同样具有抑制作用[7-10]。
自2010年有学者发现ATO对Hh通路具有靶向性抑制作用以来,陆续有研究通过体内外实验证实,ATO通过此种机制对包括骨肉瘤、间皮瘤、恶性横纹肌样瘤、恶性胶质瘤、胰腺癌、成神经管细胞瘤和尤文肉瘤甚至APL在内的多种肿瘤发挥杀伤作用,而且ATO的作用范围不仅是肿瘤细胞,也包括部分肿瘤干细胞[11-15]。ATO对Hh信号转导通路表现出特异性抑制,该抑制作用与ATO的细胞毒性、ATO对Ras和Wnt通路的抑制和对JNK和Pp38MAPK通路的活化起作用均无关[13]。
研究发现,ATO对Hh信号转导通路的作用靶点为执行这条通路的核心蛋白Gli。ATO仅对Gli高表达肿瘤细胞具有较好的敏感性,而对Gli低表达的细胞株敏感性较差。目前推测ATO对Gli的作用机理为:Gli蛋白上存在与PML/RARα半胱氨酸残基相同的巯基结构,因此ATO能够与Gli蛋白结合并诱导其降解,体外研究已经发现,ATO长期作用能降解Gli2蛋白;并能与Gli1蛋白结合,抑制其靶基因Ptch和cyclinD1的表达[13-14]。此外,研究还发现,ATO短期作用还可以抑制Gli2在初级鞭毛的积累(该过程为Hh信号转导通路的关键步骤),这可能是与ATO对微管的直接作用相关。
研究采用不同浓度的ATO处理CML细胞K562发现ATO对Hh通路核心蛋白Gli2的抑制和诱导细胞凋亡均呈药物剂量依赖性。但ATO的诱导凋亡效果落后于对Gli2抑制,ATO对Gli2的抑制作用开始于0.5 μM,该剂量对细胞的凋亡并未产生影响,当ATO浓度达到2 μM时,仅使少量CML细胞发生凋亡,但可使K562细胞的Gli2表达显著受抑。因此ATO对Hh分子的抑制,并非是细胞凋亡的后果,表明ATO对Gli2的抑制具有靶向性。本研究在K562细胞上发现ATO对Gli2的抑制作用,与文献报道的在其他细胞上ATO对Gli2的效果一致[13]。本研究还发现,ATO对K562细胞的Gli1蛋白并无抑制作用,该结果亦符合其他研究者的文献报道[14]。Hh通路的负反馈调控因子Ptch低表达是CML患者预后不良的标志,Ptch是预测IM治疗失败的敏感和特异性指标[16]。本研究发现,在ATO作用后,Ptch2蛋白的表达有升高的趋势,表明ATO可能是通过上调负调控因子的表达,抑制Hh通路。当ATO的浓度达到4 μM,大部分细胞死亡,Ptch2随之降解。
总之,本研究证实,在CML细胞中,ATO对Hh通路具有显著的抑制作用,主要是通过降解以Gli2为核心的蛋白发挥最用,并可一定程度上上调负调控因子Ptch2蛋白的表达。ATO对Hh通路的抑制作用具有特异性,发生在诱导凋亡之前。本实验为扩大ATO应用于IM耐药的CML提供了一个坚实的理论基础。
[1] Ross AE, Hughes RM, Glavaris S, et al. Pharmacodynamic and pharmacokinetic neoadjuvant study of hedgehog pathway inhibitor Sonidegib (LDE-225) in men with high-risk localized prostate cancer undergoing prostatectomy[J]. Oncotarget,2017,8(61):104182-104192.
[2] Brechbiel J, Miller-Moslin K, Adjei AA. Crosstalk between hedgehog and other signaling pathways as a basis for combination therapies in cancer[J]. Cancer Treatment Reviews,2014,40(6):750-759.
[3] Kim J, Aftab BT, Tang JY, et al. Itraconazole and arsenic trioxide inhibit hedgehog pathway activation and tumor growth associated with acquired resistance to smoothened antagonists[J]. Cancer Cell,2013,23(1):23-34.
[4] Dijkgraaf GJ, Alicke B, Weinmann L, et al. Small molecule inhibition of GDC-0449 refractory smoothened mutants and downstream mechanisms of drug resistance[J]. Cancer Res, 2011,71(2):435-444.
[5] 朱鸿义.含砷中药治疗白血病的机理探讨[J].浙江中西医结合杂志,2001,11(3):150-151.
[6] Guo Z, Meng M, Geng S, et al. The optimal dose of arsenic trioxide induced opposite efficacy in autophagy between K562 cells and their initiating cells to eradicate human myelogenous leukemia[J]. J Ethnopharmacol, 2017,196:29-38.
[7] 张顺同,孟宇,宁怡蒙,等.三氧化二砷通过Akt信号通路抑制HGC-27细胞的增殖并促进其凋亡[J].胃肠病学和肝病学杂志,2017,26(8):910-914.
[8] 苏永强,邓述恺.三氧化二砷对A549细胞株增殖的抑制作用研究[J].现代医药卫生,2017,33(20):3098-3099.
[9] 倪博雄,杨艳梅,陈晓宁,等.三氧化二砷对肝癌HepG2细胞侵袭转移及USP22蛋白表达的影响[J].现代肿瘤医学,2018,26(5):672-675.
[10] Cai X, Yu K, Zhang L, et al. Synergistic inhibition of colon carcinoma cell growth by Hedgehog-Gli1 inhibitor arsenic trioxide and phosphoinositide 3-kinase inhibitor LY294002[J]. Onco Targets Ther,2015(8):877-883.
[11] Eit R M E, Iskandarani A N, Saliba J L, et al. Effective targeting of chronic myeloid leukemia initiating activity with the combination of arsenic trioxide and interferon alpha[J]. International Journal of Cancer,2014,134(4):988-996.
[12] Yang D, Cao F, Ye X, et al. Arsenic trioxide inhibits the Hedgehog pathway which is aberrantly activated in acute promyelocytic leukemia[J].Acta Haematologica,2013,130(4):260-267.
[13] Nagao Kitamoto H, Nagata M, Nagano S, et al. GLI2 is a novel therapeutic target for metastasis of osteosarcoma[J]. International Journal of Cancer Journal International Du Cancer,2015,136(6):1276-1284.
[14] Beauchamp E M, Ringer L, Bulut G, et al. Arsenic trioxide inhibits human cancer cell growth and tumor development in mice by blocking Hedgehog/GLI pathway[J]. Journal of Clinical Investigation,2011,121(1):148-160.
[15] Kim J, Lee J J, Kim J, et al. Arsenic antagonizes the Hedgehog pathway by preventing ciliary accumulation and reducing stability of the Gli2 transcriptional effector[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(30):13432-13437.
[16] Doulatov S, Notta F, Laurenti E, et al. Hematopoiesis: A Human Perspective[J].Cell Stem Cell,2012,10(2):120-136.

