浅谈细胞规模化培养过程中引起污染的类型及防治策略探讨
苟东东
(杨凌金海生物技术有限公司,陕西 咸阳 712100)
细胞污染是指细胞培养过程中,由于操作不慎或灭菌不彻底将细菌、霉菌或其他异物等带入细胞培养物中,对细胞的生存环境造成侵害的现象。20世纪自Moran和Schenerman等人发现,悬浮培养的规模可以从3 L放大到10 000 L,动物细胞培养的规模开始扩大,广泛地应用于抗体的制备或病毒疫苗的生产,但由于细胞培养自身有其环境敏感性和培养条件苛刻性等特性,如果受到外源性污染,将对生物制品研究或制品生产带来严重的危害。为了防止细胞培养过程中受到其他污染因素的影响,有必要了解细胞培养过程中污染来源、染菌种类等,建立起规范化的操作及防治策略,尽可能地保证细胞培养工序的稳定性及生产可靠性是有必要的。
1 造成污染的来源
1.1 操作人员
人是细胞培养过程中重要的污染源。据统计显示,人自然活动时,人体散发出的热量形成一股热流,这股热流便于微小粒子(大于0.3μm)的扩散,漫步时每分钟产生5.0×106个,快步时产生1.0×107个。人体的各部位都生长着各类微生物,由此可见人体也会给微生物的生长繁殖创造一个良好的环境,因此,加强无菌意识显得尤为重要。从事细胞培养工作人员一定要注意个人卫生习惯,要经常洗澡、洗头、剪指甲,不得化妆、佩戴饰物和手表,工作时要带上消毒好的口罩,以免因交谈、咳嗽等导致传播范围扩大,且不定时对手部等风险较高的位置进行消毒。
1.2 培养环境
按照GMP厂房设施及《洁净厂房设计规范》(GB 50073—2013)中对洁净区内换气次数的要求为15~25 h-1,其目的是为将洁净室污染粒子消除,空调系统须送风于洁净室中循环,对室内污染粒子进行稀释,以保持洁净室洁净度处于可控范围,且HVAC验证合格后方可投入使用,按要求每年需进行检漏试验,并且每月进行一次大环境沉降菌检测来确保环境符合要求。
随着国内细胞工艺的改革,传统的细胞转瓶工艺已经远远跟不上医药产业的需求,在以往的无菌操作中,所有敞口操作都必须在酒精灯火焰旁,现如今采用细胞密闭培养系统(生物反应器),除非是取样口等外部关键部位需要火焰对其进行外部消毒,但是为了排除后续细胞污染因环境因素所带来的干扰,有必要按规定定期对环境进行消毒及环境质量检测,并对区域内房间压差进行监控,防止低级别房间的不洁净空气倒流。
按照兽药GMP现行版的要求,在人、物流通道要加强管理。比如,所有进入洁净区的物品必须在进入洁净区之前脱去外包,并用消毒液对其表面进行擦拭消毒。防止包装上的灰尘进入洁净区,污染环境。笔者以前遇到过有员工在值班期间为了省事,不按照洁净区更衣规程直接进入洁净区域,因此,加强员工洁净区管理意识等方面培训显得尤为重要。
1.3 设备器具
在笔者以前从事细胞转瓶培养的过程中,洁净室空气洁净度为局部环境百级,首先用75%酒精对进入百级环境中使用的物品进行表面消毒,并对层流下的操作台进行擦拭处理,打开紫外灯进行照射15 min,然后打开风机进行自净。使用中的转瓶、除菌滤器、胶塞等工具必须经过121℃、60 min湿热灭菌处理。之后,笔者从事了细胞规模化培养工作,对生物反应器有了新的认识,所谓“死角”,即SIP过程中蒸汽的高温所达不到、消不透的角落。死角在生物反应器容易形成的部位有挡板的背后、罐内管路浸渍管内残留的焦化物,罐体腰部培养基进料口、罐体取样系统、温度计、PH、DO等部位夹缝之间的残留焦化物。以上的这些死角,在分批次规模化培养过程中,由于个别罐体培养周期过长,期间要进行取样、计数、染色及培养基补料操作,操作结束后要及时清洗。如果清洗不彻底,则容易形成死角,这些死角中含有细胞培养悬液,经过高温容易形成越来越多、坚硬的焦化层,这些焦化层是藏污纳垢、杂菌避免高温杀灭的绝好保护层。所以,罐体培养结束后,下罐检查并清除罐内的死角和残渣,是人为消灭杂菌的重要措施。具体流程如图1所示。
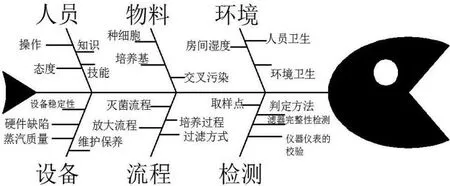
图1 具体工作流程
2 污染的种类
2.1 细菌污染
由于体外培养的细胞自身没有抵抗污染的能力,污染较常见的有大肠杆菌、白色葡萄球菌、假单孢菌等。加用抗生素的培养液可预防和排除少量细菌的污染。一旦发生细菌污染,则很容易发现,多数情况下培养液短时间内变黄,表明有大量酸性物质产生,并出现明显浑浊现象;有时静置的培养液起初不混,但稍加震荡,就有许多浑浊物漂起。倒置显微镜下观察,可见培养液中有大量圆球状颗粒物漂浮,有时在细胞表面及周围有大量细菌存在。有的培养液改变不明显而又疑似污染,也可按照现行版《中国兽药典》中关于无菌检测等方法判断。在规模化生产过程中,用革兰氏染色方法可以快速辨别染菌情况,如图2所示。
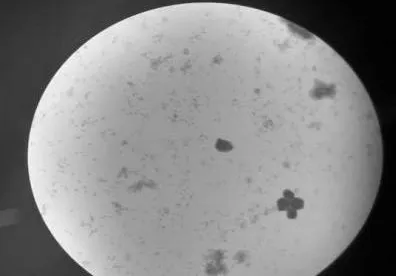
图2 用革兰氏染色方法快速辨别染菌
2.2 真菌污染
真菌的种类很多,污染的多是曲霉菌、白色念珠菌、酵母菌、黑霉菌、孢子菌等。真菌污染后多数在培养液中形成淡黄色或是白色的漂浮物,一般肉眼可见,较易被发现,但培养液仍是清亮的,倒置显微镜下无杂质,37℃培养箱培养两三天仍清亮,但出现絮状杂质,镜下可见呈细丝状的团状漂浮物,可看到明显的菌丝,细胞仍可生长,但时间长之后,细胞的活力状态变差,短期内培养液多不变浑浊。倒置显微镜下可以看见细胞之间有纵横交错穿行的丝状,树枝状或管状菌丝,并漂浮在培养液中。很多菌丝在高倍镜下可以看见链状排列的菌株。念珠菌及酵母菌菌株呈卵圆形,散在细胞上及细胞周边生长。
2.3 支原体污染
支原体是一种大小介于细菌和病毒之间(最小直径0.2μm)并独立生活的微生物,约有1%可通过除菌滤器。支原体无细胞壁形态呈高度多形性,并且国内血清很多都没有做支原体阴性检测,而支原体是牛血清中最常见的微生物之一。支原体多吸附或散在于细胞表面和细胞之间。当细胞(特别是传代细胞)被支原体污染后,培养液一般会浑浊,细胞内的DNA、RNA及蛋白表达发生改变,而细胞的生长率一般并未发生显著的影响,因而细胞被支原体污染一般难以察觉。
3 细胞培养过程中的异常现象
3.1 DO异常变化
引起DO异常下降的原因有以下几个:①罐体染菌,导致细菌消耗大量溶氧,致使罐体溶氧监测值在短时间内迅速下降;②细胞培养接种时初始密度超出规定值,氧需求量增加,使溶氧下降;③生物反应器培养体积较大时,如果搅拌转速较慢、停止或者闷罐 (关闭排气阀)等,都有可能使溶氧下降。
引起DO异常上升的原因有污染烈性噬菌体、补料时间或间隔不当。综上所述,根据培养系统中溶解氧浓度的变化来判断细胞代谢是否正常,有助于查找细胞培养异常的原因。
3.2 p H异常变化
大多数细胞适于pH7.2~pH7.4条件下生长,笔者所培养的BHK-21细胞pH要求为pH6.9~pH7.1范围内。当罐体细胞染菌时,由于细菌消耗大量营养物质,产生过量酸,pH补偿系统崩溃,导致罐体pH值全线下降。即使在不确定染菌情况下,所采取的补救措施也于事无补。
3.3 其他变化
可以根据其他现象,比如细胞形态异常、罐体尾气气味、培养过程中泡沫异常增多、细胞悬液颜色异常变化等来判断,不确定时也可通过罐体取样进行革兰氏染色来判断。
4 污染的防治策略
4.1 对蒸汽质量要求
实践已证明饱和蒸汽在灭菌过程中具有潜热大、穿透力强等特点,所以,反应器在SIP过程中选用饱和蒸汽,罐体灭菌前应先将纯蒸汽管道中的冷凝水排掉,在线对空气滤器灭菌时应注意蒸汽压力,厂家建议压力范围内不可以大幅度的波动,避免对滤芯使用寿命产生影响。按照各企业要求定期对不凝性气体、过热值、干燥值等检测,确保将所需蒸汽符合相关要求。
4.2 对设备的要求
生物反应器及其附属设备在管道对接过程中应注意垫圈大小是否匹配、法兰是否平整、安装是否对中、法兰与管道的焊接是否有砂眼。全盘或半盘管应定期检漏。过滤器在灭菌柜中灭菌时要注意冷凝水的排放且罐体进料所使用滤芯的大小笔者建议使用20in,罐体取样装置,建议使用原厂,包括GMP阀组(符合ASME-BPE要求)。
4.3 对工艺操作的要求
细胞培养结束后,用CIP对罐体及附属设备进行预冲洗,操作人员进入罐体对罐内、附属设备死角、传感器安装处及搅拌桨背面、罐顶等部位进行残渣清除防止焦化层产生,并对空罐进行SIP灭菌后保存。培养基配制罐及培养基传送管道使用后要及时清洗并灭菌,这样既可以降低生物载荷,又可以起到控制制品热源的作用。生物反应器及其附属管道在SIP过程中,要严格执行SOP等规程要求。体积较大的罐体在灭菌过程中应保证蒸汽畅通及冷空气排尽。SIP预热过程中,应一路进气,避免纯蒸汽相互冲撞,将罐体及管道与外界相通的阀门调节到适当位置,能够保证“水汽”排出,SIP过程中注意各阀门的出气大小。
有条件的企业可以使用热成像设备或手持式温度检测仪来建立巡查制度。细胞培养过程中取样一定要注意取样瓶是否是无菌状态、关键部位消毒、阀门的开关顺序,力求减少取样时给罐体所带来的污染风险。严格执行镜检岗位的操作要求,降低革兰氏染色的错判与误判。罐体染菌后,禁止开启罐体与外界相通的阀门并及时查明杂菌来源,并采取相应措施予以处理。根据罐体有效培养体积,计算好培养量,避免培养液面处于搅拌位置而产生泡沫,避免上升至罐顶对呼吸器造成堵塞,进而影响培养参数的正常调控。
5 结束语
现如今,生物制品行业利用多型号、大吨位生物反应器来培养细胞已趋于常态,如果无菌意识不增强、设备使用不规范、硬件设计制造不符合行业标准,都可能造成罐体污染。以上所列举只是笔者生产中经常遇到及用到的,加强无菌意识并且建立规范化的操作及防治策略尤为重要,尽可能地保证细胞培养工序稳定性及生产可靠性。
[1]周丽薇.细胞培养技术与防止细胞污染的方法[J].医学信息(上旬刊),2010,23(11):4387-4388.
[2]曾今诚,向文玉,孔彬,等.细胞培养过程中恶臭假单胞菌污染的去除及污染去除后细胞增殖和细胞周期的检测[J].广东医学院学报,2015,33(01):28-31.
[3]安芳兰,张荣,武发菊,等.大规模细胞培养过程中污染的类型及控制策略探讨[J].甘肃畜牧兽医,2016,46(19):27-30.
[4]曹忠玲.大规模细胞培养中控制污染的举措[J].中国兽药杂志,2010,44(02):56-58.

