小贯小绿叶蝉半胱氨酸蛋白酶基因的克隆与表达
于永晨,肖斌,孙晓玲
1. 西北农林科技大学,陕西 杨凌 712100;2. 中国农业科学院茶叶研究所,浙江 杭州310008;3. 农业部茶树生物学与资源利用重点实验室,浙江 杭州 310008
半胱氨酸蛋白酶(Cysteine protease,CYP)广泛分布于植物、动物、病原微生物、寄生线虫和哺乳动物等生物体内,是一类以半胱氨酸残基为活性中心的蛋白水解酶,可参与细胞内外蛋白质水解与加工、组织再生、个体发育、免疫防御,以及细胞凋亡等许多生理过程[1-3]。在植食性昆虫体内,CYP是不可或缺的重要水解蛋白之一,主要参与食物消化、生长发育、生殖、蜕皮变态、免疫调节和种群防御等重要生命过程,目前在鳞翅目和鞘翅目等完全变态发育的昆虫中研究得已较为透彻[4-9]。例如,家蚕(Bombyx mori)中已报道了 13条 CYP基因全长序列,它们在不同组织和不同发育时期的表达谱也已明确,进一步研究还发现CYP不仅参与了家蚕蜕皮与变态过程中的组织降解与重构,而且也参与了家蚕血细胞发育或辅助血细胞执行造血功能等生理过程[10-14]。Peter等[15]从马铃薯甲虫(Leptinotarsa decemlineataSay)中克隆获得了两条与消化相关的 CYP基因全长序列,并发现其中一条可被植物的诱导防御上调。棉铃虫(Helicoverpa armigeraHübner)CYP不仅参与 5~6龄幼虫的蜕皮过程,而且参与胚胎发育过程中卵黄蛋白的降解[6-7]。迄今,关于不完全变态发育昆虫CYP的研究仅在豆长管蚜(Acyrthosiphon pisum)等个别昆虫中有少量报道[4]。
小贯小绿叶蝉(Empoasca onukiiMatsuda)的发育类型为不完全变态,以成虫、若虫刺吸茶树芽、叶及嫩梢汁液为害,是我国茶园的头号害虫。雌成虫陆续孕卵和分批产卵的习性导致其在田间世代重叠严重而难于防治,据统计,小贯小绿叶蝉大爆发可引起 30%~50%的茶叶产量损失,为害叶制成茶叶后品质严重下降[16]。长期以来,对小贯小绿叶蝉的有效防治主要依赖于化学农药。然而,化学农药的大量使用导致的环境污染、农药残留、害虫抗药性等问题日益凸显。王念武等[17]和庄家祥等[18]的研究结果表明,福建福安茶场的小贯小绿叶蝉对吡虫啉、啶虫脒和联苯菊酯的抗性指数已达到中抗至高抗的水平。因此,利用新型抗虫分子标靶开发小贯小绿叶蝉的调控剂已成为当务之急。如前所述,CYP在昆虫的整个生命过程中发挥着重要作用,因此干扰半胱氨酸蛋白酶的生理功能,将会对目标害虫的生理机能造成严重阻碍,并最终导致死亡。目前,CYP已作为靶蛋白在一些鳞翅目昆虫进行了相关研究[19]。本文从小贯小绿叶蝉的转录组数据库中获得CYP的基因片段的转录本序列,利用RACE技术对其全长进行克隆,继而采用荧光定量PCR(qRT-PCR)技术对Eocyp在小贯小绿叶蝉的不同发育时期、不同组织部位,以及不同温度和不同光照条件处理后的表达量变化情况进行研究,拟为该基因的利用提供基础理论依据。
1 材料与方法
1.1 供试昆虫与样品采集
小贯小绿叶蝉成虫捕于中国农业科学院茶叶研究所试验茶场,并在网笼中用离体茶枝饲喂[(25±2)℃,(70±5)%,14L︰10D]。繁殖一代后用于实验。不同发育时期(5个不同龄期若虫及雌、雄成虫)及不同部位(头、胸、腹)的样品在体视显微镜(SZ60,奥林巴斯,日本)下进行采集。选取 5龄新羽化若虫,分别于 4、26、36℃下饲养 1 h,并于26℃下恢复1 h后采集,作为不同温度处理的样品备用。选取 4龄新生若虫,分别于不同光照时间(0L︰24D,14L︰10D,24L︰0D)下饲养2 d后采集,作为不同光照处理的样品备用。上述样品均保存于–80℃冰箱中。每个处理3个生物学重复。
1.2 总RNA提取与cDNA的合成
使用 Promega总 RNA提取试剂盒(SV Total RNA Isolation System,Progema)提取总RNA。使用NANODROP 2000c测定RNA的浓度及质量。利用反转录试剂盒(PrimeScript™ RT Master Mix,TaKaRa)反转录获得 cDNA 第一链。利用 SMARTer®RACE 5′/3′ Kit(TaKaRa)试剂盒进行 RACE所用cDNA的合成。
1.3 Eocyp基因序列全长克隆
根据本实验室小贯小绿叶蝉转录组数据,得到 1个小贯小绿叶蝉半胱氨酸蛋白酶基因片段转录本序列,根据此序列分别设计RACE引物(表1),以RACE所用cDNA为模板进行 PCR,反应体系为:2×PrimerSTAR Max Premix( TaKaRa, Tokyo, Japan) 20 µL ,10×Universal Primer A Mix(UPM)4 µL,5′或 3′基因特异引物(GSP)1 µL,cDNA模板1 µL,补充ddH2O至40 µL。克隆采用巢式PCR技术,反应条件为:94℃变性 30 s,68℃退火30 s,72℃延伸90 s,25个循环。之后进行PCR产物的纯化与回收,并以PMD-19T为载体进行连接,成功转化到大肠杆菌后委托南京金斯锐科技有限公司进行测序。将测序得到的结果使用 DNAman进行序列拼接,获得全长后对其开放阅读框(ORF)设计引物(表1),进行 PCR重复上述实验步骤,验证所获得的全长序列。
1.4 生物信息学分析
推导得到的氨基酸序列在 NCBI上进行同源比对(https://blast.ncbi.nlm.nih.gov/Blast);利用ProtParam(http://web.expasy.org/ protparam)进行蛋白理化性质预测,利用 ScanProsite(http://prosite.expasy.org/prosite.html)预测蛋白功能结构域;利用SignalP(http://www.cbs.dtu.dk/services/SignalP)进行信号肽的预测;利用DNAman进行多序列比对;使用MEGA7软件,采用邻接法(Neighbor-Joining,NJ)构建系统发育树,各分支重复检验次数均为1 000。
1.5 小贯小绿叶蝉Eocyp表达特征分析
使用 FastStart Essential DNA Green Master(Roche)试剂盒进行荧光定量分析。定量检测引物详见表1,以小贯小绿叶蝉18 S基因为内参基因。相对表达量通过 2-ΔΔCT法进行计算。利用SPSS 22.0软件,采用单因素方差分析法对差异显著性进行分析。

表1 引物信息Table 1 Information of Primers
2 结果与分析
2.1 Eocyp基因克隆、序列验证及分析
利用 RACE技术对Eocyp(GenBank登录号:MH036890)的 3′和 5′端进行扩增,分别得到800 bp和1 600 bp左右(图1)的特异性条带,使用DNAman软件将测序结果与转录组数据进行拼接得到长为 2 144 bp的cDNA序列,根据拼接序列设计引物(表1)扩增出1条1 772 bp的片段(图1)。该片段包含 ORF 1 656 bp(图2),编码 551个氨基酸,具有由24个氨基酸残基组成的信号肽。预测其分子式为 C2782H4163N737O835S25;相对分子量为 62 094.59;理论等电点为 6.02;不稳定系数为 36.10,表明该蛋白状态稳定;总平均亲水系数为–0.493,表明该蛋白为疏水性蛋白。由MotifScan分析表明,该蛋白具有半胱氨酸蛋白酶基因的催化三联体结构,即半胱氨酸活性位点 Cys357(351~362 QSVCGS CWSFGT),组氨酸活性位点 His499(497~507 LDHAVLLVGYG)和天冬酰胺活性位点 Asn519(514~533 YWLVKNSW SNYWGNDGYILM),同时具有GCDGG簇等保守结构域。

图1 Eocyp基因RACE克隆及全长验证Fig. 1 RACE and full-length cDNA clone of Eocyp
2.2 Eocyp基因进化树分析
将Eocyp编码的氨基酸序列在 GenBank中进行检索,并与其他已登录的昆虫Cyp序列进行比对,通过MEGA7软件采用邻接法构建进化树。结果表明(图 3),小贯小绿叶蝉Eocyp与半翅目昆虫茶翅蝽(H. halys)和温带臭虫(Cimex lectularius)聚为一支,膜翅目昆虫小蜜蜂(Apis florea),北美大黄蜂(Bombus impatiens)等聚为一支。等翅目昆虫古白蚁(Zootermopsis nevadensis)单独聚为一支,而鞘翅目昆虫(Nicrophorus vespilloides)与双翅目果蝇属等昆虫聚为一支。
2.3 Eocyp基因在不同发育时期的表达分析
Eocyp基因在小贯小绿叶蝉不同发育时期的表达结果详见图4。结果表明,Eocyp在小贯小绿叶蝉所有发育时期均有表达,从若虫到成虫的发育过程中,Eocyp的表达量表现为先升高后降低的趋势,5龄若虫表达量显著高于其他龄期,而 1龄若虫和雄成虫表达量最低,显著低于其他若虫生长阶段。由此推测Eocyp基因可能在小贯小绿叶蝉的若虫发育阶段发挥作用。

图2 小贯小绿叶蝉Eocyp基因的cDNA序列及推导的氨基酸序列Fig. 2 The cDNA and deduced amino acid sequence of Eocyp in E. onukii
2.4 Eocyp基因在不同部位的表达分析
Eocyp在小贯小绿叶蝉雌成虫头部的表达量显著低于胸部和腹部(图5-A),而Eocyp在雄成虫胸部的表达量显著低于头部和腹部(图5-B)。
2.5 光照和温度对Eocyp基因表达量的影响
不同温度和不同光照处理对Eocyp的相对表达量都没有显著影响(图6)。
3 讨论

图3 Eocyp系统发育分析Fig. 3 Phylogenetic analysis of Eocyp
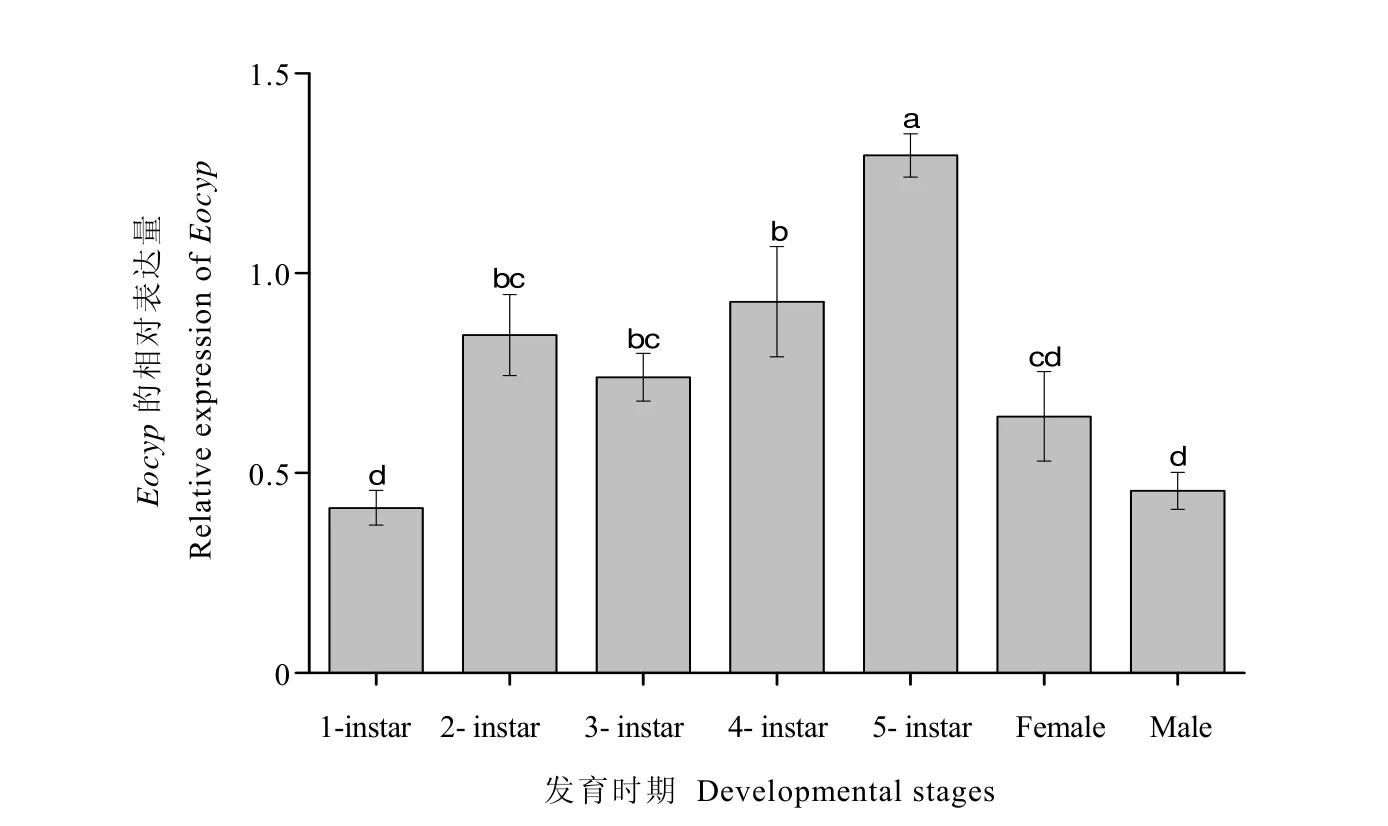
图4 Eocyp在小贯小绿叶蝉不同发育阶段的相对表达量Fig. 4 Relative expression levels of Eocyp in different developmental stages of E. onukii

图5 小贯小绿叶蝉Eocyp不同部位的相对表达量Fig. 5 Relative expression levels of Eocyp in different parts of adults of E. onukii

图6 小贯小绿叶蝉Eocyp在不同温度(A)和不同光照(B)条件下的相对表达量Fig. 6 Expression levels of Eocyp under different temperatures (A) and different photoperiods (B)
本研究克隆到 1条小贯小绿叶蝉半胱氨酸蛋白酶基因的全长序列,命名为Eocyp,由该基因编码的蛋白具有半胱氨酸蛋白酶基因的催化三联体结构和 GCDGG簇等保守结构域(图 2)。将由该基因编码的氨基酸序列与已报道的其他昆虫半胱氨酸蛋白酶的蛋白进行同源性比对分析,我们发现Eocyp与同为半翅目的茶翅蝽(Halyomorpha halys)(GenBank登录号:XP_014283673.1)半胱氨酸蛋白酶1同源性最高为65%;与麦茎蜂(Cephus cinctus)(XP_015586901.1)、内华达古白蚁(Zootermopsis nevadensis)(XP_021934297.1)及造纸胡蜂(Polistes dominula)(XP_015182850.1)中的 CYP同源率分别为63%、63%和61%,该结果进一步证明我们克隆获得的Eocyp为半胱氨酸蛋白酶基因。
Eocyp在小贯小绿叶蝉的整个发育过程中均有表达,且Eocyp在不同发育时期转录水平上的表达量存在一定差异,暗示Eocyp在叶蝉的不同发育阶段可能发挥着不同的作用,这一现象在其他昆虫中已见报道。例如,甘蓝地种蝇(Delia radicum)的半胱氨酸蛋白酶DrCP1在幼虫向蛹转化时期的表达量显著升高,说明该基因可能与幼虫变态化蛹有关[7]。有研究发现橘小实蝇Bdcyp在不同发育阶段皆有表达,但是主要集中在蛹期,由此推测Bdcyp在其变态发育过程中可能具有重要作用[20]。与之相似,本研究发现Eocyp的表达量由 1龄若虫发育到 5龄若虫的过程中逐步升高,这说明Eocyp对小贯小绿叶蝉若虫的生长发育具有重要作用;Eocyp在5龄若虫期的表达量显著高于雌、雄成虫的现象,说明该基因在小贯小绿叶蝉由若虫向成虫发育转变的过程中亦具有重要作用。Eocyp在成虫头部的表达量显著低于胸部和腹部,而Eocyp在雄成虫胸部的表达量显著低于头部和腹部,这说明该基因可能在小贯小绿叶蝉不同雌、雄成虫中具有相似且不同的功能。这与花绒寄甲(Dastarcus helophoroidesFairmaire)中发现的现象基本一致[21],但是Dahel caspase-1还被发现与老细胞凋亡和新细胞形成及成虫衰老相关,Eocyp是否具有上述功能还需进一步研究。但是,光照及温度变化不影响Eocyp的相对表达量。需要说明的是,本文仅从转录水平上对Eocyp在小贯小绿叶蝉不同发育阶段、不同组织部位,以及不同非生物胁迫处理下的表达量进行分析,并在此基础上进行功能推测,但是该基因到底具有何种生物学功能尚需利用 RNAi技术进行深入研究。
[1] Berti P J, Storer A C. Alignment/phylogeny of the papain superfamily of cysteine proteases [J]. Journal of Molecular Biology, 1995, 246(2): 273-283.
[2] Chernaya V I. Early Postnatal Development-related dynamics of the activity of cathepsin l in rat brain structures[J]. Neurophysiology, 2001, 33(1): 15-18.
[3] Barros N M, Puzer L, Tersariol I L, et al. Plasma prekallikrein/kallikrein processing by lysosomal cysteine proteases [J]. Biological Chemistry, 2004, 385(11):1087-1091.
[4] Cristofoletti P T, Ribeiro A F, Deraison C, et al. Midgut adaptation and digestive enzyme distribution in a phloem feeding insect, the pea aphidAcyrthosiphon pisum[J].Journal of Insect Physiology, 2003, 49(1): 11-24.
[5] Rabossi A, Stoka V, Puizdar V, et al. Novel aspartyl proteinase associated to fat body histolysis duringCeratitis capitataearly metamorphosis [J]. Archives of Insect Biochemistry & Physiology, 2004, 57(2): 51-67.
[6] Zhao X, An X, Wang J, et al. Expression of theHelicoverpa cathepsinb-like proteinase during embryonic development[J]. Arch Insect Biochem Physiol, 2005, 58(1): 39-46.
[7] Liu J, Shi G P, Zhang W Q, et al. Cathepsin L function in insect moulting: molecular cloning and functional analysis in cotton bollworm,Helicoverpa armigera[J]. Insect Molecular Biology, 2006, 15(6): 823-834.
[8] Beton D, Guzzo C R, Ribeiro A F, et al. The 3D structure and function of digestive cathepsin L-like proteinases ofTenebrio molitorlarval midgut [J]. Insect Biochemistry &Molecular Biology, 2012, 42(9): 655-664.
[9] L F Wang, L Q Chai, He H J, et al. A cathepsin L-like proteinase is involved in moulting and metamorphosis inHelicoverpa armigera[J]. Insect Molecular Biology, 2010,19(1): 99-111.
[10] Kwangsik L, Boyeon K, Youngmoo C, et al. Expression profile of cathepsin B in the fat body ofBombyx moriduring metamorphosis [J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 2009, 154(2):188-194.
[11] Yu J, Wu F Y, Zou F M, et al. Identification of ecdysone response elements (EcREs) in theBombyx moricathepsin D promoter [J]. Biochemical & Biophysical Research Communications, 2012, 425(1): 113-118.
[12] Cai X Y, Yu J, Yu H Y, et al. Core promoter regulates the expression of cathepsin B gene in the fat body ofBombyx mori[J]. Gene, 2014, 542(2): 232-239.
[13] 苏晶晶, 陈思源, 张奎, 等. 家蚕组织蛋白酶O (BmCatO)基因鉴定及表达分析[J]. 中国农业科学, 2015, 48(22):4564-4573.
[14] Wu F, Kang L, Wang P, et al. The expression analysis of cysteine proteinase-like protein in wild-type and nm2 mutant silkworm (Lepidoptera:Bombyx mori) [J]. Gene, 2016,586(1): 170-175.
[15] Peter M, Turnšek N, Gašparič MB, et al. A complex of genes involved in adaptation ofLeptinotarsa decemlineatalarvae to induced potato defense[J]. Arch Insect Biochem Physiol,2012, 79(3): 153-181.
[16] 赵冬香, 陈宗懋, 程家安. 茶小绿叶蝉优势种的归属[J].茶叶科学, 2000, 20(2): 101-104.
[17] 王念武, 徐金汉, 陈峥, 等. 不同茶园假眼小绿叶蝉抗药性比较[J]. 福建农业大学学报, 2004(2): 169-173.
[18] 庄家祥, 傅建炜, 苏庆泉, 等. 福建省茶小绿叶蝉抗药性的地区差异[J]. 茶叶科学, 2009, 29(2): 154-158.
[19] Bolter C, Jongsma M A. The adaptation of insect to plant protease inhibitors [J]. Journal of Insect Physiology. 1997,43(10): 885-895.
[20] 杨文佳, 许抗抗, 王进军, 等. 橘小实蝇半胱氨酸蛋白酶基因克隆及表达模式[J]. 中山大学学报(自然科学版),2017, 56(1): 131-137.
[21] 宋旺. 花绒寄甲Caspase-1基因的表达研究[D]. 杨凌: 西北农林科技大学, 2014.

