免疫亲和固相萃取-超高效合相色谱-串联质谱法同时测定牛奶中6种玉米赤霉醇类化合物残留
章璐幸, 孙洁胤, 王延辉, 吴惠芳, 俞松林
(浙江医药高等专科学校, 宁波,315100)
霉菌毒素对食物的污染已引起了人们的广泛关注。玉米赤霉烯酮(ZON)是一种由镰刀菌素产生的非甾体类霉菌毒素[1,2]在自然界中主要污染玉米、小麦、大麦、高粱、小米等作物[1]。当奶牛食用了被玉米赤霉烯酮污染的饲料后,易在体内代谢生成α-玉米赤霉烯醇(α-ZOL)和β-玉米赤霉烯醇(β-ZOL),进而转移到牛乳中[3]。另外,在奶牛饲养过程中为了让其增重,不法商贩将α-玉米赤霉醇(α-ZAL)用作生长促进剂[4],同时α-ZAL在体内会代谢生成β-玉米赤霉醇(β-ZAL)和ZON[5]。研究表明,玉米赤霉醇类化合物(α-ZAL、β-ZAL、α-ZOL、β-ZOL、ZON和玉米赤霉酮(ZAN))具有弱雌激素效应,当其通过食物链进入人体后,可引起人体机能紊乱,甚至影响生育[6]。欧盟规定玉米赤霉醇等激素类药物禁止用于畜禽养殖中[7];我国农业部于2002年规定玉米赤霉醇在食品动物中不得检出[8]。
目前对动物源食品中玉米赤霉醇类化合物残留的主要检测方法有酶联免疫吸附法[9]、胶体金免疫层析法[10]、气相色谱-质谱联用法(GC-MS)[11]、高效液相色谱法(HPLC)和超高效液相色谱法(UPLC)及其联合各种检测器如紫外(UV)[12]、荧光(FL)[13,14]、质谱(MS)等。酶联免疫吸附法和胶体金免疫层析法可能存在假阳性结果[6]; GC-MS需将样品衍生化,操作较为繁琐;HPLC、HPLC(UPLC)-MS/MS因其成熟稳定的技术应用较多[15,16],但有机溶剂消耗量较大。超高效合相色谱(UPC2)是基于超临界流体色谱的技术体系[17],该体系以超临界CO2为主要组成,可以和任意有机溶剂混合组成流动相,依靠流动相的溶剂化能力进行分离分析。与液相色谱相比,UPC2具有黏度低、分子扩散快、分离效率高、绿色环保的优势[18]。
进行痕量检测时要尽可能地降低背景干扰,因此对样品前处理的要求相对较高。常见的前处理方法有液液萃取法(LLE)[1]、固相萃取法(SPE)[19]等。但LLE需要使用大量的有机溶剂,操作繁琐,费时费力;SPE因其具有有机溶剂使用量小、吸附容量大、分离快速等特点,已成为最常用的萃取手段之一。目前常用于测定玉米赤霉醇类化合物的SPE柱有混合型阴离子交换柱(MAX柱)[20]和亲水亲脂平衡柱(HLB柱)[21,22]等,但因其不能选择性的吸附目标分子,在痕量药物测定过程中可能会引入干扰物。免疫亲和柱(IAC)是基于抗原抗体免疫反应原理制成的[23,24],具有较强的专属性,较好的净化富集效率,在真菌毒素残留检测方面应用较多[25]。Kong等[13]用IAC结合HPLC-FLD和HPLC-MS/MS对国内100多种食品和药用植物中痕量玉米赤霉醇和玉米赤霉烯酮进行了检测。孙雪等[2]采用复合免疫亲和柱净化,结合高效液相色谱-串联质谱,建立了动物源食品中6种黄曲霉毒素和6种玉米赤霉醇类残留量的测定方法。
本文采用免疫亲和固相萃取结合UPC2-MS/MS,建立了同时测定牛奶中α-玉米赤霉醇、β-玉米赤霉醇、α-玉米赤霉烯醇、β-玉米赤霉烯醇、玉米赤霉酮和玉米赤霉烯酮残留的检测方法,为测定乳制品中残留的玉米赤霉醇类药物提供方便环保、快速准确的新途径,同时也为评价乳制品品质提供了数据参考,为保障我国食品安全提供新思路与新方法。
1 实验部分
1.1 仪器、试剂与材料
ACQUITY UPC2超高效合相色谱仪,包括合相色谱管理器、四元溶剂管理器、柱温箱管理器、样品管理器、Xevo TQD三重四极杆质谱检测器、溶剂补偿泵(美国Waters公司); 高速离心机(德国Eppendorf公司);超纯水系统(美国PALL公司);十万分之一分析天平(美国梅特勒公司);涡旋仪(其林贝尔仪器制造有限公司);氮吹仪(上海泉岛公司)。
IAC-SEP免疫亲和柱(500 ng/1 mL,北京中检维康技术有限公司);甲醇和乙腈(美国Tedia公司);其他试剂均为分析纯。α-ZAL、β-ZAL、α-ZOL、β-ZOL、ZAN和ZON标准品(纯度>98%)购自澳大利亚政府国家计量研究所。6种具有代表性品牌的牛奶购自本地超市。
1.2 标准溶液的配制
精密称取适量6种标准品,用甲醇溶解并稀释成100 μg/mL的标准储备液,置于-20 ℃冰箱避光保存。
精密移取上述标准储备液各1 mL,置于100 mL容量瓶中,用甲醇稀释,配制成质量浓度为1 μg/mL的混合标准溶液,置于-20 ℃冰箱避光保存。
1.3 样品前处理
精密吸取牛奶20 mL,置于50 mL离心管中,加入20 mL去离子水,涡旋混匀,然后以8 000 r/min离心10 min,精密移取下层清液30 mL,置于干净烧杯中,为样品溶液,备用。
于-3 ℃冰箱中取出免疫亲和柱,置于室温,将柱内保护液放干,然后连接在20 mL玻璃注射器下,精密量取20 mL上述样品溶液,注入玻璃注射器,以1滴/s的流速缓慢通过免疫亲和柱,直至部分空气通过,再以1~2滴/s的流速用20 mL去离子水淋洗柱子,弃去全部淋洗液,并使部分空气通过,最后用2.0 mL 0.1%(v/v)乙酸甲醇溶液洗脱,收集洗脱液,用氮气吹干(50 ℃),用0.5 mL甲醇复溶,过0.22 μm有机滤膜。
1.4 分析条件
色谱柱:ACQUITY UPC2Torus 2-PIC柱(50 mm×3.0 mm, 1.7 μm);柱温:25 ℃;流动相:(A)超临界CO2和(B)0.1%(v/v)甲酸甲醇溶液;流速:1 mL/min。梯度洗脱条件:0~1 min, 0%B; 1~2 min, 5%B~10%B; 2~4 min, 10%B~15%B; 4~6 min, 15%B~0%B; 6~7 min, 0%B。背压:17.2 MPa;进样量:2 μL。离子源:ESI-;离子源温度:150 ℃;毛细管电压:2.0 kV;锥孔电压:50 V;脱溶剂气温度:450 ℃;脱溶剂气体流速:800 L/h;锥孔气体流速:50 L/h;补偿溶剂:含0.2%(v/v)氨水的甲醇溶液;流速:0.2 mL/min;在选择离子监测模式下6种玉米赤霉醇类化合物的质谱参数见表1。
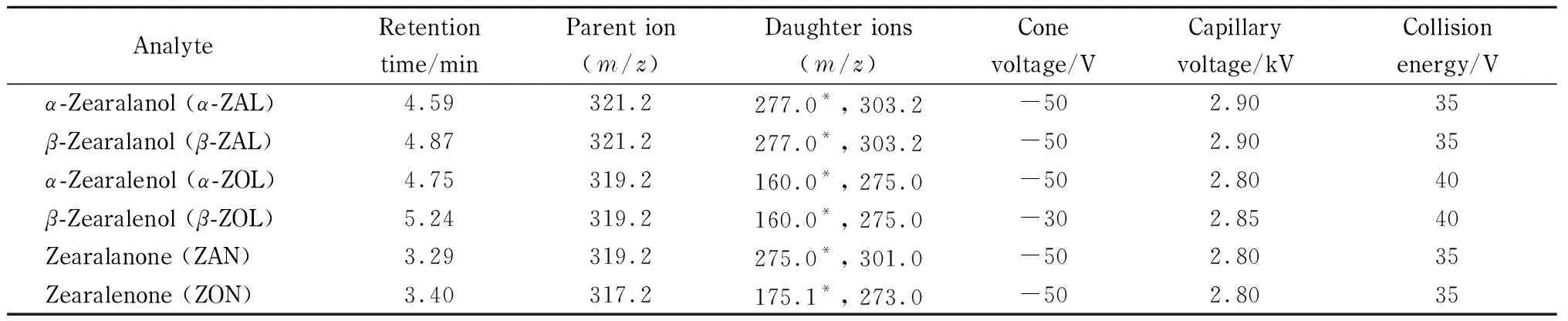
表 1 6种玉米赤霉醇类化合物的质谱参数
* Quantitative ion.
2 结果与讨论
2.1 色谱条件的优化
2.1.1色谱柱的优化
6种玉米赤霉醇类化合物中α-ZAL和β-ZAL、α-ZOL和β-ZOL是两组同分异构体,这给色谱分离带来了一定难度。本实验考察了3种不同填料的ACQUITY UPC2色谱柱(BEH柱(50 mm×2.1 mm, 1.7 μm)、HSS C18柱(100 mm×2.1 mm, 1.8 μm)和Torus 2-PIC柱(50 mm×3.0 mm, 1.7 μm))对6种玉米赤霉醇类化合物分离效果的影响(见图1)。HSS C18色谱柱的填料为全多孔硅胶基质,与常规C18柱选择性相近;BEH色谱柱的填料为亚乙基桥杂化颗粒;Torus 2-PIC色谱柱的填料为二氨甲基吡啶键合改进的亚乙基桥杂化颗粒,具有较强的选择性。如图1所示,采用BEH柱和HSS C18柱时,6种玉米赤霉醇类化合物无法分离;采用Torus 2-PIC柱时,6种玉米赤霉醇类化合物可达到基线分离。因此实验选用Torus 2-PIC色谱柱。
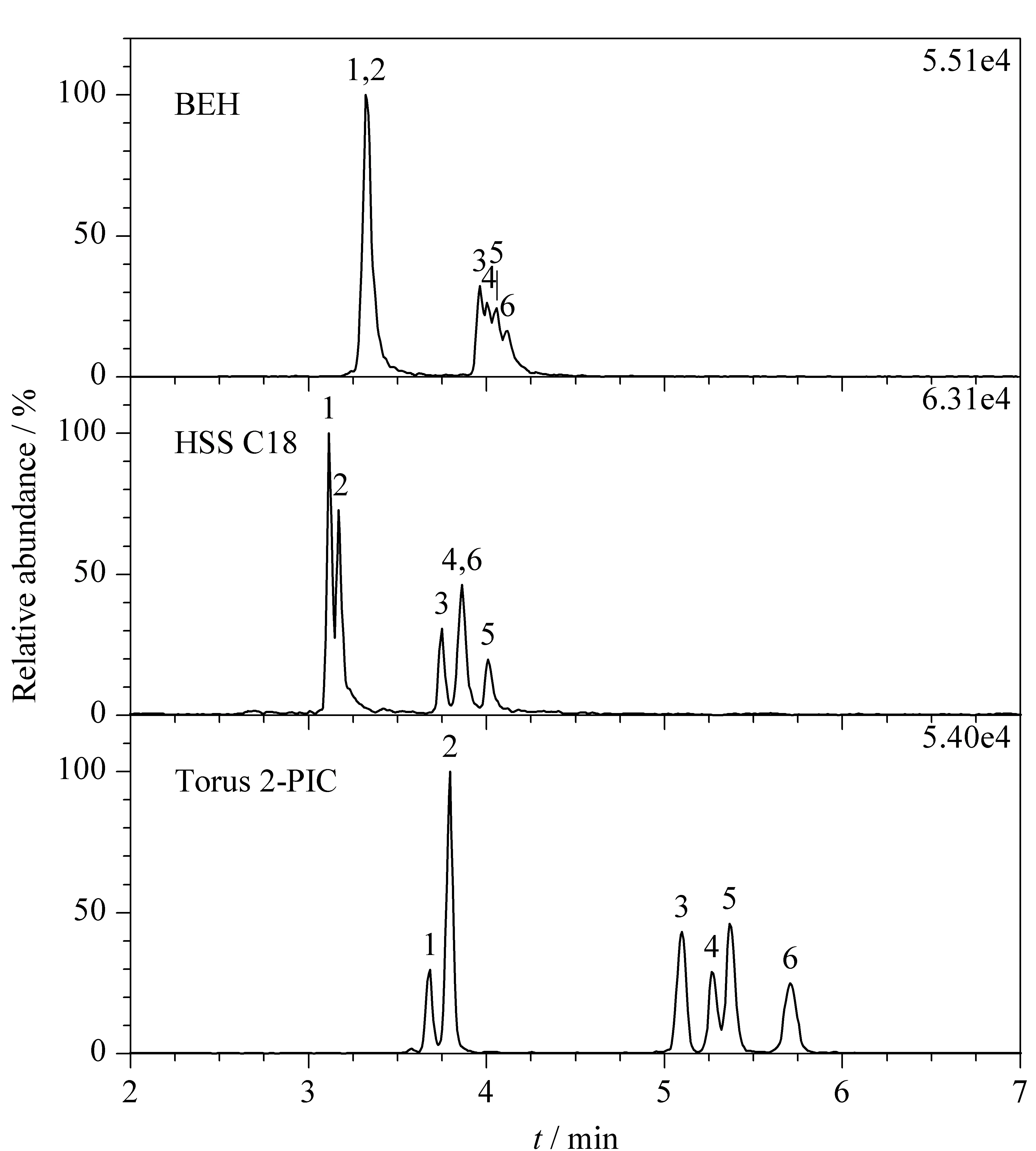
图 1 采用不同色谱柱时6种玉米赤霉醇类化合物的色谱图Fig. 1 Chromatograms of the six zeranols using different columns1. ZAN; 2. ZON; 3. α-ZAL; 4. α-ZOL; 5. β-ZAL; 6. β-ZOL.
2.1.2共溶剂的优化
在合相色谱上,共溶剂有两个作用,一是提高CO2的溶解力,二是可作为强洗脱溶剂,通过调节共溶剂的种类和比例可改变化合物的保留行为和峰形。为了获得较好的色谱峰峰形和响应强度,考察了几种合相色谱上常用的共溶剂:甲醇、异丙醇、甲醇-乙腈(1∶1, v/v)和乙腈。结果表明,采用甲醇时,目标化合物的分离效果良好;其余几种共溶剂不能完全分离6种玉米赤霉醇类化合物。
在向合相色谱系统中加入添加剂可改善色谱峰峰形及分离度。因此在共溶剂甲醇中添加体积分数为0.05%、0.1%、0.2%的甲酸,考察目标化合物的分离情况。当甲酸的体积分数为0.1%时,目标化合物的色谱峰峰形最尖锐;当甲酸的体积分数为0.2%时,目标化合物的离子响应减弱,可能是过高的酸度导致了离子化效果的抑制。因此实验选择0.1%(v/v)甲酸甲醇溶液作为共溶剂。
2.1.3系统背压的优化
通过背压的调节可以改变超临界流体的密度,从而影响目标化合物的保留时间。实验考察了不同背压(10.0、13.8、17.2、20.7 MPa)对分离效果的影响。随着背压的升高,CO2密度增大,流动相的洗脱能力增强,各化合物保留时间逐渐缩短。当背压为17.2 MPa时,目标物的保留时间和分离度均较好;当背压升至20.7 MPa时,整个系统压力偏大,且目标化合物的分离度有所减弱。因此实验选择17.2 MPa作为系统背压。
2.1.4柱温的优化
与液相色谱相比,柱温对合相色谱在保留行为上的影响是相反的,柱温的升高可使化合物的保留时间延长。这是因为升高温度会使流动相的密度减弱,洗脱能力降低,从而保留时间延长。实验考察了不同柱温(20、25、30、35 ℃)对目标化合物分离效果的影响。当柱温升高时,6种玉米赤霉醇类化合物的峰形展宽,保留时间延长,响应强度降低。综合考虑分离度和保留时间等因素,实验选择25 ℃作为色谱柱柱温。
2.1.5补偿溶剂的影响
不同的补偿溶剂对化合物的离子化效果会产生明显影响。实验通过比较无补偿溶剂和不同补偿溶剂(甲醇、含0.1%(v/v)氨水的甲醇、含0.2%(v/v)氨水的甲醇)对分离效果的影响。在0.2 mL/min的流速下,观察目标物的响应值。结果表明,有补偿溶剂时目标化合物的响应值明显高于无补偿溶剂时目标化合物的响应值,且含0.2%(v/v)氨水的甲醇作为补偿溶剂时目标化合物的响应值最大。
在优化后的色谱条件下6种玉米赤霉醇类化合物的提取离子色谱图见图2。
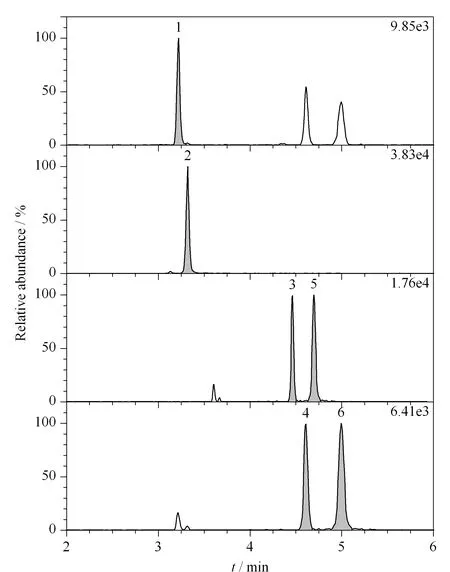
图 2 6种玉米赤霉醇类化合物的提取离子色谱图Fig. 2 Extracted ion chromatograms of the six zeranols1. ZAN; 2. ZON; 3. α-ZAL; 4. α-ZOL; 5. β-ZAL; 6. β-ZOL.
2.2 前处理条件的优化
2.2.1提取净化方法的选择
实验考察了不同的提取净化方法对目标化合物回收率的影响。采用农业部1025号公告[26]中提到的方法,用18%(v/v)硫酸溶液对牛奶中玉米赤霉醇类化合物进行沉淀蛋白质,再用正己烷和乙腈分离提取,最后用NaOH反萃取后过免疫固相萃取柱,玉米赤霉醇类化合物的提取回收率较低,为58.3%~72.4%;采用乙腈直接沉淀蛋白质的方法对目标化合物进行处理,提取回收率反而更低,为39.8%~65.4%。考虑免疫亲和柱中的固定相主要以蛋白质的形式(抗体)存在,其状态最佳时的pH范围在7.4左右,且有机溶剂的含量需保持在20%以下。因此以上两种方法待净化溶液的pH及有机溶剂的含量对免疫亲和柱中的抗体产生了影响,降低了其富集目标化合物的能力。另外在沉淀蛋白质的同时可能将目标物包裹着一起沉淀,导致提取回收率降低。最后决定对牛奶样品不沉淀蛋白直接过免疫亲和柱。已有文献[27]表明,牛奶样品如果直接过柱,其中含有的脂肪会掩盖抗体,导致回收率偏低,且不经稀释的牛奶样品过于黏稠,会发生柱子堵塞等问题,因此将牛奶和水按体积比1∶1稀释,经8 000 r/min离心后,移取下清液直接过柱,目标化合物的回收率为72.3%~102.1%,因此实验选择此方法作为提取净化方法。
2.2.2上样量的优化
由于牛奶中玉米赤霉醇类化合物的含量极低,因此有必要将残留物富集浓缩,以达到检测器灵敏度的要求。实验比较了不同质量浓度(0.5、1.0、5.0 ng/mL)的上样液在不同上样体积(5、10、20 mL)的条件下对目标化合物回收率的影响。当上样体积为20 mL时,6种目标化合物在3个浓度水平下的提取回收率均能达到75%以上。因此实验选择20 mL作为上样体积。
2.2.3淋洗溶剂的优化
为了尽可能减少干扰物对系统基质和目标物的影响,实验分别选择去离子水、甲醇、乙腈为清洗溶剂,在用量均为20 mL的条件下进行提取回收试验,添加水平为1.0 ng/mL。结果表明,去离子水对6种玉米赤霉醇类化合物的回收率几乎无影响,均在75%以上,而当乙腈和甲醇作为清洗剂时,目标化合物的回收率下降到20%以下。因此实验选择去离子水为清洗剂,用量为20 mL。
2.2.4洗脱溶剂的优化
在固相萃取过程中,将目标物最大限度的洗脱下来是整个固相萃取的关键。实验考察了甲醇、乙腈、1%(v/v)乙酸甲醇、1%(v/v)乙酸乙腈4种洗脱溶剂对目标化合物(添加水平为1.0 ng/mL)提取回收率的影响。结果表明,用乙腈洗脱时,目标化合物的回收率为33.3%~53.4%,且有轻微基线噪声变大的现象;用1%(v/v)乙酸乙腈洗脱时,回收率为45.1%~87.4%,基线噪声明显增大;当用甲醇洗脱时,α-ZOL的回收率为55.6%;当用1%(v/v)乙酸甲醇洗脱时,α-ZOL的回收率提高至75.3%,其余5种目标物的回收率均在82.0%以上。因此实验选择1%(v/v)乙酸甲醇溶液作为洗脱溶剂。
2.3 方法学考察
2.3.1线性范围、检出限和定量限
在1.4节条件下,对质量浓度为1、2、5、10、20、50、100、200 ng/mL的6种玉米赤霉醇类混合标准溶液进行测定,以峰面积为纵坐标(y)、对应的质量浓度(x, ng/mL)为横坐标绘制标准曲线(见表2)。结果表明,各化合物在其线性范围内呈现较好的线性关系,相关系数(r2)均≥0.995 7。以定量离子信噪比(S/N)≥3计算方法的检出限,为0.25~2.04 ng/mL,以S/N≥10计算方法的定量限,为0.51~5.10 ng/mL,可以看出,本方法的灵敏度整体上高于文献[28,29]报道的采用HPLC测定玉米赤霉醇类残留的方法(检出限为1~45 ng/mL,定量限为3.5~100 ng/mL),但略低于采用HPLC-MS/MS测定玉米赤霉醇类残留的方法(检出限为0.01~0.10 ng/mL,定量限为0.04~1.0 ng/mL)[1-3,5]。
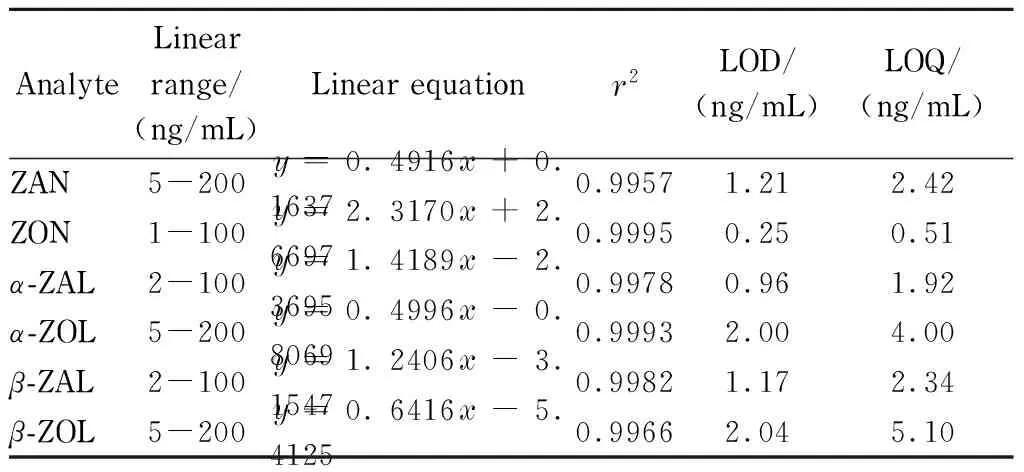
表 2 6种玉米赤霉醇类化合物的线性范围、线性方程、
y: peak area;x: mass concentration, ng/mL.
2.3.2基质效应(ME)的考察
取空白牛奶样品,按1.3节描述处理后,用1 mL系列混合标准溶液(1、2、5、10、20、50、100、200 ng/mL)溶解残渣,涡旋混匀,过0.22 μm滤膜,供测定。
将基质混合标准曲线和溶剂混合标准曲线的斜率分别记为K1和K2,根据公式(1)计算基质效应:
ME=(K1/K2-1)×100%
(1)
结果表明,牛奶基质中玉米赤霉醇类化合物的基质效应为-5%~7%,可以忽略不计,因此可用混合标准溶液做标准曲线,采用外标法定量。
2.3.3回收率
精密移取50、100、500 μL 1 μg/mL混合标准溶液,分别置于100 mL量瓶中,用空白牛奶稀释至刻度,即为加标水平为0.5、1.0、5.0 ng/mL的加标牛奶溶液,每个水平做3份平行样品,进行加标回收试验,具体结果见表3。由表3可知,牛奶基质中6种目标化合物的平均回收率为75.9%~106.5%,相对标准偏差为3.2%~12.3%,表明本法在样品前处理及测定中有较好的回收率和精密度,适用于牛奶基质中玉米赤霉醇类化合物残留的检测。
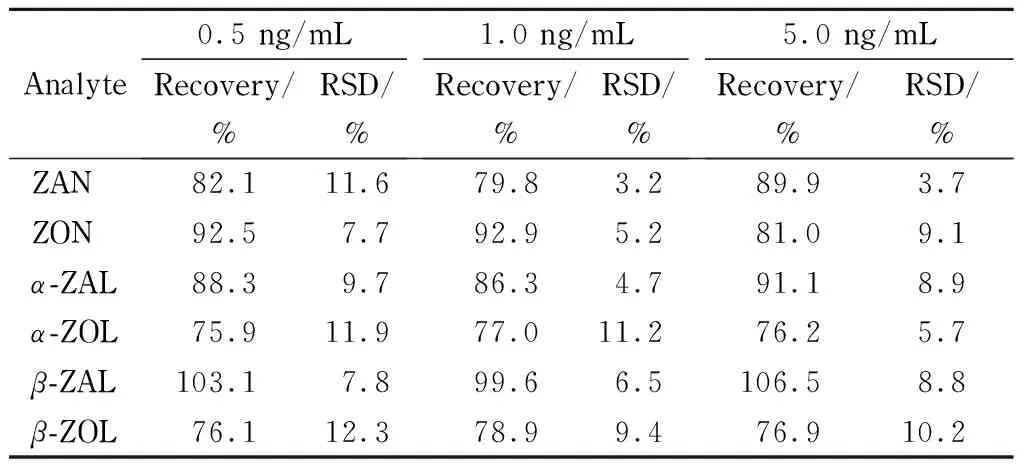
表 3 6种玉米赤霉醇类化合物的加标回收率和相对
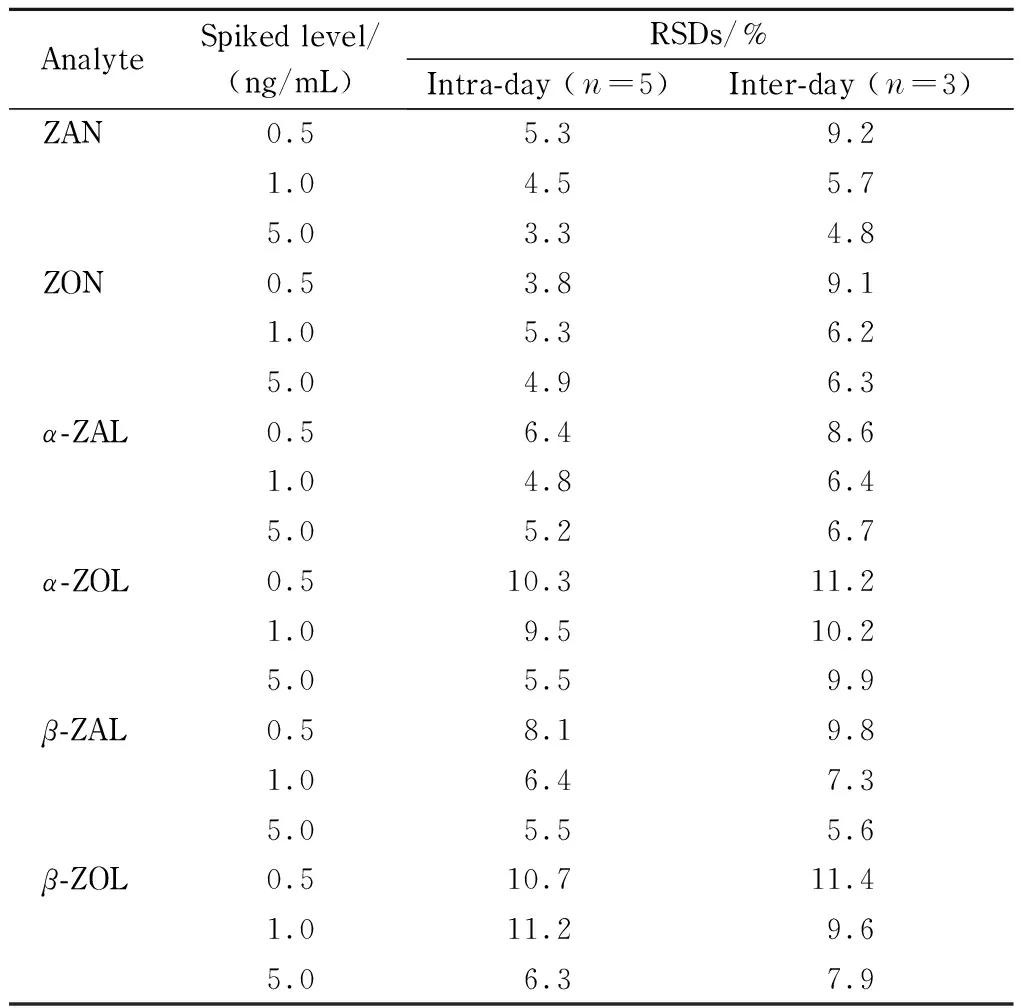
表 4 6种玉米赤霉醇类化合物的日内和日间精密度
2.3.4日内和日间精密度
按2.3.3节描述配制加标牛奶溶液,每个水平做5份平行样品,按1.3节方法制备样品溶液,连续测定3天,得到日内和日间精密度,结果见表4。由表4可知,6种玉米赤霉醇类化合物的日内精密度为3.3%~11.2%(n=5),日间精密度为4.8%~11.4%(n=3)。
2.3.5实际样品测定
在本地超市购买了6份国内不同牛奶企业生产的牛奶,对其进行测定,结果表明,其中一份样品含有玉米赤霉烯酮0.085 ng/mL,其余均未检出。阳性样品的色谱图见图3。
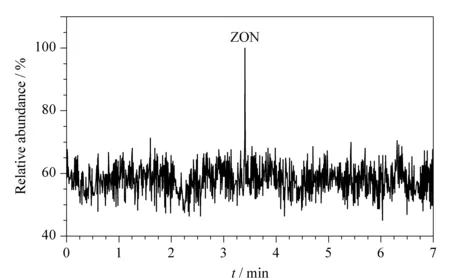
图 3 阳性样品的色谱图Fig. 3 Chromatograms of a positive sample
3 结论
建立了一种免疫亲和固相萃取结合UPC2-MS/MS同时测定牛奶中6种玉米赤霉醇类化合物残留的分析方法。该法专属性好,基质效应小,与传统固相萃取法相比前处理操作简单,快速,无有机溶剂的使用。
参考文献:
[1] Belhassen H, Jimenez-Diaz I, Ghali R, et al. J Chromatogr B, 2014, 962(1): 68
[2] Sun X, Xi C X, Tang B B, et al. Chinese Journal of Analytical Chemistry, 2016, 44(6): 970
孙雪, 郗存显, 唐柏彬, 等. 分析化学, 2016, 44(6): 970
[3] Han Z, Ren Y P, Zhou H L, et al. J Chromatogr B, 2011, 879(5/6): 411
[4] Zhu J, Ma G J, Ma X M. Food Research and Development, 2017, 38(6): 159
朱捷, 马桂娟, 马雪梅. 食品研究与开发, 2017, 38(6): 159
[5] Wang Q, Wang G M, Xi C X, et al. Chinese Journal of Chromatography, 2014, 32(6): 640
王清, 王国民, 郗存显, 等. 色谱, 2014, 32(6): 640
[6] Huang L C, Zheng N, Zheng B Q, et al. Food Chem, 2014, 146(1): 242
[7] 96/22/EC
[8] Ministry of Agriculture. No. 235 Bulletin of the Ministry of Agriculture of the People’s Republic of China. (2002-12-24)[2018-05-18]. http://www.foodmate.net/law/shipin/163968.html
农业部. 中华人民共和国农业部公告第235号. (2002-12-24)[2018-05-18]. http://www.foodmate.net/law/shipin/163968.html
[9] Yu T, Li D G, Deng N, et al. Food Science, 2013, 34(3): 184
余涛, 李大刚, 邓宁, 等. 食品科学, 2013, 34(3): 184
[10] Luo M E, Tang Y, Xiang J J, et al. Chinese Journal of Cellular and Molecular Immunology, 2013, 29(7): 729
骆敏儿, 唐勇, 向军俭, 等. 细胞与分子免疫学杂志, 2013, 29(7): 729
[11] Zhang W, Wang J P, Shen J Z, et al. Acta Veterinaria et Zootechnica Sinica, 2007, 38(5): 513
张伟, 王建平, 沈建忠, 等. 畜牧兽医学报, 2007, 38(5): 513
[12] You L N, Li X L, Xi C X, et al. Chinese Journal of Chromatography, 2012, 30(10): 1021
游丽娜, 李贤良, 郗存显. 色谱, 2012, 30(10): 1021
[13] Kong W J, Shen H H, Zhang X F, et al. J Sci Food Agric, 2013, 93(7): 1584
[14] Chen F F, Luan C L, Wang L, et al. J Sci Food Agric, 2017, 97(6): 1805
[15] Zhao Y, Wan L H, Bai X L, et al. Food Addit Contam A, 2017, 34(7): 1201
[16] Wang Q, Zhao H, Xi C, et al. Food Addit Contam A, 2014, 31(7): 1177
[17] Li B, Zhao H Y, Liu W, et al. Journal of Instrumental Analysis, 2015, 34(7): 813
李兵, 赵海燕, 刘伟, 等. 分析测试学报, 2015, 34(7): 813
[18] Xin X, New Chemical Materials, 2016, 44(5): 264
新型. 化工新型材料, 2016, 44(5): 264
[19] Capriotti A L, Cavaliere C, Foglia P, et al. J Chromatogr A, 2014, 1343(23): 69
[20] Capriotti A L, Cavaliere C, Piovesana S, et al. J Agric Food Chem, 2015, 63(40): 8940
[21] Xie J A, Liu B L. Food Safety and Quality Detection Technology, 2013, 4(1): 150
谢继安, 刘柏林. 食品安全质量检测学报, 2013, 4(1): 150
[22] Li L P, Fan S, Zhao R. Chinese Journal of Chromatography, 2013, 31(7): 703
李丽萍, 范赛, 赵榕. 色谱, 2013, 31(7): 703
[23] Lattanzio V M, Ciasca B, Powers S, et al. J Chromatogr A, 2014, 1354(8): 139
[24] Wilcox J, Donnelly C, Leeman D, et al. J Chromatogr A, 2015, 1400(26): 91
[25] Yan Z Y, Zhang X J, Li Q F, et al. Journal of Analytical Chemistry, 2015, 43(2): 277
严忠雍, 张小军, 李奇富, 等. 分析化学, 2015, 43(2): 277
[26] Ministry of Agriculture. No. 1025 Bulletin of the Ministry of Agriculture of the People’s Republic of China. (2008-04-29) [2018-05-18]. http://down.foodmate.net/standard/sort/9/17237.html
农业部. 中华人民共和国农业部第1025号公告. (2008-04-29) [2018-05-18]. http://down.foodmate.net/standard/sort/9/17237.html
[27] Wu N, Jiang J D, Tao D L, et al. Journal of Instrumental Analysis, 2013, 32(3): 389
吴楠, 姜金斗, 陶大利, 等. 分析测试学报, 2013, 32(3): 389
[28] Wang Q, You L N, Li X L, et al. Science and Technology of Food Industry, 2013, 34(17): 298
王清, 游丽娜, 李贤良, 等. 食品工业科技, 2013, 34(17): 298
[29] Hsieh H Y, Shyu C L, Liao C W, et al. J Sci Food Agric, 2012, 92(6): 1230

