毛细管电泳结合压力辅助电动进样测定水样中4种酚类雌激素
高芳芳, 刘军英, 鹿文慧, 李金花*, 刘惠涛
(1. 烟台大学化学化工学院, 山东 烟台 264005; 2. 中国科学院烟台海岸带研究所,中国科学院海岸带环境过程与生态修复重点实验室, 山东 烟台 264003)
酚类雌激素(phenolic estrogens, PEs)是指结构中含有酚基且具有类雌激素效应的化合物,由于其具有较高的脂溶性,极易被生物体富集,威胁生态系统,严重危害人类健康和发展,从而成为人们重点关注的对象[1]。己烷雌酚(HS)、双烯雌酚(DS)、己烯雌酚(DES)和双酚A(BPA)4种PEs被广泛应用于促进畜禽生长,提高牛奶产量,增加瘦肉率等[2]。双酚A作为环氧树脂等工业原料的前体物质,是最常见的内分泌干扰物之一[3,4]。此外,已经证明PEs广泛存在于环境中的水体、沉积物等基质中[5,6],在环境基质中的含量在0~10 ng/g范围内,在污水中的含量更高[7]。PEs可以通过食物链进入人体,使人体的代谢紊乱,破坏生理平衡,甚至癌变[8,9]。PEs的含量在几ng/L的质量浓度水平就会对人体的代谢产生影响[10]。很多国家和地区已经规定了这类雌激素在水体中的最大残留量为0.1 μg/L或者更低的质量浓度。因此,快速准确地检测这类化合物是十分必要的。
目前,检测PEs的方法主要有高效液相色谱[11,12]、气相色谱[13]、毛细管电泳(CE)[14]及免疫法[15]等。近年来,CE以其柱效高、分析速度快、试剂消耗少等特点发展迅速,已广泛应用于各个领域[16]。然而,由于CE进样量少,紫外检测器的光程短,因此检测的灵敏度较低[17]。CE的在线富集技术是其特有的富集方法,只需对样品溶液和仪器进行适当的调整,即可实现样品的在线堆积,操作简便[18,19]。压力辅助电动进样(pressure-assisted electrokinetic injection, PAEKI)是通过调节给定电压下的压力或者是给定压力下的电压来使毛细管内的电渗流保持平衡,在此状态下,再采用电动进样[20]。目前,CE-PAEKI已被广泛用于砷、硒等的形态分析[21],精氨酸、咪唑的分析[22],以及人工尿液中维替泊芬药物的手性拆分和检测[23]等。
我们拟以HS、DS、DES和BPA这4种PEs为研究对象,采用PAEKI的在线富集方式实现其在毛细管入口端的堆积富集,提高CE-UV的灵敏度[24]。对影响富集效果的条件进行优化,包括进样电压、进样时间、注入水柱的选择等[25,26]。相较于普通的压力进样,该PAEKI法简单、快速,可以得到较高的富集倍数和更低的检出限。我们采用胶束电动色谱(MEKC)模式进行了电泳分离[27],结合PAEKI,实现了对自来水和湖水中4种PEs的同时高效测定,为雌激素的痕量分析提供了一种快速、准确、灵敏的分析方法。
1 实验部分
1.1 仪器、试剂与材料
P/ACE MDQ CE毛细管电泳仪(美国贝克曼公司),检测器为二极管阵列检测器;裸熔融石英毛细管(内径75 μm,外径375 μm,总长50.2 cm,有效分离长度40 cm)(河北永年光导纤维厂);雷磁PHs-3C型pH计(上海精密科学仪器有限公司); TG16-WS台式高速离心机(湖南湘仪实验室仪器开发有限公司);电子天平(赛多利斯科学仪器(北京)有限公司)。
HS、DS、DES、BPA 4种PEs的标准品(纯度不低于98%)均购自西格玛奥德里奇(上海)贸易有限公司。十二烷基硫酸钠(SDS)购自上海阿拉丁公司。色谱级乙腈和甲醇购自北京百灵威化学公司;其他化学试剂如氢氧化钠(NaOH)、硼砂(Na2B4O7510H2O)等均为分析纯,均购自国药集团化学试剂有限公司。超纯水由Milli-Q超纯水系统(美国Millipore公司)制备,电阻率为18.2 MΩ5cm。
自来水取自实验室,自流5 min后收集;湖水取自烟台大学校园内的人工湖。采集时分别用自来水和湖水冲洗取样器3次,并采用0.22 μm亲水性聚丙烯滤膜过滤,过滤后的样品置于4 ℃冰箱保存。
1.2 溶液配制
标准溶液:准确称取适量的标准物质溶于甲醇,配制成质量浓度为1 000 mg/L的标准贮备液,用超纯水稀释标准溶液得到相应浓度的工作溶液,于4 ℃冰箱内避光保存。
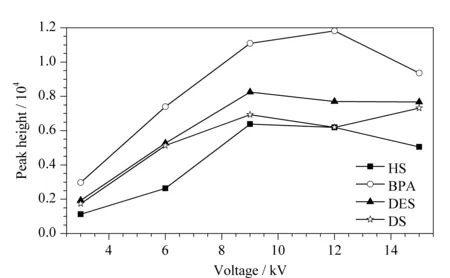
图 1 电压对4种PEs峰高的影响Fig. 1 Effect of voltage on the peak height of four phenolic estrogens (PEs) HS: hexestrol; BPA: bisphenol A; DES: diethylstilbestrol; DS: dienestrol.
MEKC缓冲溶液:由10 mmol/L Na2B4O7510H2O、20 mmol/L的SDS和40% (v/v)的乙腈组成,用1.0 mol/L的NaOH调节缓冲液pH为10.8。1.3实验方法
新使用的毛细管分别用超纯水、1.0 mol/L的NaOH、超纯水和缓冲溶液依次冲洗10、40、10和30 min。每天使用前用超纯水、1.0 mol/L的NaOH、超纯水和缓冲溶液冲洗2、10、5和5 min。两次进样间隔使用缓冲溶液冲洗3 min。
检测条件:分离电压为+28 kV;检测波长228 nm; PAEKI进样条件为-9 kV电压下压力进样,进样压力0.3 psi (约2.1 kPa),进样时间0.4 min,不注入水柱进样。
2 结果与讨论
2.1 进样条件的优化
采用PAEKI的进样方式在线富集分析物,对影响堆积效率的参数进行了优化。
2.1.1进样电压的优化
首先,设置压力为0.3 psi (约2.1 kPa),进样时间为0.4 min,对进样电压进行考察。如图1所示,富集效率随着进样电压的增大而升高,可见电压越大,有越多的分析物进入毛细管,堆积效果越好。然而,当电压过大时,峰形开始变差,峰高开始减小,这可能是因为过大的电渗流将分析物推出毛细管口,使堆积效果变差。此外,我们还发现当电压较大时,电泳分离容易出现断流情况,重复性较差,且和毛细管柱的使用程度、冲洗状态有较大的关系。在进样电压为-9 kV时,有最好的峰形和堆积效果。因此,选择进样电压为-9 kV,进样压力为2.1 kPa。
2.1.2进样时间的优化
在电压-9 kV、压力2.1 kPa条件下对进样时间进行了考察。从图2可以看出,在0.2~0.4 min时,堆积效果随着进样时间的增加而增加;但当时间超过0.4 min以后,峰高增加不明显,且DES和DS的峰高有所下降。当进样时间为0.5 min时,峰形展宽,分离度下降,这可能是进样量过多的原因。因此,选择进样时间为0.4 min。
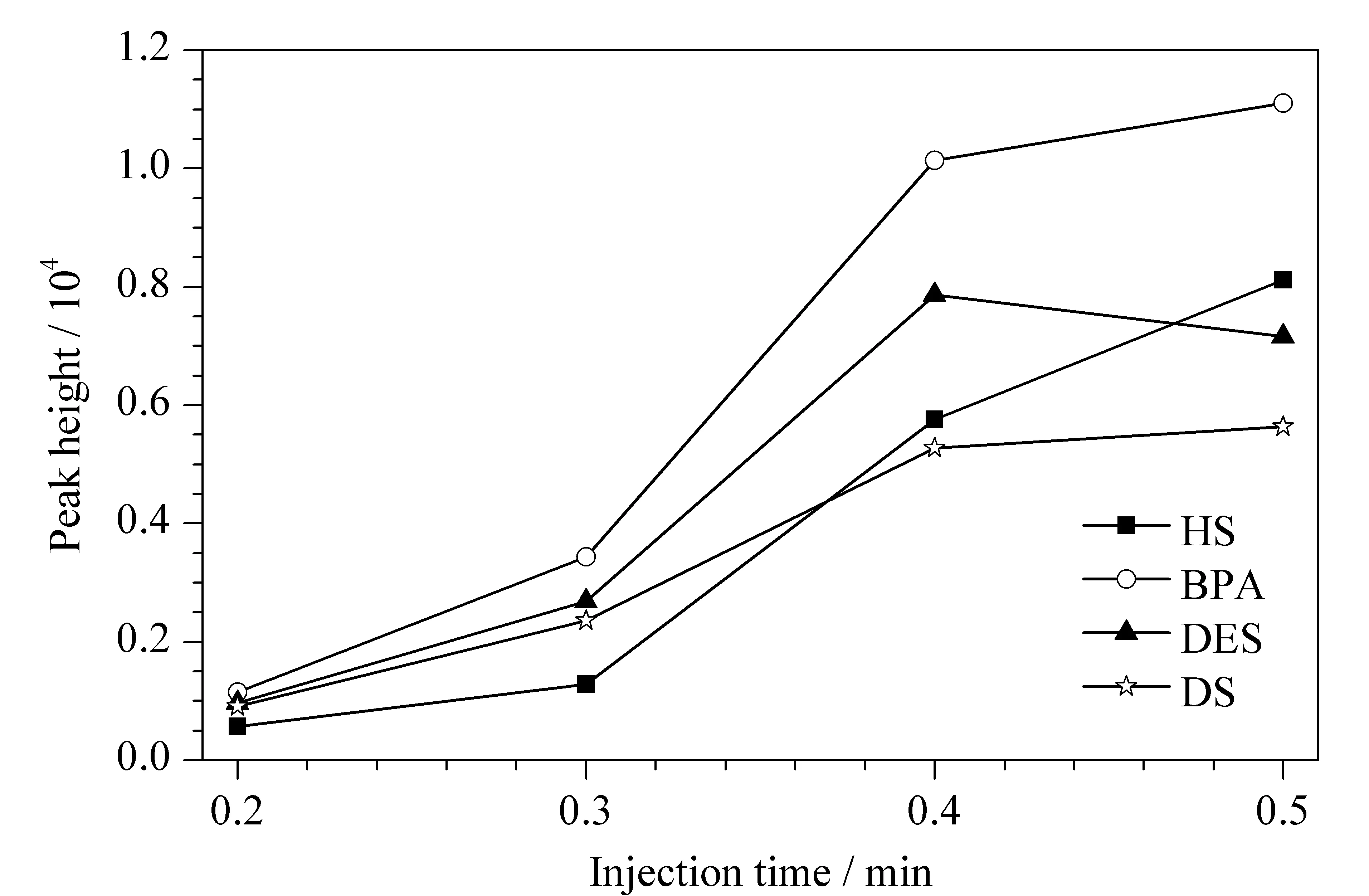
图 2 进样时间对4种分析物峰高的影响Fig. 2 Effect of injection time on the peak height of the four PEs
2.1.3注入水柱的选择
进一步考察电泳的在线富集效果,在压力辅助电动进样之前,预先注入一段水柱(0.5 psi (约3.4 kPa), 6 s)。考察了预先引入水柱对于富集效果的影响,发现电泳检测时断流情况较为严重,且分析物峰形较差。因此选择不注入水柱进样。
2.2 PAEKI和普通进样的对比
图3给出了在相同的分析物浓度条件下,普通压力进样(3.4 kPa, 3 s)的电泳图和最优的PAEKI条件(-9 kV, 2.1 kPa)下的电泳图。可以看出,PAEKI和普通的压力进样相比具有较明显的堆积效果。在最优的PAEKI条件下,4种分析物的富集倍数是普通压力进样的11~15倍。
2.3 线性关系及检出限
在最优的电泳条件下,4种分析物在7 min内基线分离。配制质量浓度为0.05~10 mg/L的混合标准溶液,在最优的PAEKI的条件下进行电泳分析,以分析物的峰高为纵坐标、质量浓度为横坐标,绘制校正曲线,4种雌激素在各自的范围(HS和DS为0.05~5 mg/L, BPA和DES为0.1~10 mg/L)内线性关系良好,相关系数(r)均≥0.993 6。以目标物的峰高与背景噪声的3倍信噪比(S/N)计算方法的检出限(LOD)。由表1可见,4种分析物的检出限为0.007 1~0.017 mg/L,达到痕量分析要求。
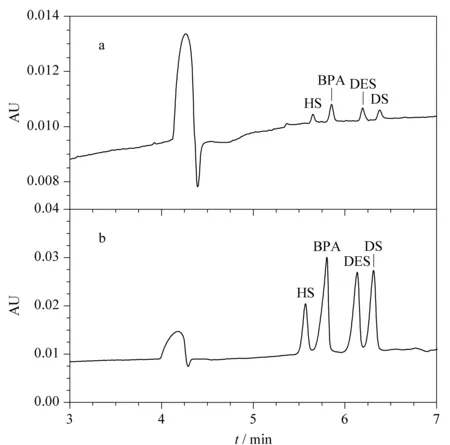
图 3 (a)普通压力进样和(b)压力辅助电动进样的电泳图Fig. 3 Electrophoregrams of (a) usual pressure injection and (b) pressure-assisted electrokinetic injection (PAEKI) a. The mass concentrations of HS, BPA, DES, and DS were 1, 2, 2 and 1 mg/L, respectively; b. The mass concentrations of HS, BPA, DES, and DS were 2.5, 5, 5 and 2.5 mg/L, respectively.
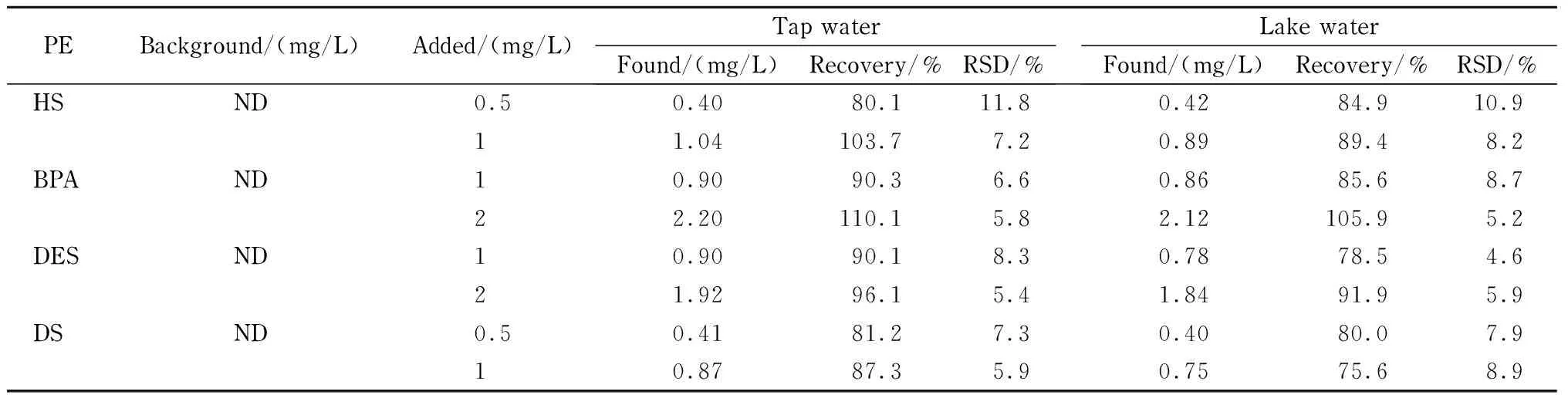
表 3 自来水和湖水样品中4种雌激素的加标回收率和相对标准偏差(n=5)
ND: not detected.
y: peak height;x: mass concentration, mg/L.
采用质量浓度分别为5、10、10和5 mg/L的HS、BPA、DES和DS的混合标准溶液,对MEKC-PAEKI测定4种PEs的精密度进行了考察。由表2可见,迁移时间的日内精密度为0.1%,日间精密度为1.3%~2.0%;峰面积的日内精密度为2.2%~2.8%,日间精密度为2.6%~3.3%。结果表明该方法稳定、可靠,适于准确测定。
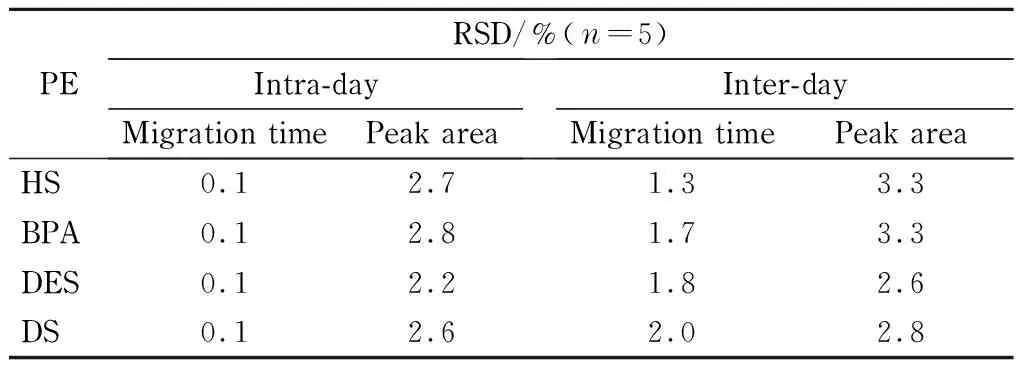
表 2 PAEKI测定PEs迁移时间和峰面积的精密度*
* Spiking HS, BPA, DES, and DS at 5, 10, 10, and 5 mg/L, respectively.
2.4 实际样品检测及加标回收试验
为进一步评价方法的实际应用价值,将建立的MEKC-PAEKI方法用于自来水和湖水样品中4种PEs残留的检测。以目标物的峰高与背景噪声10倍信噪比(S/N)计算方法的定量限(LOQ)。4种分析物在自来水中的LOQ分别为0.064 mg/L(HS)、0.029 mg/L(BPA)、0.063 mg/L(DES)和0.034 mg/L(DS),在湖水中的LOQ分别为0.071 mg/L(HS)、0.033 mg/L(BPA)、0.079 mg/L(DES)和0.038 mg/L(DS)。可见,此方法能够对实际水样中的痕量雌激素进行定量分析。
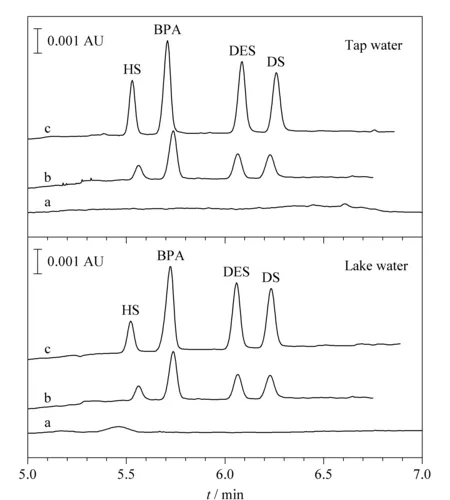
图 4 自来水、湖水空白样品和加标样品中4种PEs的电泳图Fig. 4 Electrophoregrams of the four PEs in blank and spiked samples of tap water and lake water a. without spiking; b. spiked with 0.5 mg/L HS, 1 mg/L BPA, 1 mg/L DES and 0.5 mg/L DS; c. spiked with 1 mg/L HS, 2 mg/L BPA, 2 mg/L DES and 1 mg/L DS.
对实际样品进行加标回收实验,自来水、湖水样品中4种雌激素的加标水平分别为0、0.5、1或2 mg/L,每个水平进行5次平行实验。测定结果见表3,电泳图见图4。由表3可以看出,自来水中4种PEs的加标回收率为80.1%~110.1%,相对标准偏差为5.4%~11.8%;湖水样品中加标回收率为75.6%~105.9%,相对标准偏差为4.6%~10.9%。以上结果表明,所建立的MEKC-PAEKI方法适用实际水样中多种酚类雌激素残留的同时分离和检测。
3 结论
本实验采用MEKC-PAEKI方法对自来水和湖水中痕量酚类雌激素进行在线富集和分析检测。PAEKI具有较好的富集效果,实际水样分析结果满意。PAEKI不需要样品前处理的富集过程,只需要对仪器进行简单的调试,方法简单、快速、无污染。并且,对于环境中基质复杂的样品,PAEKI还可以和其他的样品前处理技术连用,如液液萃取和固相萃取,进一步净化和富集样品,提高富集倍数,降低检出限,为酚类雌激素的检测提供了一条行之有效的途径。
参考文献:
[1] Sosvorova L K, Chlupacova T, Vitku J, et al. Talanta, 2017, 174: 21
[2] Lin Z A, Pang J L, Huang H, et al. Journal of Instrumental Analysis, 2010, 29(1): 55
林子俺, 庞纪磊, 黄慧, 等. 分析测试学报, 2010, 29(1): 55
[3] Sarigiannis D A, Karakitsios S P, Handakas E, et al. Food Chem Toxicol, 2016, 98: 134
[4] Chen S J, Chen X R, Yan L, et al. Environmental Science, 2014, 35(4): 1457
陈善佳, 陈秀荣, 闫龙, 等. 环境科学, 2014, 35(4): 1457
[5] Chou P H, Lin Y L, Liu T C, et al. Chemosphere, 2015, 138: 814
[6] Ballesteros-Gómez A, Rubio S, Pérez-Bendito D. J Chromatogr A, 2009, 1216(3): 449
[7] Lei B L, Huang S B, Zhou Y Q, et al. Chemosphere, 2009, 76(1): 36
[8] Wang Y K, Wang M, Wang H L, et al. Food Chem, 2015, 173: 1213
[9] Yu L L, Yuan D Z, Zhang S M, et al. Acta Physiologica Sinica, 2016, 68(4): 547
喻琳麟, 袁东智, 张诗茂, 等. 生理学报, 2016, 68(4): 547
[10] Flint S, Markle T, Thompson S, et al. J Environ Manage, 2012, 104: 19
[11] Pan S D, He Q, Chen X H, et al. Chinese Journal of Chromatography, 2017, 35(9): 980
潘胜东, 何仟, 陈晓红, 等. 色谱, 2017, 35(9): 980
[12] Zou Y M, Zhang Z, Shao X L, et al. Water Sci Technol, 2014, 69(5): 1028
[13] Zhao J L, Ying G G, Wang L, et al. Sci Total Envir, 2009, 407(2): 962
[14] Wen Y Y, Li J H, Liu J S, et al. Anal Bioanal Chem, 2013, 405(17): 5843
[15] Wang L J, Zhang Y F, Liu G F, et al. Steroids, 2014, 89: 41
[16] Lu W H, Ming W N, Zhang X S, et al. Electrophoresis, 2016, 37(19): 2487
[17] Gallart-Ayala H, Núnez O, Moyano E, et al. Electrophoresis, 2010, 31(9): 1550
[18] Wen Y Y, Li J H, Ma J P, et al. Electrophoresis, 2012, 33(19/20): 2933
[19] Xu Z Q, Ye F, Wang Y L, et al. Chinese Journal of Chromatography, 2015, 33(9): 988
徐中其, 叶峰, 王永乐, 等. 色谱, 2015, 33(9): 988
[20] Huang L F, He M, Chen B B, et al. Chinese Journal of Chromatography, 2014, 32(10): 1066
黄林芳, 何蔓, 陈贝贝, 等. 色谱, 2014, 32(10): 1066
[21] Zhang H, Gavina J, Feng Y L. J Chromatogr A, 2011, 1218(20): 3095
[22] D′Ulivo L, Feng Y L. Electrophoresis, 2015, 36(7/8): 1024
[23] Xu Z Q, Li A M, Wang Y L, et al. J Chromatogr A, 2014, 1355(9): 284
[24] Liu Q Q, Jia L, Hu C F. Chromatographia, 2010, 72(1/2): 95
[25] Zhou J, Yue M E. Chemical Reagents, 2015, 37(2): 142
周建, 岳美娥. 化学试剂, 2015, 37(2): 142
[26] Liu Q Q, Liu Y L, Yu G, et al. J Sep Sci, 2009, 32(7): 1011
[27] Liu J Y, Lu W H, Liu H T, et al. Electrophoresis, 2016, 37: 2502

