左右半结肠癌患者临床病理特征分析
初祯
结肠癌是消化系统常见的恶性肿瘤,研究发现结肠癌不同发病部位之间存在显著差异,左、右半结肠癌在流行病学、病理学、细胞遗传学及分子生物学等方面均存在差异[1]。本文回顾性分析我院570例结肠癌患者的临床资料,探讨左、右半结肠癌的临床及病理特点。
1 资料与方法
1.1 研究对象
收集我院2015年1月至2017年6月收治的570例经结肠镜检及病理学检查确诊为结肠癌的570例患者的临床病理学资料。其中右半结肠癌患者300例,中位年龄57(41~76)岁;左半结肠癌患者270例,中位年龄55(44~72)岁。纳入资料完整、肿瘤原发于结肠的患者,排除诊断不明确者以及同时或异时性多原发癌患者。本研究获医院伦理委员会批准,患者知情同意并签署知情同意书。
1.2 资料收集
通过查阅病历,收集患者性别、年龄、体重、有无贫血、便血、肠梗阻、大便异常、腹痛腹胀、有无腹部肿块、CEA水平、CA199水平、肿瘤大小、病理分型和组织分型等资料。
1.3 统计学方法
采用SPSS 17.0统计软件分析数据,分类资料以例数(%)表示,组间比较采用χ2检验或Fisher精确概率法,以双侧P<0.05为差异有统计学意义。
2 结果
2.1 左、右半结肠癌患者临床特征比较
右半结肠癌患者与左半结肠癌患者年龄、体重下降、便血、大便异常、腹胀腹疼、腹部肿块、CEA水平和CA199水平方面比较,差异均有统计学意义(P<0.05);性别、贫血和肠梗阻方面比较,差异均无统计学意义(P>0.05)。见表1。
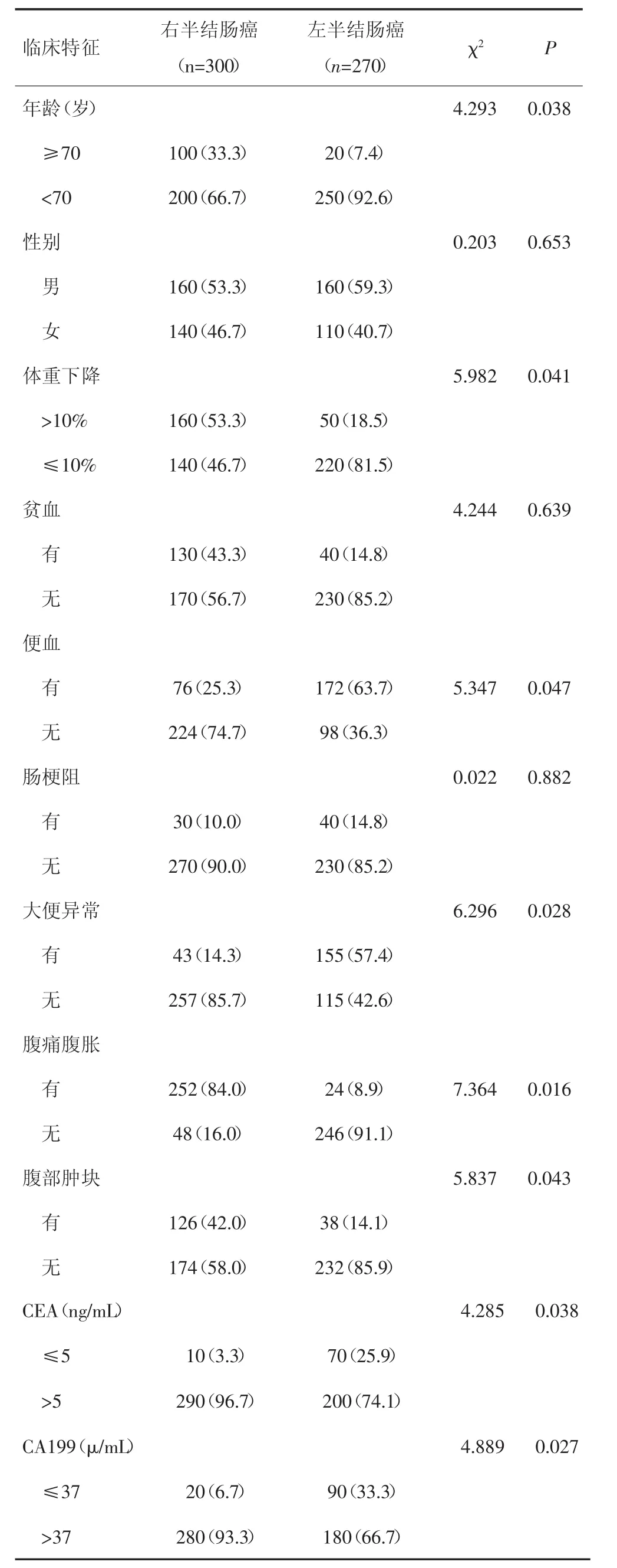
表1 左、右半结肠癌患者临床特征比较[n(%)]
2.2 左、右半结肠癌患者病理学特征比较
右半结肠癌患者肿瘤直径≥5 cm的比例大于左半结肠癌患者,差异有统计学意义(χ2=11.235,P=0.031);右半结肠癌患者中隆起型、溃疡型、浸润型分别占4.0%、81.7%、14.3%,左半结肠癌患者分别占17.8%、61.8%、20.4%,两组病理分型分布比较,差异有统计学意义(χ2=15.956,P=0.025);右半结肠癌患者中黏液腺癌、印戒细胞癌、未分化癌所占比例高于左半结肠癌患者,两组组织分型分布比较,差异有统计学意义(χ2=14.597,P=0.027)。见表2。
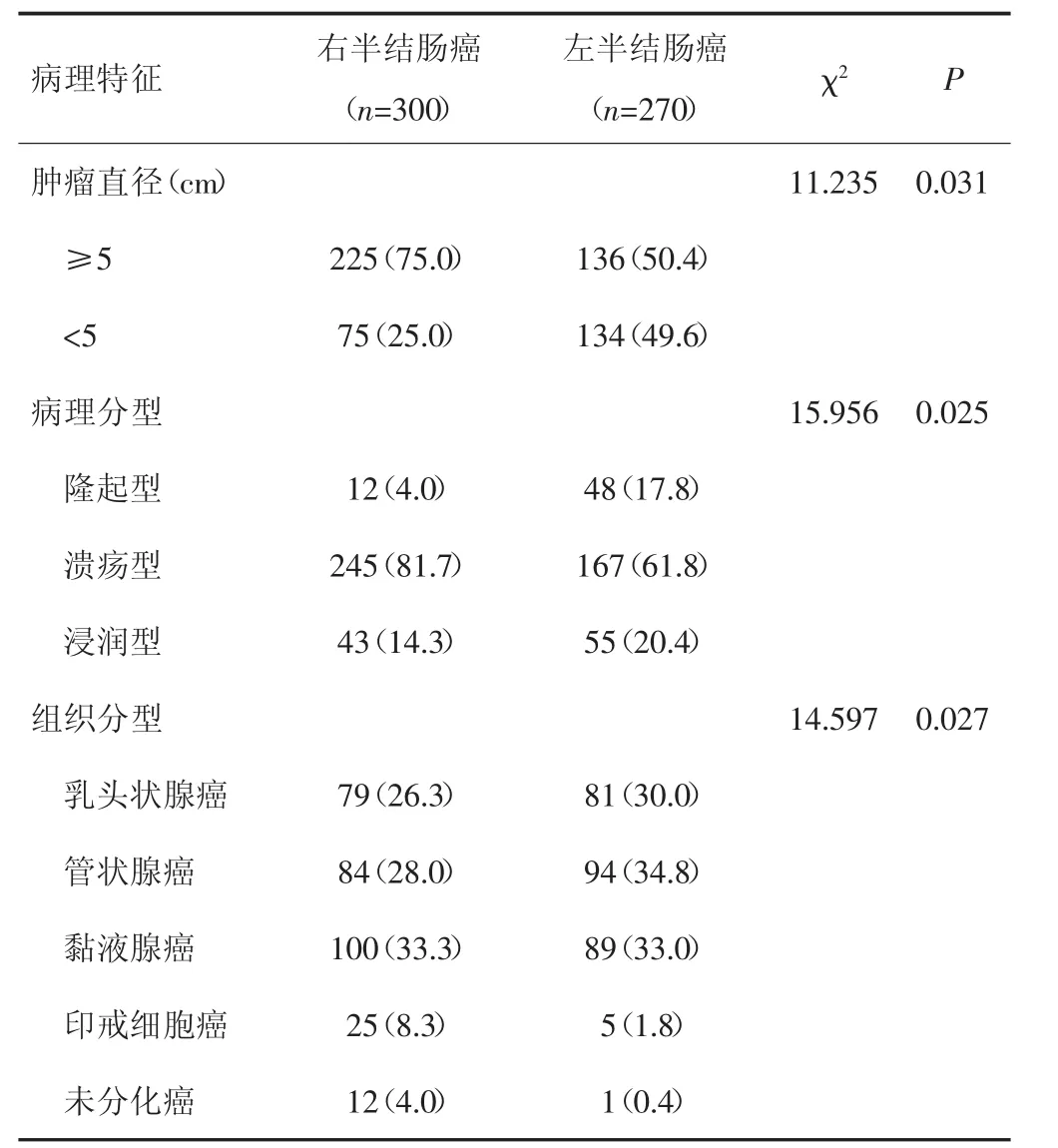
表2 左、右半结肠癌患者病理学特征比较[n(%)]
3 讨论
左、右半结肠胚胎起源不同,右半结肠包括盲肠、升结肠及横结肠近端2/3,起源于胚胎中原肠,接受肠系膜上动脉血供;左半结肠包括横结肠远端1/3、降结肠及乙状结肠,起源于胚胎后原肠,接受肠系膜下动脉血供。导致结肠癌的主要分子生物学路径有染色体不稳定(chromosomalinstability,CIN)路径、CpG 岛甲基化表型(cytosine-guanosineisland methylationphenotype,CIMP)路径和微卫星不稳定(microsatellite instability,MSI)路径。左半结肠癌中CIN路径成瘤比例较右半结肠癌高,而右半结肠癌出现MSI表型的概率是左半结肠癌的10倍[2]。近期研究[3-4]显示右半结肠癌比例逐渐上升,而左半结肠癌比例有下降趋势,即结肠癌好发部位正由左向右倾斜。
研究发现女性更易患右半结肠癌[5],同时右半结肠癌患者发病年龄较晚,高龄患者所占比例明显高于左半结肠癌[6]。数据显示结肠癌中女性患者比例较男性患者低,而右半结肠癌患者女性所占比例较右半结肠癌患者高,但均不足50%[7]。本研究发现右半结肠癌患者中高龄及女性更常见,且更易合并体重下降、贫血、腹痛、腹胀、腹部肿块,出现CEA及CA199异常升高的患者所占比例更高;而左半结肠癌患者中合并大便异常、便血及肠梗阻的比例更高。造成上述差异的可能原因为左、右半结肠胚胎起源不同。右半结肠由于管腔较大,肠壁薄易扩张且内容物较稀,因而较少出现肠梗阻症状,常表现为腹部肿物、贫血及体重减轻;而左半结肠管腔小且内容物较干结,早期患者常表现为消化道症状,如便血、大便习惯改变等。肿瘤环形生长逐渐堵塞肠腔易形成肠梗阻,右半结肠癌常表现为腹部肿物、贫血及体重减轻,而左半结肠癌更易出现肠梗阻[8],与本研究结果一致。
组织病理学方面,本研究右半结肠癌患者中黏液腺癌、印戒细胞癌、未分化癌所占比例高于左半结肠癌患者。Benedix等[9]分析17 641例结肠癌患者结果发现,右半结肠癌中分化差、印戒细胞癌及黏液腺癌所占比例均高于左半结肠癌患者。研究发现右半结肠癌组织中黏蛋白相关抗原表达高于左半结肠癌,可能是右半结肠癌中黏液腺癌比例更高的原因[10]。也有学者认为,黏蛋白的产生是体细胞MSI肿瘤的特性,而研究显示MSI多见于右半结肠癌,因此右半结肠癌患者黏液腺癌和印戒细胞癌可能较多见[11]。但本研究未对黏液腺癌、印戒细胞癌、未分化癌各亚组进行比较分析,各亚组之间关系及其原因有待研究。
本研究分析570例左、右半结肠癌患者的临床病理学资料,结果发现右半结肠癌与左半结肠癌在临床症状、组织病理学方面均存在差异,右半结肠癌较左半结肠癌分化更差,浸润和转移更强,恶性程度更高,临床应加以筛查和诊断。
[1] Brule SY,Jonker DJ,Karapetis CS,et al.Location of colon cancer(right-sided versus left-sided)as a prognostic factor and a predictor of benefit from cetuximab in NCIC CO.17[J].Eur J Cancer,2015,51(11):1405-1414.
[2] Nosho K,Irahara N,Shima K,et al.Comprehensive biostatistical analysis of CpG island methylator phenotype in colorectal cancer using a large population-based sample[J].PLoS One,2008,3(11):e3698.
[3] Omranipour R,Doroudian R,Mahmoodzadeh H.Anatomical distribution of colorectal carcinoma in Iran:a retrospective 15-yr study to evaluate rightward shift[J].Asian Pac J Cancer Prev,2012,13(1):279-282.
[4] 吴泽华,邓艳红.结直肠癌流行病学东西方差异对肿瘤部位的影响[J].中国癌症防治杂志,2017,9(5):356-360.
[5] Von Einem JC,Heinemann V,Von Weikersthal LF,et al.Left-sided primary tumors are associated with favorable prognosis in patients with KRAS codon 12/13 wild-type metastatic colorectal cancer treated with cetuximab plus chemotherapy:an analysis of the AIO KRK-0104 trial[J].J Cancer Res Clin Oncol,2014,140(9):1607-1614.
[6] Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
[7] Moritani K,Hasegawa H,Okabayashi K,et al.Difference in the recurrence rate between right-and left-sided colon cancer:a 17-year experience at a single institution[J].Surg Today,2014,44(9):1685-1691.
[8] Yamauchi M,Lochhead P,Morikawa T,et al.Colorectal cancer:a tale of two sides or a continuum?[J].Gut,2012,61(6):794-797.
[9] Benedix F,Kube R,Meyer F,et al.Comparison of 17,641 patients with right-and left-sided colon cancer:differences in epidemiology,perioperative course,histology,and survival[J].Dis Colon Rectum,2010,53(1):57-64.
[10] Price TJ,Beeke C,Ullah S,et al.Does the primary site of colorectal cancer impact outcomes for patients with metastatic disease?[J].Cancer,2015,121(6):830-835.
[11]Ishihara S,Nishikawa T,Tanaka T,et al.Prognostic impact of tumor location in stage IV colon cancer:a propensity score analysis in a multicenter study[J].Int J Surg,2014,12(9):925-930.

