含贝伐珠单抗维持治疗晚期结直肠癌患者疗效与安全性的Meta分析
李华兰 廖小莉 李永强
近年,全球结直肠癌发病率和死亡率均持续上升,我国每年约有37 630例新发病例和11 110例死亡病例[1]。针对表皮生长因子受体(epidermal growth factor receptor,EGFR)的西妥昔单抗和帕尼单抗以及针对血管内皮生长因子(vascular endothelial growth factor,VEGF)的贝伐珠单抗,给晚期结直肠癌患者带来了明显生存获益[2-3]。贝伐珠单抗联合化疗可显著改善晚期结直肠癌患者总生存期(OS)及无疾病进展生存期(PFS)[3-5],且具有良好的有效性与安全性,近年亦被用于晚期结直肠癌的维持治疗。但在晚期结直肠癌治疗中,以贝伐珠单抗为基础的维持治疗方案尚无统一意见。本研究对以贝伐珠单抗为基础的不同联合方案治疗晚期结直肠癌的疗效与安全性进行Meta分析,为诱导化疗临床获益的晚期结直肠癌患者在维持阶段选择最佳治疗方案提供循证依据。
1 资料与方法
1.1 文献检索
在 PubMed、EMbase、Web of Science 和 Cochrane Library 数据库中,以“bevacizumab”“avastin,maintenance therapy”“intermittent therapy”“advanced colon cancer”“advanced rectal cancer”“advanced colorec-tal cancer”“controlled clinical trials”“randomized controlled trial”“controlled clinical trials”为关键词检索截至2017年7月31日发表的有关贝伐珠单抗维持治疗晚期结直肠癌的文献。
1.2 文献纳入与排除标准
纳入标准:⑴年龄≥18周岁;⑵经病理学或细胞学确诊的晚期或转移结直肠癌;⑶所有贝伐珠单抗维持治疗对比停止治疗或含贝伐珠单抗持续治疗晚期结直肠癌疗效与安全性的研究;⑷随机对照研究(RCT);⑸研究文献为全文文献;⑹有足够数据提供风险比(HR)及95%可信区间(CI)或可转化HR及95%CI;⑺相同研究重复发表的仅纳入有效数据质量高的研究。排除标准:⑴无对照人群;⑵动物实验;⑶合并其他严重疾病;⑷二重癌。
1.3 评价指标
结局指标包括无疾病进展生存期(PFS)、总生存期(OS)和相关不良事件。
1.4 资料提取
由2名研究人员分别独立完成资料复审和文献数据提取,不一致部分经讨论解决,如无法达成一致,则由第3位研究者最终做出决定。资料主要包括第一作者姓名、发表年份、研究机构、研究所在地区或国家、研究对象、样本量、研究组和对照组的治疗方案、PFS及OS的HR和95%CI、中位PFS和OS及3~4级临床不良反应等。
1.5 文献质量评价
参照改良版Jadad质量计分法进行评价。1~3分视为低质量,4~7分视为高质量。由2名研究员根据统一的质量标准独立评估,提取文献资料,然后交叉核对,如遇分歧讨论解决。
1.6 统计学分析
采用RevMan 5.3软件进行Meta分析,OR或HR及其95%CI为效应统计量。通过I2值和P值进行异质性检验,当P≥0.05和I2≤50% 时,表示各独立研究结果具有同质性,则采用固定效应模型进行分析;反之,表示各研究间存在统计学异质性,则采用随机效应模型进行分析。以P<0.05为差异有统计学意义。
2 结果
2.1 文献检索与质量评价
共检索到2 154篇相关文献,全部为英文文献,去除重复及不符主题文献后剩余113篇;阅读题目及摘要,排除后剩余25篇;细读全文文献,排除不符合纳入标准文献后,最终纳入8篇文献[6-13]。经改良版Jadad质量计分法评价,8篇文献均为高质量文献。文献基本特征见表1。
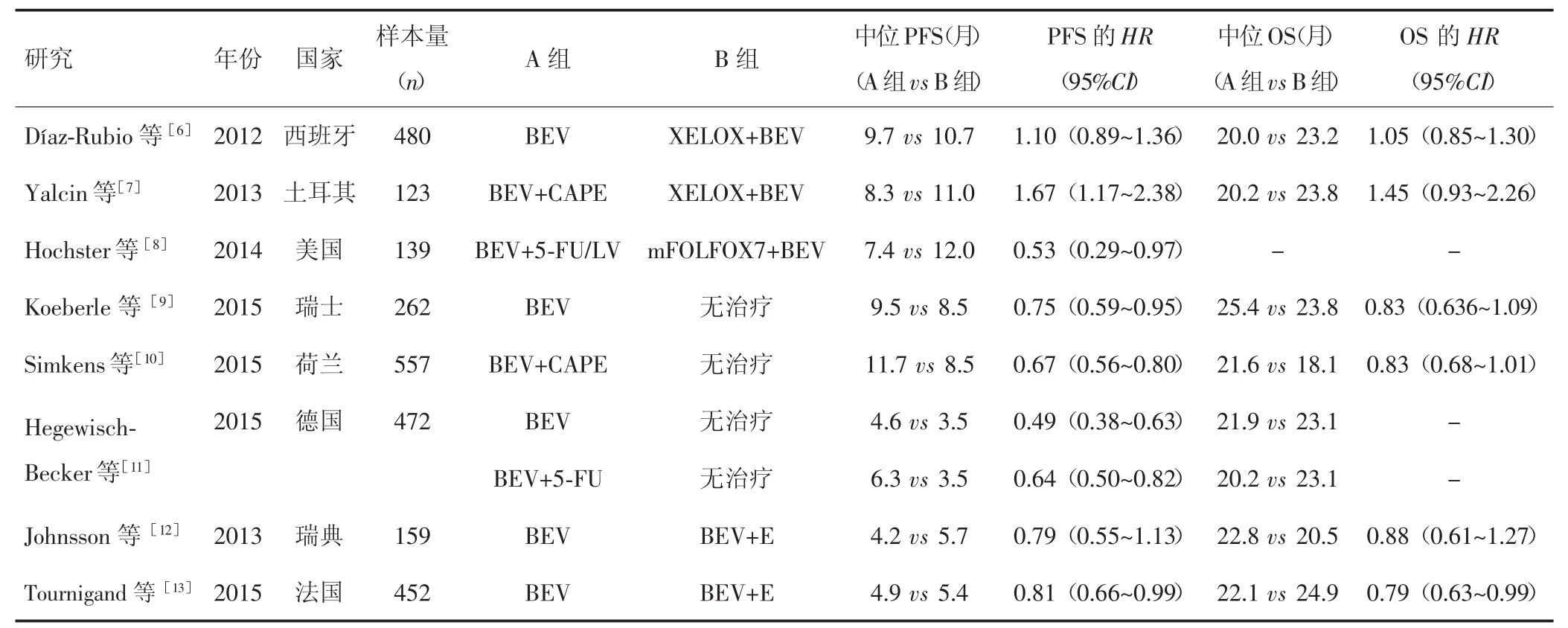
表1 纳入研究的基本特征
2.2 疗效分析
2.2.1 贝伐珠单抗维持治疗与持续治疗 3项研究[6-8]提供PFS,研究间具有异质性(P=0.005,I2=81%),采用随机效应模型分析,结果显示,贝伐珠单抗维持治疗组与持续治疗组PFS差异无统计学意义(HR=1.05,95%CI:0.56~1.71,P=0.830),见图 1A。2 项研究[6-7]提供OS,研究间具有同质性(P=0.200,I2=40%),采用固定效应模型分析,结果显,示两组OS差异无统计学意义(HR=1.11,95%CI:0.92~1.35,P=0.270),见图 1B。

图1 晚期结直肠癌贝伐珠单抗维持治疗与持续治疗疗效的Meta分析
2.2.2 贝伐珠单抗维持治疗与无治疗 3项研究[9-11]提供PFS,研究间具有异质性(P=0.050,I2=62%),采用随机效应模型进行分析,结果显示,贝伐珠单抗维持治疗组与无治疗组的PFS比较,差异有统计学意义(HR=0.65,95%CI:0.53~0.78,P<0.001),见图 2A。2 项研究[9-10]提供 OS,研究间具有同质性(P=1.000,I2=0),采用固定效应模型分析,结果显示,贝伐珠单抗维持治疗组OS较无治疗组长,差异有统计学意义(HR=0.83,95%CI:0.71~0.98,P=0.020),见图 2B。

图2 晚期结直肠癌贝伐珠单抗维持治疗与无治疗疗效的Meta分析
2.2.3 贝伐珠单抗联合厄洛替尼与单药贝伐珠单抗治疗
2项研究[12-13]均提供PFS及OS,研究间具有同质性(P>0.05,I2<50%),采用固定效应模型分析,结果显示,与单药贝伐珠单抗相比,贝伐珠单抗联合厄洛替尼双靶向治疗可明显改善晚期结直肠癌患者PFS(HR=0.81,95%CI:0.67~0.96,P=0.020)及 OS(HR=0.81,95%CI:0.67~0.99,P=0.040),见图 3。
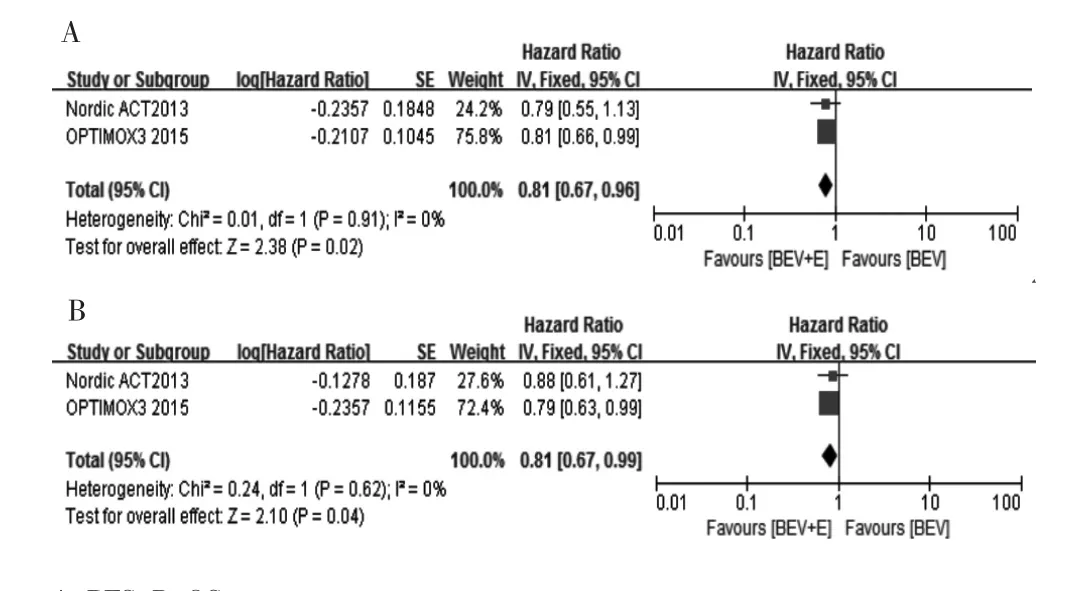
图3 晚期结直肠癌贝伐珠单抗联合厄洛替尼与单药贝伐珠单抗治疗疗效的Meta分析
2.3 安全性分析
2.3.1 贝伐珠单抗维持治疗与持续治疗 3项研究[6-8]主要3~4级不良反应为感觉神经障碍、疲乏及手足综合征,研究间具有同质性(P>0.05,I2<50%),采用固定效应模型分析,结果显示,贝伐珠单抗维持治疗组3~4级感觉神经障碍、疲乏及手足综合征的发生率明显低于持续治疗组,差异有统计学意义(P<0.05)。见图4。
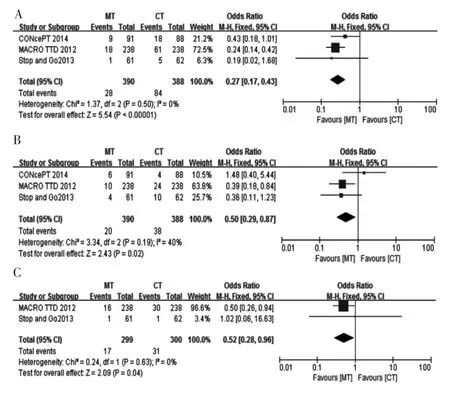
图4 晚期结直肠癌贝伐珠单抗维持治疗与持续治疗3~4级不良反应的Meta分析
2.3.2 贝伐珠单抗维持治疗与无治疗 3项研究[9-11]提供了3~4级临床不良反应相关数据。针对主要不良反应感觉神经障碍、高血压相关数据,异质性检验显示研究间存在同质性(P>0.05,I2<50%),采用固定效应模型分析,结果显示,贝伐珠单抗维持治疗组发生3~4级感觉神经障碍、高血压的风险高于无治疗组,差异有统计学意义(P<0.05),见图5A~B。针对手足综合征,研究间具有异质性(P=0.006,I2=81%),采用随机效应模型分析,结果显示,两组手足综合征发生率差异无统计学意义(P=0.210),见图5C。
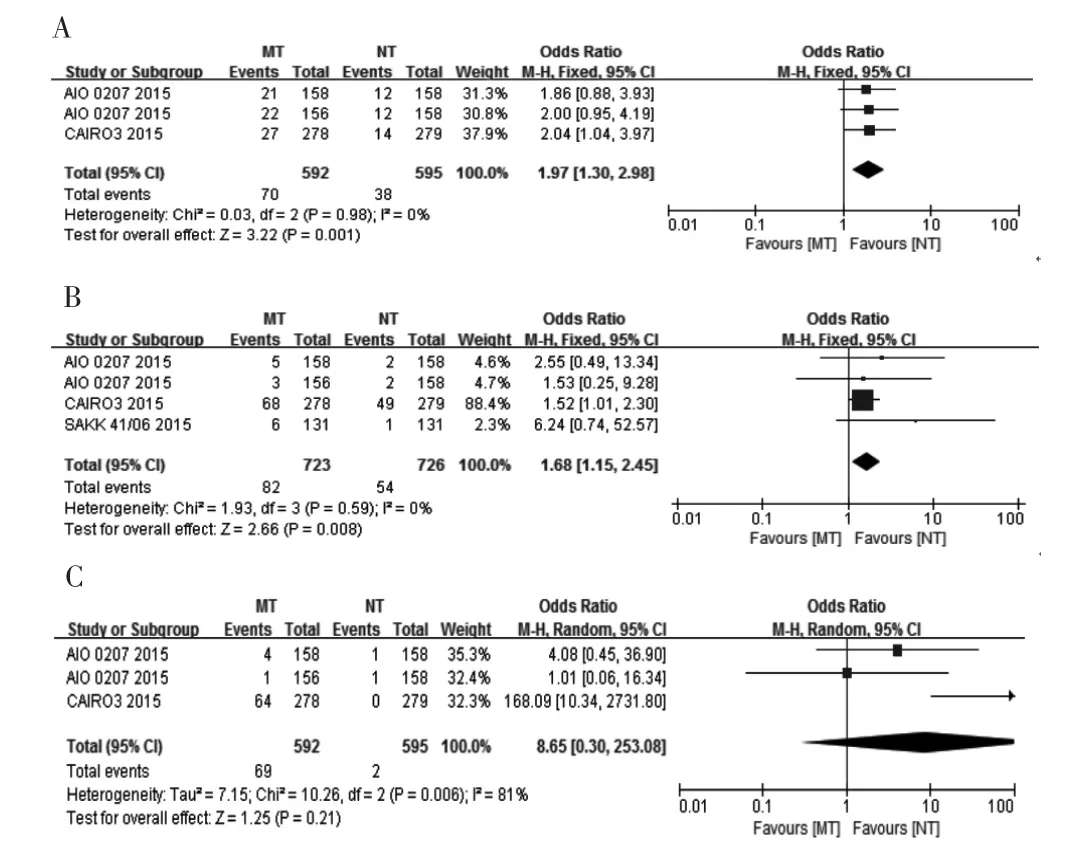
图5 晚期结直肠癌贝伐珠单抗维持治疗与无治疗3~4级不良反应的Meta分析
2.3.3 贝伐珠单抗联合厄洛替尼与单药贝伐珠单抗2项研究[12-13]的主要不良反应为皮疹,研究间具有同质性(P>0.05,I2<50%),采用固定效应模型分析,结果显示,贝伐珠单抗联合厄洛替尼组3~4级皮疹发生率明显高于单药贝伐珠单抗组,差异有统计学意义(P<0.001),见图 6。2.4 发表偏倚分析

图6 晚期结直肠癌贝伐珠单抗联合厄洛替尼与单药贝伐珠单抗治疗3~4级不良反应的Meta分析
8项研究均提供PFS相关数据,1项研究未提供OS数据,故本研究选择PFS的HR及其95%CI绘制漏斗图。结果显示,散点左右分布不对称,提示可能存在发表偏倚,但仍在可接受的范围,见图7。

图7 PFS发表偏倚的漏斗图
3 讨论
晚期结直肠癌姑息化疗的目的是延长患者生存期,改善生活质量。化疗是治疗晚期结直肠癌最重要的手段,但多数抗肿瘤药物属非选择性药物,在杀死肿瘤细胞的同时,亦对正常细胞有杀伤作用。持续治疗会增加严重不良反应的发生率[14-15],且长期化疗可诱导患者对化疗药物耐药,导致化疗方案失败,但MRC COINⅢ期临床研究[16]表明维持阶段完全停止治疗不利于晚期结直肠癌患者生存。同时有研究[17]表明,仅用低毒药物作为维持治疗可降低严重不良反应的发生率,改善患者生活质量,且不影响疗效。因此,使用低毒药物维持治疗晚期结直肠癌被提上了议程。
贝伐珠单抗是一种针对VEGF重组人源化、人鼠嵌合的单克隆抗体,通过与VEGF-A亚型结合,阻断其与血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)结合,从而抑制内皮细胞和新血管形成,使肿瘤组织无法获得所需的血液、氧和其他养分,达到抑制肿瘤生长和转移的目的[18]。Hurwitz等[3]研究发现贝伐珠单抗联合 5-FU为基础的化疗可明显延长患者的PFS和OS,且不增加化疗不良反应。基于此,美国FDA批准贝伐珠单抗用于晚期结直肠癌一线治疗。
本研究共纳入8篇文献,均为高质量的临床随机对照试验。其中3项研究比较贝伐珠单抗维持治疗与持续治疗的Ⅲ期RCT,MACRO TTD研究[6]显示两组PFS和OS差异无统计学意义。Stop and Go[7]及CONcePT[8]两项研究显示PFS有统计学意义,Stop andGo研究显示,相比贝伐珠单抗维持治疗,持续治疗OS无明显延长,将数据合并后分析发现,PFS、OS差异均无统计学意义,可能与MACRO TTD研究的样本量远大于其他2项研究有关。在安全性分析中,3项独立性研究的结果与合并分析的结果均显示持续治疗的3~4不良反应发生率高于维持治疗,且持续治疗组因不良反应较大无法耐受而退出研究的比例较维持组高。综上,相比维持治疗,持续治疗并未延长PFS和OS,且明显增加不良反应,因此目前的试验不推荐持续治疗。
本研究对3项比较贝伐珠单抗维持治疗与无治疗的疗效和安全性的临床随机对照试验进行数据合并分析发现,贝伐珠单抗维持治疗较无治疗更有优势。在安全性方面,贝伐珠单抗维持组虽3~4级不良反应的发生率高于无治疗组,主要不良反应为感觉神经障碍和高血压,但均可耐受,对患者生活质量亦无明显影响。
此外,本研究亦纳入2项关于贝伐珠单抗联合厄洛替尼维持治疗晚期结直肠癌的临床随机对照试验,主要研究终点均为PFS,OPTIMOX3研究[13]结果显示PFS及OS差异有统计学意义,Nordic ACT研究[12]结果则显示PFS及OS差异无统计学意义。将2项研究结果进行系统分析发现,两种靶向药物较单药贝伐珠单抗生存获益更大。在安全性上,虽然贝伐珠单抗联合厄洛替尼组增加3~4级皮疹发生率,但大部分患者可耐受。因此,相比单药贝伐珠单抗,靶向药物联合可能对改善晚期结直肠癌患者PFS及OS更具优势,且不影响患者生活质量[13]。
综上所述,贝伐珠单抗联合或不联合化疗药物或联合其他靶向药物对晚期结直肠癌患者的PFS及OS具有潜在优势,尽管增加了不良反应发生风险,但大多数患者耐受性良好,能保持较好的生活质量,可为治疗晚期结直肠癌的标准治疗或优先治疗选择提供一定参考价值。本研究纳入的研究均为Ⅲ期临床随机对照试验,证据质量较高,但纳入文献较少,均为英文文献,可能存在潜在发表偏倚。此外,8项研究来自不同国家,各研究的主要终点、样本量不同,维持治疗前肿瘤体积、转移部位及一线治疗方案等不同,可能为本文异质性的原因。因此,有待更多大样本多中心的临床随机对照试验加以验证。
[1] Chen W,Zheng R,Baade PD.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2] Cunningham D,Humblet Y,Siena S,et al.Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cance[rJ].N Engl J Med,2004,351(4):337-345.
[3] Hurwitz H,Fehrenbacher L,Novotny W,et al.Bevacizumab plus irinotecan,fluorouracil,and leucovorin for metastatic colorectal cance[rJ].N Engl J Med,2004,350(23):2335-2342.
[4] Kabbinavar FF,Hambleton J,Mass RD,et al.Combined analysis of efficacy:the addition of bevacizumab to fluorouracil/leucovorin improves survival for patients with metastatic colorectal cancer[J].J Clin Oncol,2005,23(16):3706-3712.
[5] Tebbutt NC,Wilson K,Gebski VJ,et al.Capecitabine,bevacizumab,and mitomycin in first-line treatment of metastatic colorectal cancer:results of the Australasian gastrointestinal trials group randomized phase III MAX study[J].J Clin Oncol,2010,28(19):3191-3198.
[6] Díaz-Rubio E,Gómez-Espaa A,Massuti B,et al.First-line XELOX plus bevacizumab followed by XELOX plus bevacizumab or singleagentbevacizumab asmaintenance therapy in patientswith metastatic colorectal cancer:the phase Ⅲ MACRO TTD study[J].Oncologist,2012,17(1):15-25.
[7] Yalcin S,Uslu R,Dane F,et al.Bevacizumab+capecitabine as maintenance therapy after initial bevacizumab+XELOX treatment in previously untreated patients with metastatic colorectal cancer:phase III Stop and Go study results--a Turkish Oncology Group Trial[J].Oncology,2013,85(6):328-335.
[8] Hochster HS,Grothey A,Hart L,et al.Improved time to treatment failurewithanintermittentoxaliplatinstrategy:resultsofCONcePT[J].Ann Oncol,2014,25(6):1172-1178.
[9] Koeberle D,Betticher DC,Von Moos R,et al.Bevacizumab continuation versus no continuation after first-line chemotherapy plus bevacizumab in patients with metastatic colorectal cancer:a randomized phase III non-inferiority trial(SAKK 41/06)[J].Ann Oncol,2015,26(4):709-714.
[10]Simkens LH,Van Tinteren H,May A,et al.Maintenance treatment with capecitabine and bevacizumab in metastatic colorectal cancer(CAIRO3):a phase 3 randomised controlled trial of the dutch colorectal cancer group[J].Lancet,2015,385(9980):1843-1852.
[11]Hegewisch-Becker S,Graeven U,Lerchenmuller CA,et al.Maintenance strategies after first-line oxaliplatin plus fluoropyrimidine plus bevacizumab for patients with metastatic colorectal cancer(AIO 0207):a randomised,non-inferiority,open-label,phase 3 trial[J].Lancet Oncol,2015,16(13):1355-1369.
[12] Johnsson A,Hagman H,Fr?din JE,et al.A randomized phase Ⅲtrial on maintenance treatment with bevacizumab alone or in combination with erlotinib after chemotherapy and bevacizumab in metastatic colorectal cancer:the Nordic ACT trial[J].Ann Oncol,2013,24(9):2335-2341.
[13] Tournigand C,Chibaudel B,Samson B,et al.Bevacizumab with or without erlotinib as maintenance therapy in patients with metastatic colorectal cancer(GERCOR DREAM;OPTIMOX3):a randomised,open-label,phase 3 trial[J].Lancet Oncol,2015,16(15):1493-1505.
[14]Maughan TS,James RD,Kerr DJ,et al.Comparison of intermittent and continuous palliative chemotherapy for advanced colorectal cancer:a multicentre randomised trial[J].Lancet,2003,361(9356):457-464.
[15]Chibaudel B,Maindrault-Goebel F,Lledo G,et al.Can chemotherapy be discontinued in unresectable metastatic colorectal cancer?The GERCOR OPTIMOX2 Study[J].J Clin Oncol,2009,27(34):5727-5733.
[16]Adams RA,Meade AM,Seymour MT,et al.Intermittent versus continuous oxaliplatin and fluoropyrimidine combination chemotherapy for first-line treatment of advanced colorectal cancer:results of the randomised phase 3 MRC COIN trial[J].Lancet Oncol,2011,12(7):642-653.
[17]Tournigand C,Cervantes A,Figer A,et al.OPTIMOX1:a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-Go fashion in advanced colorectal cancer--a GERCOR study[J].J Clin Oncol,2006,24(3):394-400.
[18]Ferrara N,Kerbel RS.Angiogenesis as a therapeutic target[J].Nature,2005,438(7070):967-974.

