纳米氧化锌对凋落物降解微生物群落结构和代谢功能的影响
杜京京,崔明会,张玉燕,郭瑞林,高玉聪,胡丹
1. 郑州轻工业学院 材料与化学工程学院,郑州 450002 2. 环境污染治理与生态修复河南省协同创新中心,郑州450002
纳米材料由于具有小尺寸效应、表面效应、量子尺寸效应和宏观量子隧道效应等特性,故被广泛应用于轻工、化工、军事、医药等多个领域[1]。随着纳米科技的飞速发展,越来越多的纳米材料被开发并投入到商业应用,如纳米银、纳米氧化锌、纳米二氧化钛、纳米氧化铈等[2]。然而,在研发、生产及应用过程中,纳米材料的环境释放量日趋增加,对生态系统及人体健康存在潜在危害[3]。因此,研究纳米材料的生态毒理机制对纳米材料的可持续发展及生态安全具有实际意义。
淡水生态系统是大部分生活用水、生产用水及雨水的汇集地[4],在该系统中,水生丝状真菌在物质循环和能量流动等方面起着重要的作用。原因在于水生丝状真菌能够分泌一系列关键的胞外降解酶,作用于系统内的大分子聚合物,对有机质(如凋落物)进行降解转化,从而使其更容易被碎食性无脊椎动物进食,同时也为水生细菌提供无机营养[5]。在此过程中,水生丝状真菌完成了将碳和能量从凋落物转移到更高营养级的生态功能。然而,水生丝状真菌极易受到外界环境压力的干扰,如营养来源、温度、酸碱度、氧气、重金属等因素的变化都有可能影响到它的代谢功能,间接地对凋落物的分解效率产生影响[6]。研究表明,重金属锌离子和铜离子对水生丝状真菌的生长繁殖具有抑制作用,从而显著抑制了其生物活性,导致凋落物降解速率下降[7-8]。然而,纳米材料对水生丝状真菌的影响效应却鲜有报道[9],研究水生丝状真菌对纳米材料的响应及适应机制将有助于更好地解释纳米材料对生态系统的环境毒理机制。
纳米氧化锌因其独特的光电性能、高效的催化能力和抗菌活性而广泛应用于陶瓷、玻璃、接合剂、涂料、电池和助燃剂等生产中,间接导致了其在水环境中有相当程度的暴露。Nowack课题组和Dumont课题组的研究[10-11]均表明,随着纳米产品的大量应用,预计纳米氧化锌在水环境中的浓度水平将不断增加。因此,国内外研究者越来越关注纳米氧化锌对生态环境和人类健康造成的负面效应[12-14]。基于上述分析,本课题通过室内模拟凋落物降解过程实验,探讨纳米氧化锌对水生丝状真菌的影响效应,分析纳米氧化锌在降解过程中的形态变化、运移规律及其对凋落物降解速率的影响;并对体系内水生丝状真菌生孢率及群落多样性的变化进行跟踪,探明水生丝状真菌在纳米氧化锌作用下的演替规律;结合水生丝状真菌主要降解酶活性的动态变化,进一步剖析纳米氧化锌的环境行为特征与水生丝状真菌代谢功能的内在联系,综合多重视角来揭示水生丝状真菌对纳米氧化锌的响应及适应机制,为新兴污染物的生态毒理研究提供坚实的理论基础。
1 实验材料(Experimental materials)
1.1 纳米氧化锌
实验所用3种粒径的纳米氧化锌(30±10 nm,99.9%;90±10 nm,99.8% metals basis;200 nm, 99.9%)均由上海阿拉丁试剂公司提供。纳米氧化锌悬浮液(6 g L-1)的制备:分别称取不同粒径的纳米氧化锌粉末,用超纯水定容,使用数控超声波清洗器(KQ-500DE,昆山舒美)在4 ℃、40 KHz条件下超声30 min使纳米颗粒分散均匀。在200 KV下透过电子显微镜(JEM-2010,JEOL,日本)表征ZnO悬浮液的初始尺寸和形态特征(图1),其平均实际粒径分别为(15±3) nm、(50±23) nm和 (200±21) nm。
1.2 凋落叶
实验所用凋落叶取自钻天杨(PopulusnigralL.),别称美杨。由于钻天杨广泛分布于河岸两边,所以选择为实验材料。凋落叶收集于2015年11月济源砚瓦河的河岸边,将其带回实验室,用去离子水把叶子清洗干净并用打孔器制成直径为12 mm的圆盘,40 ℃烘干至恒重(约72 h),后装入孔径为0.5 mm的凋落物袋中(每袋80片,装之前称重),实验共准备78袋。凋落物袋定植点选在济源砚瓦河某段溪流(34°56′24.73''N,112°25′56.15''E,海拔134 m,宽度10 m)。该河段水质良好,水温18 ℃,电导率546μs·cm-1,溶解氧10 mg·L-1,氧化还原电位-60μV,其优势物种有狭叶香蒲、芦苇及狐尾藻。将凋落物袋绑紧并系到笼子里,沉浸在河水中15 d使微生物定植。为确定叶片的初始重量,在定植30 min时,随机选取3袋带回实验室烘干并称重。另外,取20 L河水低温运送至实验室用于凋落物培养。
2 实验方法(Experimental methods)
凋落物定植完成后,将凋落物筐低温运至实验室,用纯水轻柔清洗叶子3遍后放进装有60 mL无菌河水(121 ℃,20 min)的150 mL锥形瓶中。其中河水使用隔膜真空泵(LH-85LD,上海昨非实验室设备有限公司)过滤[15],并高温高压灭菌降至室温后使用。取15瓶作为空白对照,剩余60瓶进行相应的处理,分别加入纳米氧化锌悬浮液(30、90、200 nm)1 mL,使其最终浓度达到100 mg·L-1[16-20]。实验采用的是室内模拟的方法,因此需早晚摇三角瓶(光照与黑暗比为12 h:12 h)并记下当时的温度和湿度,同时温度在17~18 ℃,为微生物提供适宜的温度,每隔7天换一次水并重新加入相同浓度的纳米氧化锌。分别在暴露0、4、10、17、27和46 d时取样,一组15个样,每个处理3个重复,随机选取,分别测定真菌生孢率、群落组成、脱氢酶活性、胞外降解酶活性、体系pH值、叶子剩余干重及碳、氮含量等各项指标。
2.1 真菌生孢率及群落组成分析
通过凋落物降解期间叶片上水生丝状真菌产生的分生孢子来评估真菌生孢率及多样性。空白组各夹取8片叶子于装有40 mL河水的锥形瓶中,高压灭菌(121 ℃、20 min),作为阴性对照。另从各处理组中各夹取8片叶子置于装有已灭菌河水的锥形瓶中,加入60μL 0.5% 曲拉通溶液,放入摇床黑暗培养48 h(18 ℃、120 r·min-1),诱导产生孢子。48 h后,将叶片取出并用5μm混合纤维素滤膜依次过滤每一个锥形瓶中的培养液,然后再用0.05% 乳酸酚棉蓝活细胞染液染色并用载玻片固定。20 min后,用400倍光学显微镜观察并记录真菌分生孢子丝、子囊、孢子形状和数量,每个样品观察20个视野[21-22]。最后所有叶片移入烘箱40 ℃干燥72 h并称重,根据式(1)计算出生孢率。
生孢率=孢子总数/培养时间
(1)
其中:脱氢酶活性单位表示为个·h-1;培养时间单位为h。

图1 纳米氧化锌悬浮液的透射电镜图注: (a) 30 nm 氧化锌;(b) 90 nm氧化锌;(c) 200 nm 氧化锌。Fig. 1 Transmission electron microscopy (TEM) images of stock suspensionsNote: (a) 30 nm ZnO, (b) 90 nm ZnO, and (c) 200 nm ZnO.
2.2 脱氢酶活性
早期的研究表明脱氢酶活性与生物量之间存在正相关,脱氢酶活性可以间接反映体系内微生物的生物量[23]。本课题根据Hoostal等[24]测定脱氢酶活性的方法,测定凋落叶降解过程中的脱氢酶活性的变化来表征微生物总量的变化。每个处理取3片叶子加入0.4 mL 2,3,5氯化三苯基四氮唑溶液(由Tris 缓冲液配得,pH值为7.6);在恒温培养箱中30 ℃黑暗培养24 h后加入4 mL丙酮,继续培养2 h,摇匀取上清液测485 nm下的吸光度,根据式(2)计算出脱氢酶活性。
脱氢酶活性=CV/Dwt
(2)
其中:脱氢酶活性单位表示为μg TPF·g-1干重;TPF为甲臢化合物;C为滤液中TPF的浓度(由标准曲线得出);V为凋落物溶液体积;Dwt为凋落物干重。
2.3 胞外降解酶活性
根据Allison实验室可见光酶标法[25]测定8种胞外酶活性,包括酸性磷酸酶(ACP),β-葡萄糖苷酶(BG),纤维二糖水解酶(CBH),亮氨酸氨基肽酶(LAP),甘氨酸氨基肽酶(GAP),多酚氧化酶(PPO),过氧化物酶(POD)以及N-乙酰-葡萄糖苷酶(NAG)。取10片叶盘放于6 mL醋酸钠缓冲液中在冰浴中超声2 min得到酶粗提取液,实验使用酶粗提取液测定胞外降解酶的活性。其测定方法见表1。
2.4 凋落物损失量及碳氮含量
将每瓶样品中的叶子用超纯水轻洗去残留的纳米氧化锌,于40 ℃烘干至恒重(约72 h),用电子天平上(精确度为0.001 g)确定最终干重,凋落叶降解速率根据式Olson提供的公式得出[26]。在降解第0、27和46天时,取凋落叶样品于90 ℃烘干磨碎,用自动元素分析仪(VARIO EL III, ELemental Analysen systeme GmbH, 德国)测凋落叶在初始、中期和末期的碳氮含量。降解微环境的酸碱度由pH计测定。
3 数据处理与分析(Data analysis)
真菌生孢率、脱氢酶活性、胞外降解酶活性、pH、凋落叶降解速率及中期和后期凋落叶的碳氮含量在各处理间的差异性用单因素方差分析;降解速率率与真菌丰度之间的相关性用Pearson相关系数分析;以上分析用SPSS 18.0版软件进行了统计分析且结果在5%的显著性水平;非度量多维尺度分析(NMDS法)用来分析不同处理间水生丝状真菌群落组成的差异性,且用R语言软件3.0.2版vegan 安装包完成。
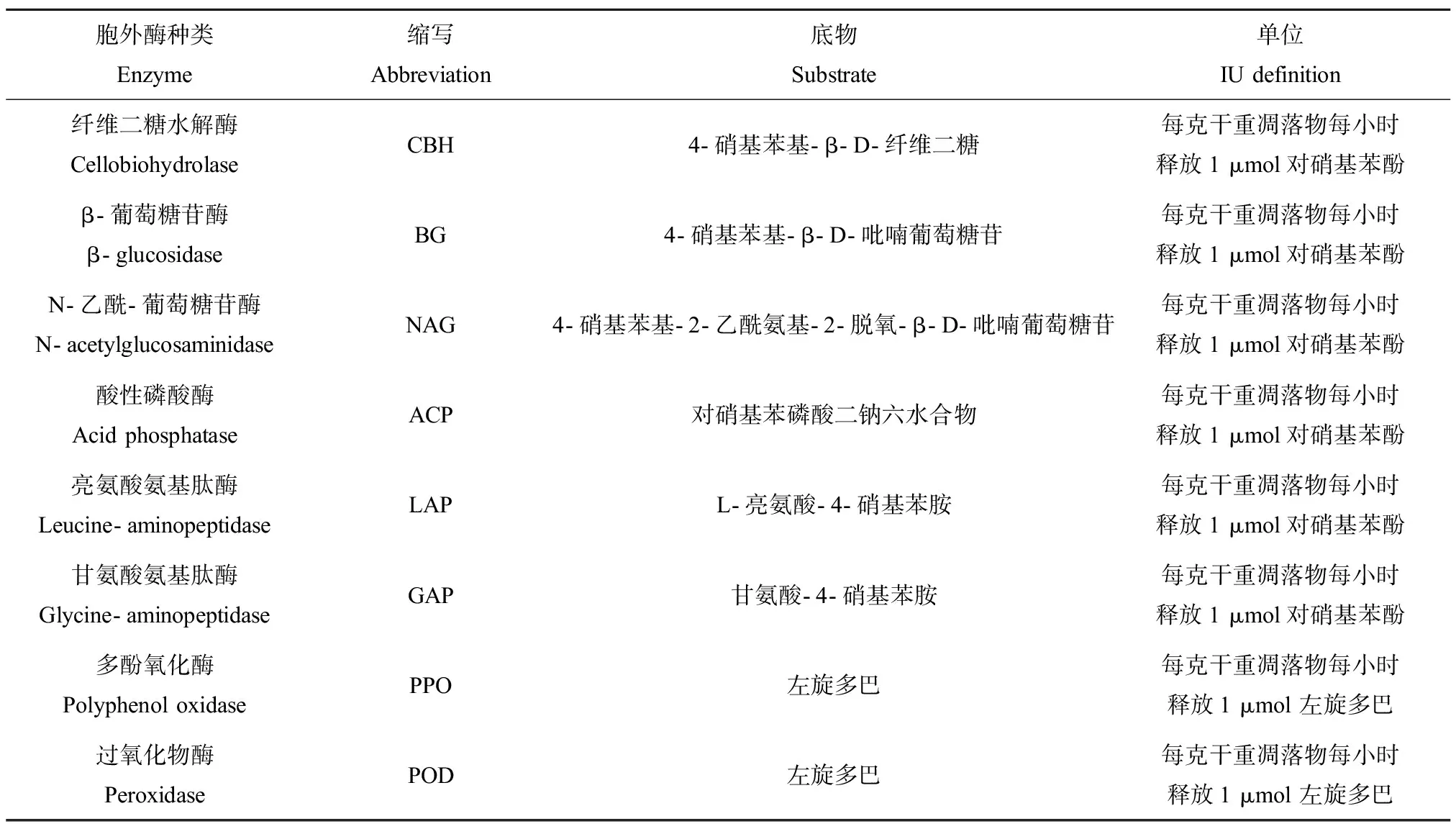
表1 胞外降解酶活性测定方法Table 1 Determination method of extracellular enzyme activities
4 结果与讨论(Results and discussion)
4.1 水生丝状真菌的生孢率
水生丝状真菌生孢率受处理组和降解时间的影响(图2)。小粒径的纳米氧化锌(30 和90 nm)在前期(前4 d)对其具有抑制作用(图2,P< 0.05)。然而,分别在第10 天90 nm氧化锌和第17 天30 nm氧化锌反而对生孢率起到明显的促进作用。这反映了经过一定时间的暴露,水生丝状真菌活性从响应到适应的一个过程。大粒径的纳米氧化锌(200 nm)经过17 d暴露使水生丝状真菌的生孢率显著低于空白组(图2,P< 0.05)且在之后一直处理较低水平,说明纳米氧化锌的粒径越大,其对生态过程的抑制作用显现得越慢[27]。
4.2 水生丝状真菌的群落组成变化
经过46 d的凋落叶降解,纳米氧化锌的介入使水生丝状真菌(基于属水平)群落结构产生了显著变化(图3)。如,纳米氧化锌显著抑制了Astrosphaeriella、Margaritispora、Pestalotiopsis和Massarina在真菌群落中的比例,其中,30 nm氧化锌对Margaritispora的抑制作用显著,90 nm氧化锌对Astrosphaeriella的抑制作用显著,这表明,真菌群落对不同粒径的氧化锌具有不同的响应机制。相反,Ypsilina和Flabellospora在群落中的比例在暴露纳米氧化锌的条件下得到显著提高,以30 nm 和90 nm的氧化锌的促进效应最明显。这表明经过慢性暴露真菌种类对不同粒径的氧化锌逐渐显示出了适应效应。
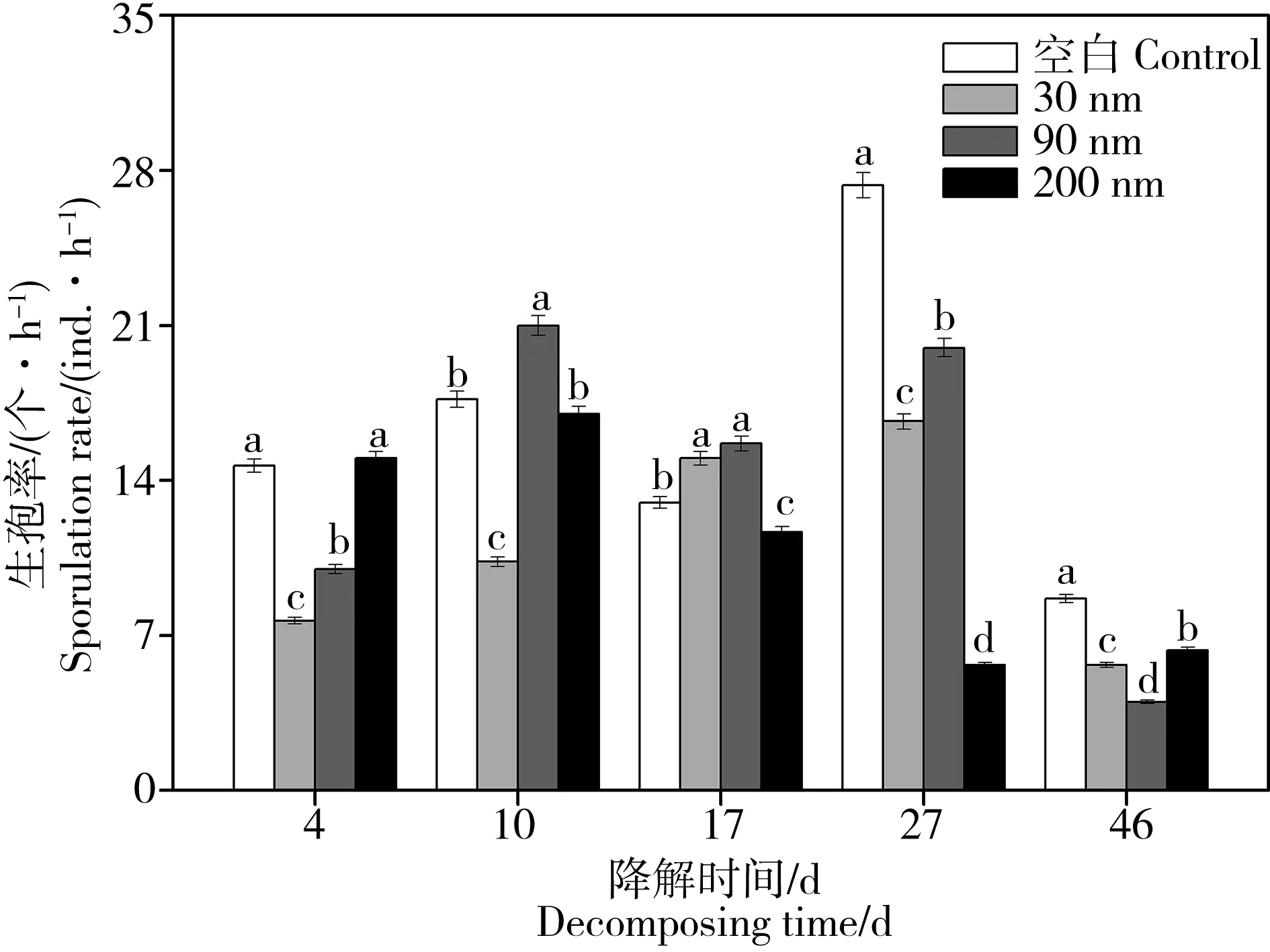
图2 纳米氧化锌慢性暴露对水生丝状真菌生孢率的影响Fig. 2 The impacts of nano-ZnO on aquatic fungal sporulation rate during the chronic exposure
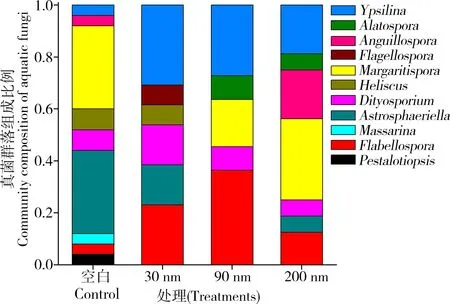
图3 纳米氧化锌对水生丝状真菌的群落组成的影响Fig. 3 The impacts of nano-ZnO on community composition of aquatic fungi
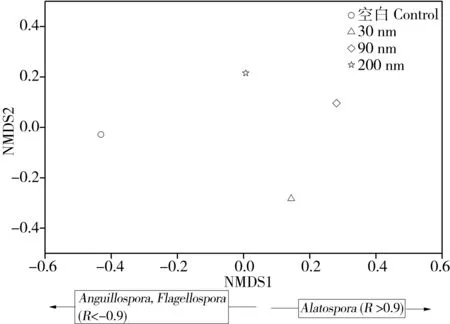
图4 基于水生丝状真菌生孢率的非度量多维尺度(NMDS)群落组成在纳米氧化锌慢性暴露下的差异Fig. 4 Non-metric multidimensional scaling (NMDS) analyses performed on sporulation rate of the fungal community present on Populus nigra L. leaf litter
从水生丝状真菌分生孢子数量角度分析(图 4),得出3种水生丝状真菌的生物量与NMDS1轴有显著的相关性。其真菌生物量具有以下规律:Alatospora在各处理间的生物量排序为:空白组 < 200 nm氧化锌 < 30 nm氧化锌 < 90 nm氧化锌;Anguillospora和Flabellospora在各处理间的生物量排序为:空白组 > 200 nm氧化锌 > 30 nm氧化锌 > 90 nm氧化锌。这表明Anguillospora和Flabellospora的活性被纳米氧化锌显著地抑制,且90 nm 氧化锌抑制作用最强,这可能是由于纳米氧化锌本身或者其释放的Zn2+所致[28];另一方面,经过慢性暴露Alatospora的生孢率得以显著提高,且以90 nm 氧化锌促进作用最强。
4.3 纳米氧化锌对脱氢酶活性的影响
假设纳米氧化锌具有毒性,那么纳米氧化锌的介入将抑制凋落叶降解过程中的微生物的生物量。实验结果表明,脱氢酶活性的变化验证了这个猜想。单因素方差分析显示,纳米氧化锌对微生物的生物量具有显著的抑制作用。通过图5可以看出,纳米氧化锌暴露使脱氢酶活性在前4 d迅速降低,这与我们之前的研究结果类似[9]。其中,30 nm氧化锌使脱氢酶活性降低了4倍,90 nm氧化锌降低了2倍,200 nm氧化锌降低了3倍。对于整个降解周期来说,纳米氧化锌暴露使脱氢酶活性平均值(2.18)比空白对照组脱氢酶酶活平均值(10.40)减少了4倍。暴露在90 nm氧化锌的凋落物脱氢酶活性的最低平均值为1.83,同期暴露在30 nm 氧化锌的凋落物脱氢酶酶活平均值为2.12,200 nm 氧化锌处理组的脱氢酶活性平均值最高为2.59(图5,P< 0.05)。
4.4 纳米氧化锌对胞外降解酶活性的影响
除了BG、LAP和GAP 3种胞外酶之外,纳米氧化锌的暴露显著抑制了大部分胞外酶的活性,其中PPO和NAG在整个降解周期中都受到显著抑制,而30 nm氧化锌却对LAP和GAP具有显著的促进作用(图6,P< 0.05)。研究表明,纳米氧化铜能够引起氧化应激反应,从而导致水生生物的原生质膜破裂,胞外酶释放受阻[29-30]。这样看来,本研究表明纳米氧化锌对水生丝状真菌产生的胞外降解酶活性具有相似的抑制作用。然而也存在一些例外,在某些采样期间,200 nm 氧化锌处理组中ACP、LAP、GAP、POD活性比空白组高,这表明不同胞外酶对纳米氧化锌具有不同的响应机制。
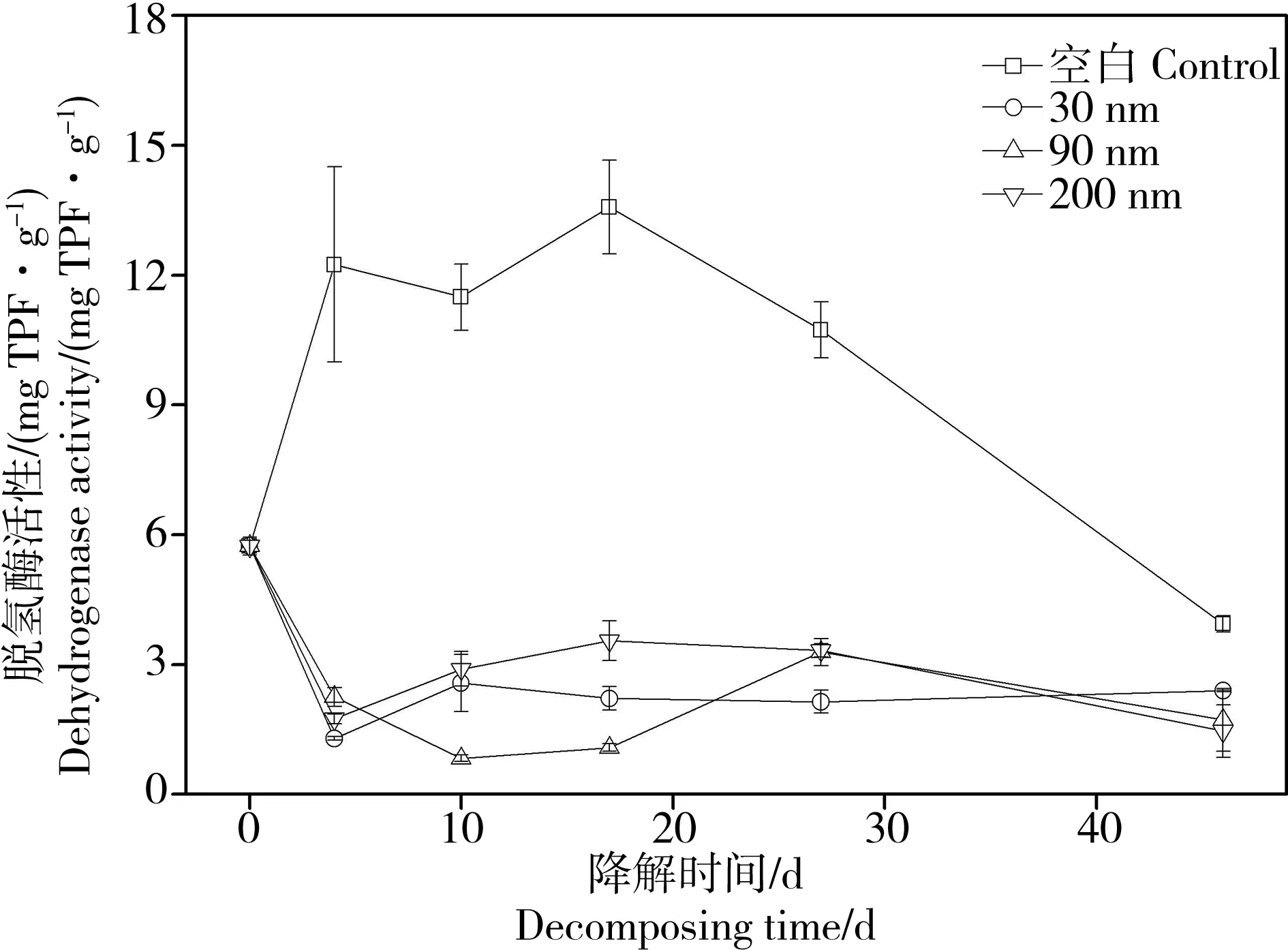
图5 纳米氧化锌慢性暴露对脱氢酶活性的影响Fig. 5 Changes of dehydrogenase activity during chronic exposure of nano-ZnO
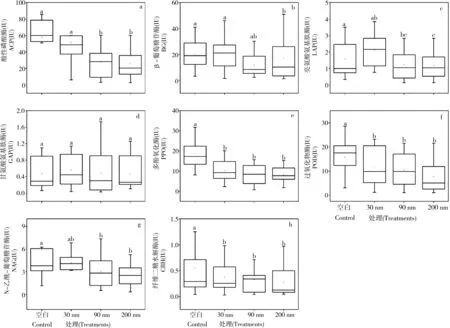
图6 纳米氧化锌对胞外降解酶活性的影响Fig. 6 The impacts of nano-ZnO on extracellular enzymatic activities
4.5 微环境pH值的变化
在46 d的降解周期中,虽然pH值的变化幅度比较小。但单因素方差分析显示,纳米氧化锌的暴露使体系内pH值升高,其中30 nm和200 nm氧化锌处理下pH值显著升高(图7,P< 0.05)。然而,在不同粒径氧化锌处理之间并无明显差异。经过46 d降解,空白组体系内pH均值最低为7.52,30 nm 氧化锌处理组pH均值最高为7.62,其次为200 nm 氧化锌处理组pH均值为7.59,90 nm氧化锌处理组pH均值为7.58(图7)。有研究表明,土壤pH值不受纳米氧化锌介入的影响[31],我们研究与该研究的不同结果说明了纳米氧化锌在不同介质中产生的影响效应是不同的。这是由于纳米氧化锌的环境行为(如聚集、溶解等)会随着环境介质的变化而变化[27, 32-34]。因此,研究纳米氧化锌的环境行为有助于更好地解释其生态毒理机制[35]。
4.6 凋落叶的降解速率
经过46 d的凋落叶降解,空白组的降解速率为0.47,其显著高于纳米氧化锌处理组(图8,P< 0.05),且不同粒径氧化锌处理之间也存在着显著差异(图8,P< 0.05)。30 nm和90 nm氧化锌处理下的降解速率(0.28和0.24)显著低于200 nm氧化锌处理下的降解速率(0.37)。该结果与纳米氧化铈、纳米氧化铜对水体凋落物降解的影响是相同的[36-38]。由于大部分胞外酶被纳米氧化锌所抑制,直接导致水生丝状真菌对凋落叶的降解速率降低[39]。与真菌生孢率和群落组成等指标相联系,我们发现Alatospora、Anguillospora和Flabellospora产生分生孢子的数量在各处理间的变化规律与凋落物降解速率具有一致性。其中,Alatospora的生孢率与降解速率具有显著负相关(R= -0.982,P= 0.018)。这表明以上3种水生丝状真菌在凋落叶降解过程中起到非常重要的作用,其中Alatospora对降解过程具有抑制作用,而后两者对该过程起到积极了作用。Alatospora的生孢率与降解速率的显著负相关表明这种水生丝状真菌是纳米氧化锌的敏感菌,而Anguillospora和Flabellospora的生孢率在纳米氧化锌介入后显著增加,表明这2种菌是纳米氧化锌的耐受菌,但需要慢性暴露才能表现出适应机制。
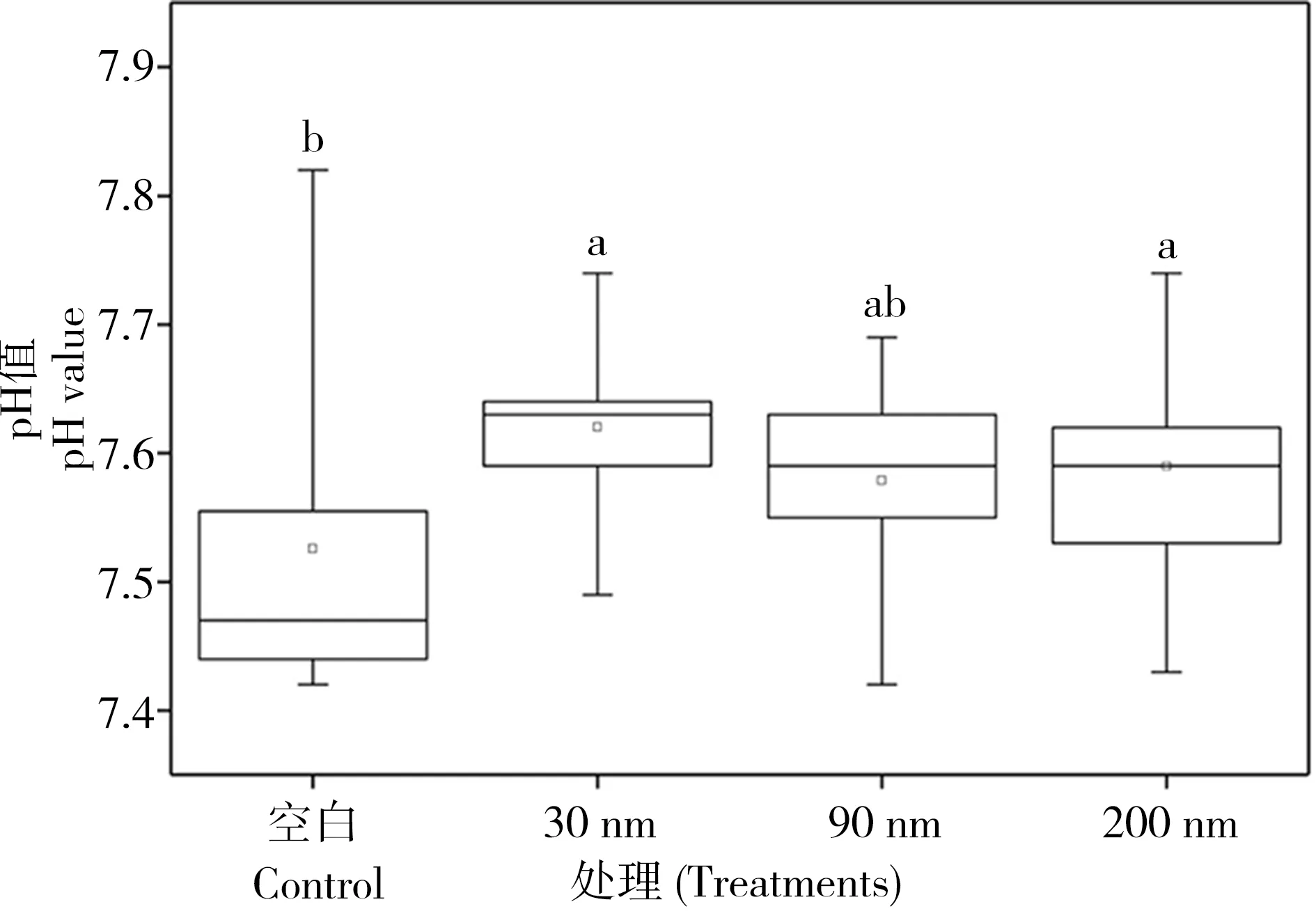
图7 纳米氧化锌慢性暴露对凋落物降解过程中微观生态环境pH值的影响Fig. 7 The effect of nano-ZnO on the pH value of microcosms environment during chronic exposure
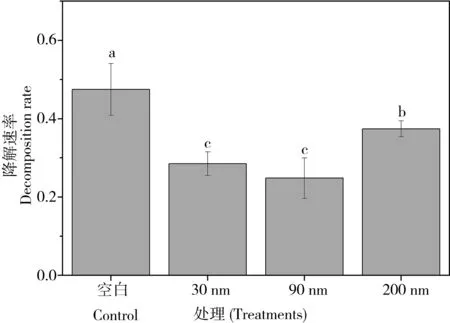
图8 纳米氧化锌对钻天杨凋落叶降解速率的影响Fig. 8 The impacts of nano-ZnO on the decomposition rate of Populus nigra L. leaves litter
4.7 凋落叶碳氮含量的变化
凋落叶降解中期,空白组凋落叶含碳量最高,之后依次是200 nm、30 nm和90 nm 氧化锌处理组,这表明纳米氧化锌促进水生丝状真菌对凋落叶有机碳的降解(表2,P< 0.05),但是在加入纳米氧化锌的处理组之间并无显著差异。同时,与空白组对比,对于有机氮的降解只有90和30 nm 氧化锌处理组表现出显著的促进作用(表2,P< 0.05)。空白组与纳米氧化锌处理组在对凋落叶碳氮比这个指标上并没有明显差异,但是30 nm 氧化锌处理下的凋落叶碳氮比显著高于200 nm 氧化锌(表2,P< 0.05)。这表明,30 nm氧化锌的介入使微生物分泌与氮相关的胞外酶相对于200 nm氧化锌多,这与凋落物含氮量数据相对应。
凋落物降解末期,90 nm 氧化锌处理下凋落叶含碳量最高,之后依次是30 nm 氧化锌、空白组和200 nm 氧化锌,说明经过纳米氧化锌的慢性暴露对凋落叶中的有机碳的降解没有显著的影响,但90 nm 氧化锌处理下的凋落叶碳含量显著高于200 nm 氧化锌(表3,P< 0.05),这说明长期影响下不同粒径的纳米氧化锌对水生丝状真菌有机碳的代谢功能具有差异性。空白组凋落叶含氮量显著高于纳米氧化锌处理组,且纳米氧化锌处理组之间并无明显差异性,这说明200 nm氧化锌在中期时并没有表现出对有机氮具有显著的降解作用,但经过慢性暴露其对凋落叶中有机氮的代谢功能表现出显著的促进作用。因此,慢性或者长期暴露对于评估纳米材料生态毒性是非常必要的。这一点在凋落叶碳氮比这个指标上也得到了验证:纳米氧化锌慢性暴露使末期凋落叶的碳氮比显著高于空白组,且纳米氧化锌处理组之间并无显著差异(表3,P< 0.05)。与中期碳氮比结果相比较,表明纳米氧化锌的慢性暴露使水生丝状真菌在对有机氮的降解功能显著提高,而对有机碳的降解功能并无明显影响,从而使处理组的凋落叶碳氮比显著高于空白组。
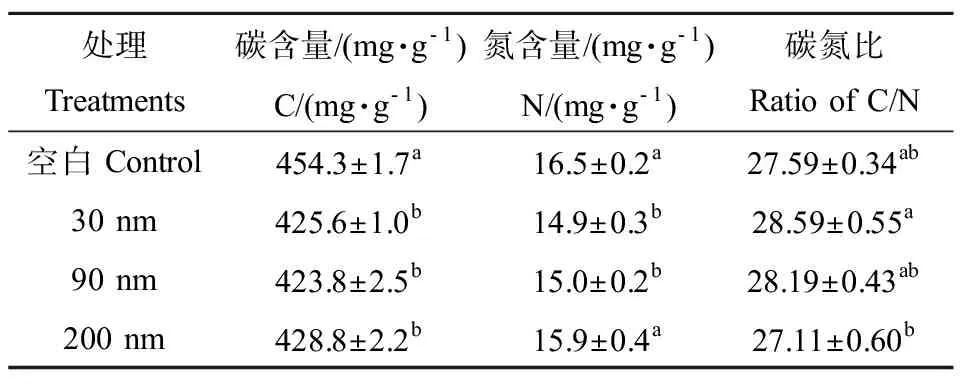
表2 凋落叶降解中期碳氮含量Table 2 The content of carbon and nitrogen of Populus nigra L. leaf litter in the medium term of the chronic exposure
注:不同字母表示各处理间存在显著性差异(P< 0.05)。
Note: Different lowercase letter denotes significant differences (P< 0.05) among treatments.
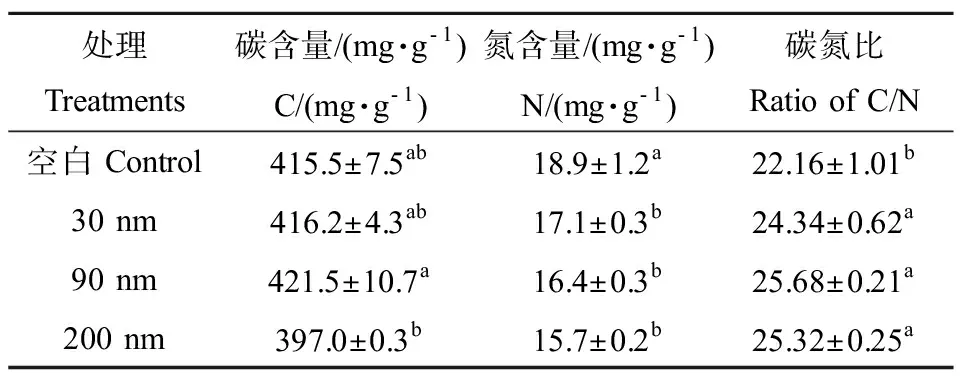
表3 凋落叶降解末期碳氮含量Table 3 The content of carbon and nitrogen of Populus nigra L. leaf litter in the final term of the chronic exposure
注:不同字母表示各处理间存在显著性差异(P< 0.05)。
Note: Different lowercase letter denotes significant differences (P< 0.05) among treatments.
参考文献(References):
[1] Farre M, Gajda-Schrantz K, Kantiani L, et al. Ecotoxicity and analysis of nanomaterials in the aquatic environment[J]. Analytical and Bioanalytical Chemistry, 2009, 393(1): 81-95
[2] Notter D A, Mitrano D M, Nowack B. Are nanosized or dissolved metals more toxic in the environment? A meta-analysis[J]. Environmental Toxicology and Chemistry, 2014, 33(12): 2733-2739
[3] Scown T M, Van A R, Tyler C R. Do engineered nanoparticles pose a significant threat to the aquatic environment?[J]. Critical Reviews in Toxicology, 2010, 40(7): 653-670
[4] Colvin V L. The potential environmental impact of engineered nanomaterials [J]. Nature Biotechnology, 2003, 21 (10): 1166-1170
[5] Krauss G J, Sole M, Krauss G, et al. Fungi in freshwaters: Ecology, physiology and biochemical potential [J]. FEMS Microbiology Reviews, 2011, 35(4): 620-651
[6] Gonçalves A L, Lírio A V, Graça M A S, et al. Fungal species diversity affects leaf decomposition after drought [J]. International Review of Hydrobiology, 2016, 101(1-2): 78-86
[7] Pu G, Tong J, Su A, et al. Adaptation of microbial communities to multiple stressors associated with litter decomposition ofPterocaryastenoptera[J]. Journal of Environmental Sciences, 2014, 26(5): 1001-1013
[8] Pu G, Du J, Ma X, et al. Contribution of ambient atmospheric exposure toTyphaangustifolialitter decomposition in aquatic environment [J]. Ecological Engineering, 2014, 67(6): 144-149
[9] Du J, Zhang Y, Liu L, et al. Can visible light impact litter decomposition under pollution of ZnO nanoparticles? [J]. Chemosphere, 2017, 187: 368-375
[10] Gottschalk F, Sun T, Nowack B. Environmental concentrations of engineered nanomaterials: Review of modeling and analytical studies [J]. Environmental Pollution, 2013,181(6): 287-300
[11] Egon D, Johnson A C, Keller V D J, et al. Nano silver and nano zinc-oxide in surface waters—Exposure estimation for Europe at high spatial and temporal resolution [J]. Environmental Pollution, 2015, 196: 341-349
[12] Xu Y, Wang C, Hou J, et al. Effects of ZnO nanoparticles and Zn2+on fluvial biofilms and the related toxicity mechanisms [J]. Science of The Total Environment, 2016, 544: 230-237
[13] Xiao Y, Vijver M G, Chen G, et al. Toxicity and accumulation of Cu and ZnO nanoparticles inDaphniamagna[J]. Environmental Science & Technology, 2015, 49(7): 4657-4664
[14] Ma H, Williams P L, Diamond S A. Ecotoxicity of manufactured ZnO nanoparticles—A review [J]. Environmental Pollution, 2013, 172(1): 76-85
[15] Ferreira V, Raposeiro P M, Pereira A, et al. Leaf litter decomposition in remote oceanic island streams is driven by microbes and depends on litter quality and environmental conditions [J]. Freshwater Biology, 2016, 61: 783-799
[16] Boxall A, Tiede K, Chaudhry Q, et al. Current and Future Predicted Exposure to Engineered Nanoparticles[M]. York, UK: Central Science Laboratory, 2007
[17] Gottschalk F, Sonderer T, Scholz R W, et al. Modeled environmental concentrations of engineered nanomaterials (TiO2, ZnO, Ag, CNT, fullerenes) for different regions [J]. Environmental Science & Technology, 2009, 43: 9216-9222
[18] Piccinno F, Gottschalk F, Seeger S, et al. Industrial production quantities and uses of ten engineered nanomaterials in Europe and the world [J]. Journal of Nanoparticle Research, 2012, 14: 1-11
[19] Pradhan A, Seena S, Pascoal C, et al. Can metal nanoparticles be a threat to microbial decomposers of plant litter in streams?[J]. Microbial Ecology, 2011, 62: 58-68
[20] Batista D, Pascoal C, Cássio F. How do physicochemical properties influence the toxicity of silver nanoparticles on freshwater decomposers of plant litter in streams?[J]. Ecotoxicology and Environmental Safety, 2017, 140: 148-155
[21] Graça M A S , Bärlocher F, Gessner M O. Methods to Study Litter Decomposition[M]. Springer Netherlands, 2005
[22] Marvanova L P C, Cassio F. New and rare hyphomycetes from streams of northwest Portugal. Part I [J]. Cryptogamie Mycologie, 2003, 24: 339-358
[23] Cochran V L, Elliott L F, Lewis C E. Soil microbial biomass and enzyme activity in subarctic agricultural and forest soils [J]. Biology and Fertility of Soils, 1989, 7(4):283-288
[24] Hoostal M J, Bidart-Bouzat M G, Bouzat J L. Local adaptation of microbial communities to heavy metal stress in polluted sediments of Lake Erie [J]. FEMS Microbiology Ecology, 2008, 65(1): 156-168
[25] The Allison Lab. Enzyme Assays for Fresh Litter and Soil Adapted from Bob Sinsabaugh Lab [R/OL]. [2017-10-31]. http://allison.bio.uci.edu/protocols
[26] Olson J S. Energy storage and the balance of producers and decomposers in ecological systems [J]. Ecology, 1963, 44(2): 322-331
[27] Santo N, Fascio U, Torres F, et al. Toxic effects and ultrastructural damages toDaphniamagnaof two differently sized ZnO nanoparticles: Does size matter?[J]. Water Research, 2014, 53(8): 339-350
[28] Duarte S, Pascoal C, Alves A, et al. Copper and zinc mixtures induce shifts in microbial communities and reduce leaf litter decomposition in streams [J]. Freshwater Biology, 2010, 53: 91-101
[29] Pradhan A, Silva C O, Silva C, et al. Enzymatic biomarkers can portray nano CuO-induced oxidative and neuronal stress in freshwater shredders [J]. Aquatic Toxicology, 2016, 180: 227-235
[30] Adam N, Schmitt C, Bruyn L D, et al. Aquatic acute species sensitivity distributions of ZnO and CuO nanoparticles [J]. Science of the Total Environment, 2015, 526: 233-242
[31] Rashid M I, Shahzad T, Shahid M, et al. Zinc oxide nanoparticles affect carbon and nitrogen mineralization ofPhoenixdactyliferaleaf litter in a sandy soil [J]. Journal of Hazardous Materials, 2017, 324 (Pt B): 298-305
[32] Tripathy N, Hong T K, Ha K T, et al. Effect of ZnO nanoparticles aggregation on the toxicity in RAW 264.7 murine macrophage [J]. Journal of Hazardous Materials, 2014, 270(8): 110-117
[33] Sávoly Z, Buzanich G, Pepponi G, et al. The fate of nano-ZnO and its bulk counterpart in the body of microscopic nematodes: An X-ray spectrometric study [J]. Microchemical Journal, 2015, 118: 80-87
[34] Wu B, Wang Y, Lee Y H, et al. Comparative eco-toxicities of nano-ZnO particles under aquatic and aerosol exposure modes [J]. Environmental Science & Technology, 2010, 44 (4): 1484-1489
[35] Li W M, Wang W X. Distinct biokinetic behavior of ZnO nanoparticles inDaphniamagnaquantified by synthesizing 65Zn tracer [J]. Water Research, 2013, 47(2): 895-902
[36] Bour A, Mouchet F, Cadarsi S, et al. Toxicity of CeO2nanoparticles on a freshwater experimental trophic chain: A study in environmentally relevant conditions through the use of mesocosms [J]. Nanotoxicology, 2016, 10(2): 245-255
[37] Bour A, Mouchet F, Cadarsi S, et al. Impact of CeO2nanoparticles on the functions of freshwater ecosystems: A microcosm study [J]. Environmental Science-Nano, 2016, 3: 830-838
[38] Pradhan A, Seena S, Schlosser D, et al. Fungi from metal-polluted streams may have high ability to cope with the oxidative stress induced by copper oxide nanoparticles [J]. Environmental Toxicology and Chemistry, 2015, 34: 923-930
[39] Tlili A, Jabiol J, Behra R, et al. Chronic exposure effects of silver nanoparticles on stream microbial decomposer communities and ecosystem functions [J]. Environmental Science & Technology, 2017, 51(4): 2447-2455

