白桦脂酸与红枣总三萜酸对小鼠酒精肝损伤的保护作用
蔡天娇,王瑞珍,魏君慧,薛 媛,雷宏杰*,徐怀德*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
红枣为鼠李科枣属植物的成熟果实,我国枣树种植面积已接近300万 hm²,原枣年产量超过800万 t,占世界枣树种植面积和产量的98%以上。红枣是一种药食同源的食品,传统中医药认为红枣具有保肝护肝、补血益气、养胃健脾等功能[1]。红枣不仅含有丰富的糖类、矿物质元素、VC等营养成分[2],还含有多酚、黄酮、环磷酸腺苷以及三萜等多种生物活性成分[3-4]。红枣三萜类化合物中熊果酸、齐墩果酸、白桦脂酸(betulinic acid,BA)等较为典型[5],相关研究多集中在提取[6]与含量分析[7-8]方面,且对于大多数枣品种,白桦脂酸含量较高[9]。
酒精性肝损伤的发病机制比较复杂,包括酒精代谢产物引起的损伤、炎症反应、氧化应激及脂质过氧化等[10-11],已有研究表明北五味子木脂素[12]、灵芝三萜酸[13]及石斛多糖[14]等多种中药提取物对酒精性肝损伤具有一定的保护作用。三萜类化合物是一种重要的中药化学成分,其中熊果酸可通过抑制TGF-β1与其受体的结合或降低TGF-β1表达有效阻止酒精引起的肝纤维化[15],齐墩果酸可通过干预酒精诱导的氧化应激等多种机制有效干预酒精性肝损伤[16-17],白桦脂醇作为BA的前体物质也被证明对酒精性肝损伤具有一定的保护作用[18],而关于BA的研究多集中于消炎[19-20]、抗癌[21-22]等方面;汪佰莉等[23]探讨了BA在急性免疫性肝损伤中的作用及对细胞因子和凋亡相关蛋白Bcl-2、activated-Caspase-3表达的影响,通过肝脏细胞实验证明BA对小鼠急性免疫性肝损伤具有一定拮抗作用。但BA和红枣总三萜酸(total triterpenic acids from red jujube,JTTA)保肝作用的动物实验研究鲜见报道。
为此,本研究采用酒精性肝损伤小鼠模型,分析其肝脏指数、肝脏病理学与生化指标,探讨BA与JTTA对小鼠酒精性肝损伤的保护作用及机制,为红枣中三萜酸的进一步开发与研究提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性昆明小鼠,体质量(20±2)g,由西安交通大学医学部实验动物中心提供。在温度(22±2)℃,相对湿度(55±5)%下饲养,控制照明时间为每天12 h,给予标准普通饲料和充足的饮用水,自由进食与饮水。
红枣采自陕西清涧,经烘箱50 ℃烘干,粉碎过40 目筛。
白桦脂酸(色谱级,纯度≥98%) 南京春秋生物工程有限公司;水飞蓟素胶囊 德国马博士大药厂;丙二醛(malondialdehyde,MDA)、肝脏谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒 南京建成生物工程研究所;羧甲基纤维素钠 国药集团;二锅头白酒 北京红星股份有限公司;其余试剂均为分析纯。
1.2 仪器与设备
UV-1780紫外-可见分光度仪 日本岛津公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;7180型全自动生化分析仪 日本日立公司;FA1004电子天平 上海恒平科学仪器有限公司;HH-8水浴锅 上海精宏实验设备有限公司;E100生物显微镜日本尼康公司。
1.3 方法
1.3.1 红枣总三萜酸的制备
称取一定量红枣粉,先进行纤维素酶酶解,酶解条件为:加酶量1.5 mg/g,酶解时间40 min,酶解温度60 ℃,酶解pH 4.5,然后进行超声波辅助提取,提取条件:以80%乙醇为提取溶剂,料液比1∶25(m/V),50 ℃、400 W超声处理20 min,重复提取2 次,过滤。滤液合并后旋转蒸发成浸膏状,将浸膏用蒸馏水分散,调pH值为4,以氯仿为萃取剂,采取两相萃取法萃取,氯仿层旋转蒸发干燥、蒸馏水分散后用D101大孔树脂纯化。纯化条件:上样pH 7,上样体积为7 BV,洗脱剂为95%乙醇,洗脱剂pH 11,洗脱剂体积5 BV。洗脱液蒸干后得微黄色红枣总三萜酸纯化物,采用紫外-可见分光光度法,在550 nm波长处检测吸光度,其纯度可达78%。
1.3.2 小鼠酒精性肝损伤模型的建立
小鼠适应性喂养7 d后,将小鼠随机分为正常对照组、模型组、BA低(25 mg/kg)、中(50 mg/kg)、高(100 mg/kg)剂量组、JTTA组(50 mg/kg)和水飞蓟素阳性对照组(50 mg/kg),每组12 只。各给药组每天灌胃给药一次,正常对照和模型组给予等量溶媒(0.5%羧甲基纤维素钠溶液),连续6 周。小鼠每周称质量2 次,根据体质量调整给药量。模型组和各给药组于第3周开始,灌胃给予二锅头白酒配制的30%乙醇。正常对照组给予等量溶剂。各给药组在灌胃给药间隔4 h以上再给予乙醇,连续4 周。
1.3.3 样品的采集与处理
于末次灌胃后,各组小鼠禁食不禁水16 h后,对各组小鼠称质量,摘眼球取血,收集血液,放置30 min,4 000 r/min离心15 min,分离血清于1.5 mL离心管中,4 ℃保存。小鼠颈椎脱臼处死后解剖取肝脏,用4 ℃预冷的生理盐水冲净表面浮血,滤纸拭干,称质量,剪取肝左叶组织浸入4%多聚甲醛中固定,制作石蜡切片,苏木精-伊红(hematoxylin-eosin,HE)染色,并于光学显微镜下检查组织病理学变化;剪取剩余部分肝组织,用预冷生理盐水冲洗并制备10%肝脏组织匀浆。
1.3.4 检测指标及方法
1.3.4.1 一般情况观察
实验期间观察小鼠的体质量变化、进食、毛发、状态、行为及死亡情况。
1.3.4.2 小鼠肝脏指数测定
小鼠肝脏指数根据下式计算。
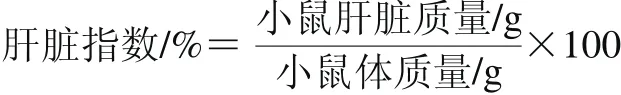
1.3.4.3 肝脏病理学检查
于400 倍光学显微镜下观察肝细胞的形态变化、炎症反应、纤维化、脂肪空泡等病理改变。
1.3.4.4 生化指标的检测
采用全自动生化分析仪测定血清中血清谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)活力等肝功能指标与血清中甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)浓度等脂肪代谢指标;按照试剂盒说明书进行肝匀浆MDA含量、GSH-Px、SOD活力等肝脏抗氧化能力指标测定。
1.4 数据统计分析
实验结果以表示,采用Minitab 16.2.3软件对数据进行统计和差异显著性分析,P<0.05为显著性差异。
2 结果与分析
2.1 BA、JTTA对酒精性肝损伤小鼠体质量的影响
整个实验过程中,正常对照组小鼠状况良好,饮食排泄均正常,体质量逐渐增加,无死亡现象。在乙醇灌胃期间,模型组、BA组、JTTA组小鼠及阳性对照组出现不同程度的异常情况。尤其是模型组小鼠行动迟缓、毛发凌乱、光泽度差,个别有脱毛现象,各剂量组和水飞蓟素组小鼠状态各有不同程度的改善。
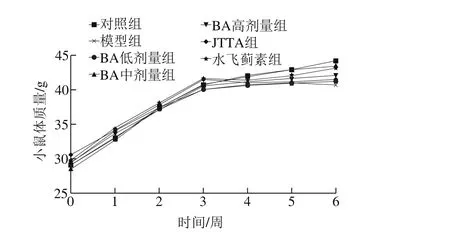
图1 各组小鼠体质量变化曲线Fig. 1 Body weight change in mice from different groups
各组小鼠体质量变化情况如图1所示,灌胃酒精前,各组小鼠体质量均正常增长,且组间差异不显著,第3周开始灌胃酒精后,模型组与对照组相比,小鼠体质量增长速率明显减慢,灌胃后期小鼠体质量基本不再增长甚至呈下降趋势,且在实验结束时,模型组小鼠体质量明显低于正常组。给药组与模型组相比,小鼠体质量增长情况均有改善。
2.2 BA、JTTA对酒精性肝损伤小鼠肝脏指数的影响
由图2可知,模型组小鼠的肝脏指数与对照组相比,肝脏指数升高了7.01%,差异显著(P<0.05),说明酒精灌胃能够使小鼠发生肝肿胀现象,使肝脏指数升高;与模型组相比,水飞蓟素组、JTTA组及BA低、中、高剂量组小鼠肝脏指数均有所降低,其中JTTA组效果最为显著,达到了正常对照组水平,不同剂量BA处理组之间并没有显著性差异。
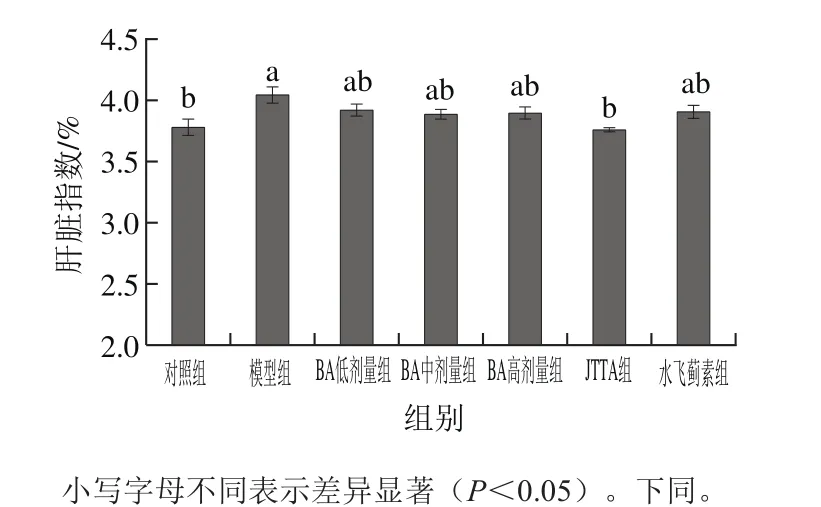
图2 BA、JTTA对小鼠肝脏指数的影响Fig. 2 Effects of BA and JTTA on liver index
2.3 BA、JTTA对酒精性肝损伤小鼠肝脏病理组织的影响
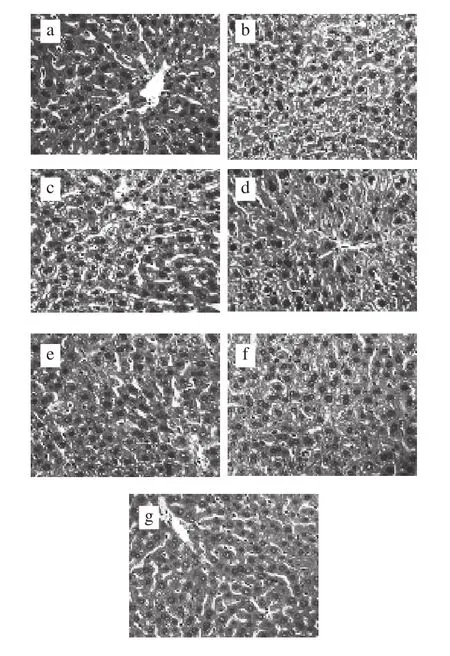
图3 BA、JTTA对小鼠肝脏组织病理损伤的影响(×400)Fig. 3 Effects of BA and JTTA on pathological liver injury (× 400)
HE染色光学显微镜观察结果如图3所示,对照组小鼠肝小叶结构清晰,肝细胞索以小叶中央静脉为中心呈放射状排列,肝小叶内网状纤维支架结构完整,分布规律,汇管区及其周围无炎症细胞浸润,肝细胞无明显的脂肪变性、水肿、坏死等,排列整齐。模型组小鼠肝组织病理损伤严重,肝细胞明显肿胀,可见大小不一、数量不等的脂滴并伴有气球样变以及细胞水肿;肝小叶结构紊乱,肝索排列不规则。低剂量组与模型组相比,小鼠肝细胞气球样变及细胞水肿情况有所改善,但肝小叶结构仍然混乱。中、高剂量BA干预后,小鼠肝脏脂肪变性得到改善,肝脏排列较为整齐,组织结构趋于正常。而JTTA干预后,小鼠肝组织病理损伤也得到明显改善,肝小叶结构也趋于完整。水飞蓟素组小鼠肝细胞、肝小叶结构也基本正常。
2.4 BA、JTTA对酒精性肝损伤小鼠肝功能的影响
ALT和AST均为非特异性细胞内功能酶,是临床上常用的肝功能评价指标[24]。正常时其在血清中的含量很低,当肝细胞损伤时,血清中ALT和AST活力会随之发生变化,所以ALT与AST活力的高低可以在一定范围内反映生物体内肝细胞的损伤程度[25]。
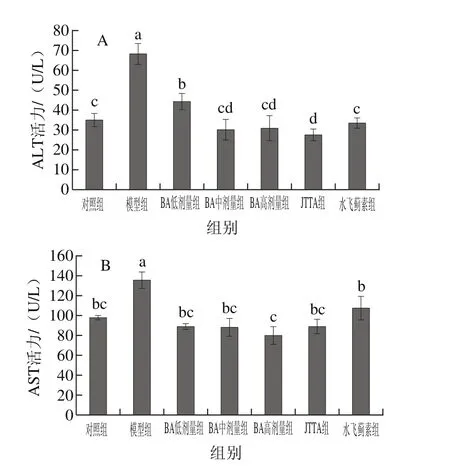
图4 BA、JTTA对小鼠血清ALT(A)、AST(B)活力的影响Fig. 4 Effects of BA and JTTA on ALT (A) and AST (B) activities in serum
由图4可知,同对照组比较,模型组小鼠血清的ALT、AST活力分别增加了78.58%、38.65%,显著性升高(P<0.05),说明成功建立模型。不同剂量BA、JTTA及水飞蓟素处理后,小鼠血清的ALT、AST活力均显著降低(P<0.05),且BA高剂量组、JTTA、水飞蓟素处理组小鼠血清的ALT、AST活力已基本达到正常水平。
2.5 BA、JTTA对酒精性肝损伤小鼠肝脏脂肪代谢的影响
肝脏发生脂肪性病变时,脂肪代谢能力下降,导致血液中TG、TC浓度上升[26]。HDL-C、LDL-C则与胆固醇在体内的运输密切相关,浓度会随着血液中TG、TC浓度的变化而改变[27]。
由表1可知,模型组小鼠血清的TG、TC浓度均明显高于对照组(P<0.05),各样品处理组与模型组相比,小鼠血清的TG、TC浓度显著降低(P<0.05),BA低、中、高处理组小鼠血清的TG浓度分别下降了17.99%、28.04%和28.57%,小鼠血清的TC浓度分别下降了8.31%、12.23%、16.15%,表现出一定的剂量依赖型,JTTA对TG、TC浓度也表现出了明显的抑制作用。且同对照组相比,模型组小鼠血清的HDL-C浓度明显下降,LDL-C浓度显著上升。BA不同剂量处理组、JTTA组及水飞蓟素组小鼠血清的HDL-C水平均有不同程度升高,LDL-C浓度则有不同程度的降低,但不同剂量白桦脂酸处理组之间并没有表现出显著性差异,不具有明显的剂量效应关系。
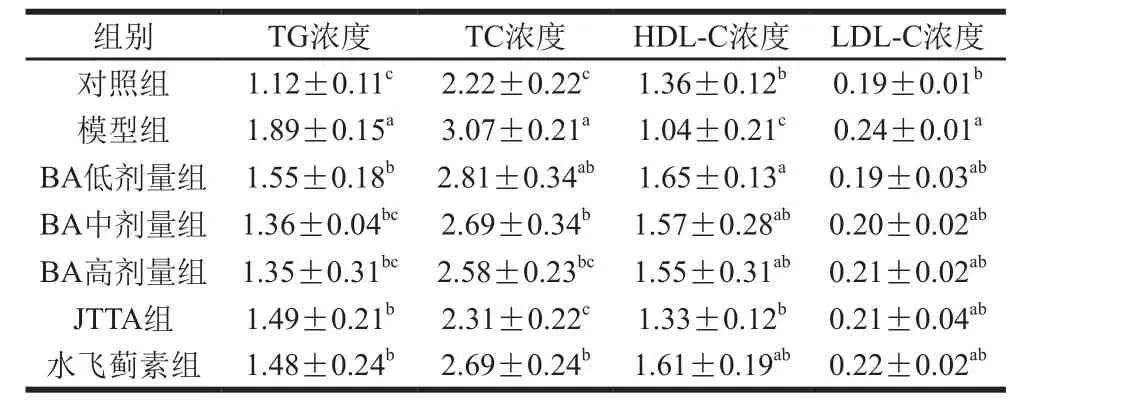
表1 BA、JTTA对小鼠血清TG、TC、HDL-C及LDL-C浓度的影响Table 1 Effects of BA and JTTA on TG, TC, HDL-C and LDL-C levels in serum mmol/L
2.6 BA、JTTA对酒精性肝损伤小鼠肝脏抗氧化能力的影响
小鼠在酒精连续灌胃4 周后,机体内乙醇代谢引发多种氧化应激反应,模型组小鼠肝脏过氧化物的含量明显升高,抗氧化能力明显降低,而不同剂量BA处理组、JTTA组及水飞蓟素组小鼠肝脏抗氧化能力有所改善。
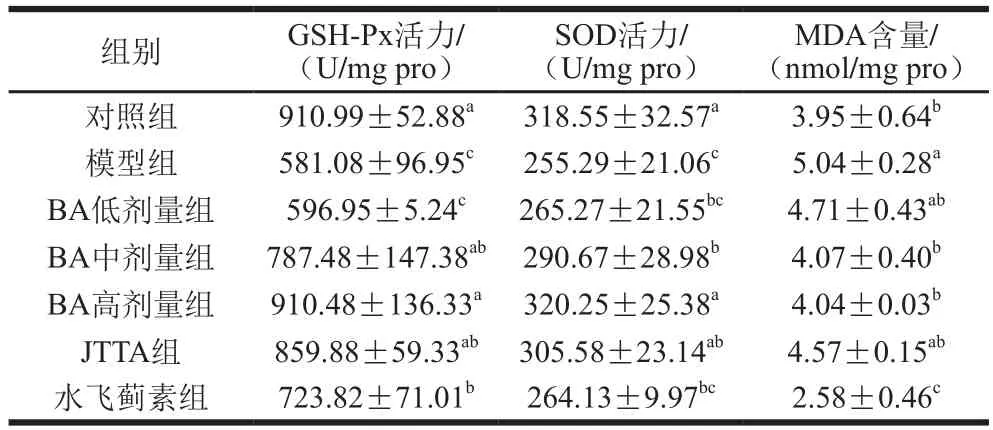
表2 BA、JTTA对小鼠肝脏GSH-Px、SOD活力及MDA含量的影响Table 2 Effects of BA and JTTA on GSH-Px and SOD activities and MDA content in liver
由表2可知,模型组小鼠肝脏GSH-Px、SOD活力与对照组相比,显著下降(P<0.05)。BA低、中、高剂量处理组与模型组相比,GSH-Px活力分别提高了2.73%、35.52%、56.69%,SOD活力分别提高了3.91%、13.86%、25.45%,均表现出明显的剂量依赖性,且高剂量组GSH-Px、SOD活力接近正常水平,JTTA组GSH-Px、SOD活力则分别提高了47.85%、19.71%,与对照组相比也无显著性差异。
MDA作为脂质过氧化终产物[28]是反映组织损伤时出现的过强氧化作用的指标之一,组织中MDA含量越高,氧化活性越强,组织受损程度越大[29-30]。由表2可知,模型组与对照组相比,小鼠肝脏MDA含量上升了27.53%,差异显著(P<0.05),BA低、中、高剂量处理组与模型组相比,小鼠肝脏MDA含量分别降低了6.51%、19.25%、19.88%,中、高剂量组之间并没有显著性差异,JTTA组与模型组相比,小鼠肝脏MDA含量则下降了9.34%。
3 结 论
BA低、中、高剂量处理组与模型组相比,小鼠体质量增长情况有所改善,肝脏指数及肝组织结构病理损伤程度明显降低,血清中ALT、AST活力显著降低,表示肝功能得到一定改善;血清中TG、TC、LDL-C浓度显著降低,HDL-C浓度显著升高,说明BA能够改善脂肪代谢功能;肝组织中MDA含量显著降低、GSH-Px、SOD活力显著升高,说明BA能够增强SOD及GSH-Px的活力,提高肝脏抗氧化系统的能力,减少细胞膜脂质过氧化产物MDA的含量。
JTTA组各项指标与BA处理组具有相同的变化趋势,肝功能与脂肪代谢功能均得到显著改善,肝脏抗氧化能力也显著增强。且与等剂量BA处理组相比,大部分指标表示其对酒精性肝损伤也具有同样良好的干预作用。
BA和JTTA均可以通过降低酒精对肝脏抗氧化系统的损伤,抑制脂质过氧化达到保肝护肝的目的。红枣中含有白桦脂酸、熊果酸、齐墩果酸等多种具有保肝作用的三萜酸,可以有效干预酒精性肝损伤,为将红枣开发为保肝护肝保健食品提供科学依据。
[1] 刘润平. 红枣的营养价值及其保健作用[J]. 中国食物与营养, 2009,21(12): 50-52.
[2] 周禹含, 毕金峰, 陈芹芹, 等. 中国红枣加工及产业发展现状[J]. 食品与机械, 2013, 29(4): 214-217. DOI:10.3969/j.issn.1003-5778.2013.04.053.
[3] 苗利军. 枣果中三萜酸等功能性成分分析[D]. 保定: 河北农业大学,2006: 1-5.
[4] LIM T K. Edible medicinal and non-medicinal plants[M]. Berlin:Springer, 2012: 578-604. DOI:10.1007/978-90-481-8661-7.
[5] 高娅, 杨洁, 杨迎春, 等. 不同品种红枣中三萜酸及环核苷酸的测定[J].中成药, 2012, 34(10): 1961-1965.
[6] 胡云峰, 姜晓燕, 崔翰元, 等. 响应面法优化超声波提取灵武长枣中三萜类化合物的研究[J]. 食品工业科技, 2010, 31(5): 260-263.DOI:10.13386/j.issn1002-0306.2010.05.015.
[7] GUO S, DUAN J A, QIAN D W. Content variations of triterpenic acid,nucleoside, nucleobase, and sugar in jujube (Ziziphus jujuba) fruit during ripening[J]. Food Chemistry, 2015, 167: 468-474.
[8] 周晓英, 王东东, 刘宏炳. RP-HPLC法测定新疆6 种红枣中齐墩果酸和熊果酸的含量[J]. 食品科技, 2012, 37(2): 288-290. DOI:10.13684/j.cnki.spkj.2012.02.032.
[9] 胡芳, 赵智慧, 刘孟军. HPLC法测定不同枣品种果实中白桦酯酸、齐墩果酸和熊果酸含量[J]. 中国农学通报, 2011, 27(5): 434-438.
[10] JIANG Z H, CHEN C, WANG J, et al. Purple potato (Solanum tuberosum L.) anthocyanins attenuate alcohol-induced hepatic injury by enhancing antioxidant defense[J]. Journal of Natural Medicines,2016, 70(1): 45-53. DOI:10.1007/s11418-015-0935-3.
[11] REDDY J K, RAO M S. Lipid metabolism and liver inflammation.Ⅱ.fatty liver disease and fatty acid oxidation[J]. American Journal of Physiology: Gastrointestinal and Liver Physiology, 2006, 290(5): 852-858. DOI:10.1152/ajpgi.00521.2005.
[12] 王春梅, 李贺, 李生, 等. 北五味子木脂素对小鼠酒精性肝损伤的保护作用[J]. 食品科学, 2014, 35(13): 262-265. DOI:10.7506/spkx1002-6630-201413052.
[13] 钱明雪, 李胜立, 李凡, 等. 6 种石斛多糖抗亚急性酒精性肝损伤作用的比较[J]. 中国药学杂志, 2015, 50(24): 2117-2123. DOI:10.11669/cpj.2015.24.006.
[14] 李鹏, 魏晓霞, 南婷婷, 等. 灵芝三萜酸对小鼠急性肝损伤的保护作用[J]. 中国医院药学杂志, 2013, 33(23): 1914-1918. DOI:10.13286/j.cnki.chinhosppharmacyj.2013.23.005.
[15] 周娟娟, 朱萱. 熊果酸抗肝纤维化作用及其机制的研究进展[J]. 世界华人消化杂志, 2015, 23(21): 3390-3395. DOI:10.11569/wcjd.v23.i21.3390.
[16] HOSKERI H J, KRISHNA B, KUMAR B V, et al. In vivo prophylactic eあects of oleanolic acid isolated from chloroform extract of Flaveria trinervia against ethanol induced liver toxicity in rats[J]. Archives of Pharmacal Research, 2012, 35(10): 1803-1810. DOI:10.1007/s12272-012-1013-y.
[17] GUTIÉRREZ-REBOLLEDO G A, SIORDIA-REYES A G, MECKESFISCHER M, et al. Hepatoprotective properties of oleanolic and ursolic acids in anti-tubercular drug-induced liver damage[J].Asian Pacific Journal of Tropical Medicine, 2016, 9(7): 644-651.DOI:10.1016/j.apjtm.2016.05.015.
[18] 张桂英, 吴光健, 王宝贵, 等. 白桦脂醇对大鼠酒精性肝损伤保护作用[J]. 中国公共卫生, 2009, 25(3): 378-379.
[19] WANG S G, YANG Z Y, XIONG F X, et al. Betulinic acid ameliorates experimental diabetic-induced renal inflammation and fibrosis via inhibiting the activation of NF-κB signaling pathway[J]. Molecular and Cellular Endocrinology, 2016, 434: 135-143. DOI:10.1016/j.mce.2016.06.019.
[20] CHO Y H, KIM N H, KHAN I, et al. Anti-inflammatory potential of quercetin-3-O-D-(“2”-galloyl)-glucopyranoside and quercetin isolated from Diospyros kaki calyx via suppression of MAP signaling molecules in LPS-induced RAW 264.7 macrophages[J]. Journal of Food Science, 2016,81(10): C2447-C2456. DOI:10.1111/1750-3841.13497.
[21] LIU Y P, GAO D W, ZHANG X W, et al. Antitumor drug effect of betulinic acid mediated by polyethylene glycol modified liposomes[J].Materials Science & Endineerings C: Materials for Biological Applications, 2016, 64: 124-132. DOI:10.1016/j.msec.2016.03.080.
[22] 时文波, 甘为, 黄雪莲, 等. 白桦脂酸诱导乳腺癌细胞MCF-7凋亡的机制研究[J]. 中药药理与临床, 2015, 31(6): 39-43. DOI:10.13412/j.cnki.zyyl.2015.06.013.
[23] 汪佰莉, 吴焕童, 曹畅, 等. 白桦脂酸对免疫性肝损伤小鼠细胞因子及Bcl-2、activated-Caspase-3表达的影响[J]. 四川动物, 2016, 35(4):511-516. DOI:10.11984/j.issn.1000-7083.20160091.
[24] WANG M, SUN J G, JIANG Z H, et al. Hepatoprotective effect of kaempferol against alcoholic liver injury in mice[J]. American Journal of Chinese Medicine, 2015, 43(2): 241-254. DOI:10.1142/S0192415X15500160.
[25] 江海涛, 吴雨龙, 王仁雷, 等. 蛹虫草基质多糖对酒精所致小鼠急性肝损伤的保护作用[J]. 食品科学, 2014, 35(13): 223-227.DOI:10.7506/spkx1002-6630-201413043.
[26] WAKABAYASHI I. Associations between heavy alcohol drinking and lipidrelated indices in middle-aged men[J]. Alcohol, 2013, 47(8): 637-642.
[27] CHEN Y L, PENG H C, TAN S W, et al. Amelioration of ethanolinduced liver injury in rats by nanogold flakes[J]. Alcohol, 2013,47(6): 467-472. DOI:10.1016/j.alcohol.2013.05.006.
[28] 张自强, 刘玉梅, 朱雪敏, 等. 6-苄氨基嘌呤对四氯化碳致小鼠肝氧化损伤的保护作用[J]. 中国临床药理学杂志, 2015, 31(11): 928-931.DOI:10.13699/j.cnki.1001-6821.2015.11.009.
[29] SID B, VERRAX J, CALDEROL P B. Role of oxidative stress in the pathogenesis of alcohol-induced liver disease[J]. Free Radical Research,2013, 47(11): 894-904. DOI:10.3109/10715762.2013.819428.
[30] 田密霞, 李亚东, 胡文忠, 等. 蓝莓花色苷对实验性糖尿病小白鼠肝脏抗氧化功能的影响[J]. 食品科学, 2017, 38(1): 210-213.DOI:10.7506/spkx1002-6630-201701035.

