超高压对鸡肉肌原纤维蛋白-MgCl2凝胶特性的影响
潘 杰,周 颖,王 昱,代显卓,李沛军,陈从贵*
(合肥工业大学食品科学与工程学院,安徽 合肥 230009)
肌原纤维蛋白(myofibrillar protein,MP)是肌肉中重要的结构蛋白质群,包括肌球蛋白、肌动蛋白、肌动球蛋白、肌钙蛋白等;是形成肉凝胶的主要成分,与肉制品的质构、保水、流变等特性密切相关[1-2]。众所周知,高盐(钠盐)饮食危害人体健康;有数据显示,肉和肉制品贡献了食物中16%~25%的钠盐摄入量[3]。因此实现肉制品的低盐化,对推动健康饮食具有重要的作用。
在低盐肉制品开发研究中,钠盐替代盐、超高压处理(high pressure processing,HPP)及两者的结合已受到关注[4-5]。MgCl2作为典型的二价盐,当其浓度低于5 mmol/L时,可提高鸡胸肉MP的热凝胶强度;而高于10 mmol/L时,则会减弱凝胶强度[6]。MgCl2部分替代钠盐,能增加猪肉MP的溶解度,提高MP乳化凝胶的黏弹性,并降低汁液流失[7]。HPP作为一种非热加工技术,可在保留肉制品营养成分的前提下,有效杀灭微生物,延长货架期[8];可提高肉蛋白凝胶的功能特性,改善肉制品的品质[9];HPP后的肌动球蛋白,在高、低离子强度的溶液中都有较强的热凝胶能力[10];300 MPa的HPP可使低盐(质量分数0.3% NaCl)鱼糜凝胶的机械性能和感官性能达到与高盐(3% NaCl)凝胶相当的水平[11]。此外,食盐与HPP之间还具有一定的互补效应[12]。可见,HPP在肉制品减盐加工中具有应用潜力。但HPP对MP-MgCl2混合体系凝胶特性的影响如何,尚鲜见文献报道。
本研究考察了MP-MgCl2凝胶硬度和保水性(water holding capacity,WHC)对HPP的响应规律,并通过混合溶胶流变特性分析及凝胶横向弛豫时间与微结构分析,探讨HPP混合体系凝胶特性的变化机制,以期为低盐肉制品的开发提供理论参考。
1 材料与方法
1.1 材料与试剂
鸡胸肉购于合肥家乐福,冰箱中冷藏(约4 ℃)。
无水氯化镁(MgCl2纯度≥99.9%) 上海阿拉丁生化科技股份有限公司;其他试剂均为分析纯。
1.2 仪器与设备
HPP600 MPa/0.6 L超高压处理装置 包头科发高压科技有限责任公司;BC/BD-241GS冷藏柜 青岛Haier集团公司;Kertone labmini4 UV超纯水机 湖南科尔顿水务有限公司;DS-1组织捣碎机 上海越磁电子科技有限公司;RCT Basic磁力搅拌器 德国IKA公司;FA25高剪切乳化机 上海弗鲁克流体机械制造有限公司;CT-14RD冷冻离心机 上海天美生化仪器设备有限公司;GL-21M高速离心机 湖南湘仪实验室仪器开发有限公司;TA.XT Plus质构仪 英国Stable Micro Systems公司;HR-3 Discovery流变仪 美国TA公司;NMI20-015V-I核磁共振成像分析仪 苏州纽迈分析仪器股份有限公司;JSM 6490LV扫描电子显微镜(scanning electron microscope,SEM)、JFC-1600喷金仪 日本JEOL公司。
1.3 方法
1.3.1 MP的提取
剔除新鲜鸡胸肉中的可见脂肪和结缔组织,切碎、称质量。参考Park[13]和Westphalen[14]等的方法提取MP,提取过程在0~4 ℃低温环境下进行;经离心所得的最终MP沉淀,用0.4 mol/L NaCl磷酸盐缓冲溶液(pH 7.0)将MP质量浓度调整至40 mg/mL。
1.3.2 MP-MgCl2溶胶制备
取上述MP溶液900 g,向其中添加质量分数0.3%的MgCl2;将所得混合溶液在冰浴中缓慢搅拌20 min,使MP与MgCl2充分混匀,即得MP-MgCl2混合溶胶。
1.3.3 超高压处理
参照Ma Fei等[15]的方法。将上述MP-MgCl2混合溶胶沿袋壁注入聚乙烯袋内,真空包装;在室温下(20~25 ℃),水作为传压介质,压力水平设为100、200、300、400 MPa,保压时间10 min。样品加压前后均保存在冰浴中,受压后的样品在5 h内完成随后的热凝胶化处理及流变学分析。
1.3.4 MP-MgCl2凝胶制备
将受压MP-MgCl2样品倒入规格为Φ 27 mm×35 mm(供凝胶硬度测定)和Φ 23 mm×37 mm(供凝胶WHC测定)的10 mL小烧杯中,放入20 ℃水浴锅中平衡10 min;20 ℃升温至80 ℃后(约30 min),于80 ℃保温30 min;然后取出,冰水浴冷却10 min,4 ℃静置12 h,供检测。非受压样品作为对照。
1.3.5 凝胶硬度测定
参照Zhou Yanzi等[16]的方法。利用TA.XT Plus质构仪GMIA程序测定。参数为:P/0.5探头,探头下降速率1.50 mm/s,测试速率1.00 mm/s,测试距离4 mm,探头回升速率1.00 mm/s,感应力5 g。检测的平行实验7 次。
1.3.6 WHC测定
参照Zhou Yanzi等[16]的离心方法。在4 ℃、1 000×g条件下离心10 min。WHC为离心后样品质量占离心前样品质量的百分比。平行实验5 次。
1.3.7 溶胶流变特性测定
参照Verbeken等[17]的方法。选用流变仪的振荡模式,具体参数为:平板直径40 mm,狭缝550 μm,应变2%,频率0.1 Hz。测定分为升温和降温两个过程,升温速率2 ℃/min,温度变化范围20~80 ℃;降温速率4 ℃/min,温度变化范围80~20 ℃。
1.3.8 横向弛豫时间
参照Han Minyi等[18]的低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)方法。将2~4 g凝胶样品放入直径25 mm核磁管中,采用Carr-Purcell-Mebiboom-Gill(CPMG)序列进行测量。测量参数:共振频率21 MHz,回波时间TE0.6 ms,等待时间TW6 000 ms,重复扫描32 次,得到指数衰减图形,使用SIRT算法反演拟合得到T2谱图。平行实验3 次,每个平行试样重复检测2 次。
1.3.9 SEM观察
参照Ma Fei等[15]的方法。将混合体系凝胶切片,用体积分数4%甲醛和2.5%戊二醛混合溶液(1∶1,V/V)固定,0.1 mol/L磷酸盐缓冲液(pH 7.2)漂洗,不同浓度梯度乙醇脱水、丙酮脱水,冷风除去易挥发的有机溶剂,真空冷冻干燥15 h,喷金,观察。
1.4 数据分析
实验数据利用Excel 2007软件计算,结果以表示,用Statistix 8软件和t-检验进行显著性分析,差异显著性水平取P<0.05;采用Origin 8.5绘图。
2 结果与分析
2.1 HPP对MP-MgCl2混合体系凝胶品质特性的影响
2.1.1 HPP对MP-MgCl2凝胶硬度的影响
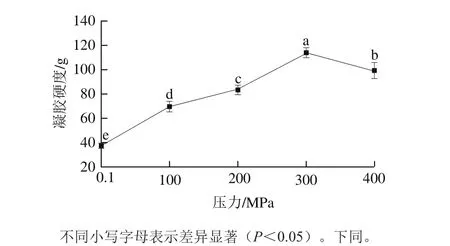
图1 HPP对MP-MgCl2凝胶硬度的影响Fig. 1 Effect of HPP on gel hardness of MP-MgCl2 gels
如图1所示,HPP对MP-MgCl2凝胶硬度的影响呈先升后降的趋势。与未受压组(0.1 MPa)相比,压力从100 MPa升至300 MPa,受压凝胶的硬度依次显著提高(P<0.05);而压力增至400 MPa时,凝胶硬度反而显著下降(P<0.05)。提高MP-MgCl2凝胶硬度的合适压力约为300 MPa。
HPP影响蛋白凝胶硬度的原因有很多。Sikes等[19]研究发现,HPP可以促进蛋白质的伸展,使受压过程的蛋白质暴露出更多的可与盐离子作用的基团,增加含盐聚合物的数量,进而改善低盐混合体系凝胶的硬度。Zheng Haibo等[20]观察到,与单纯加热所形成的粗糙凝胶网络结构相比,HPP能够促进鸡肉糜加热前的凝胶化过程,使得加热后形成的凝胶呈现细致光滑的结构,且凝胶硬度显著提高。还有研究指出,在温和的压力水平下(100~400 MPa),HPP可增强鱼糜蛋白质之间的交联作用,利于凝胶三维网络结构的形成,进而提高凝胶的弹性和强度[21];但较高的压力会加剧蛋白质的变性速率,减小蛋白质分子间的相互作用,导致MP交联度降低而不利于凝胶网络结构的形成,从而形成弱凝胶。这些结果都可能影响受压MP-MgCl2的凝胶硬度。
2.1.2 HPP对MP-MgCl2凝胶WHC的影响
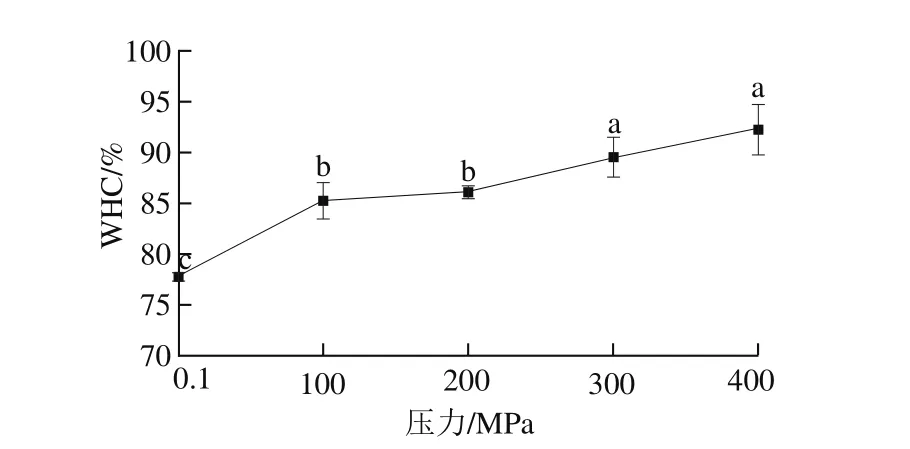
图2 HPP对MP-MgCl2凝胶WHC的影响Fig. 2 Effect of HPP on WHC of MP-MgCl2 gels
从图2可以看出,HPP(100~400 MPa)可显著提高MP-MgCl2凝胶的WHC(P<0.05),而100 MPa与200 MPa之间、300 MPa与400 MPa之间,MP-MgCl2凝胶的WHC没有显著差异(P>0.05)。
Tabilo等[22]指出,适当的压力可以促进蛋白质的解聚,提高蛋白质的溶解性,增强自由水与蛋白质之间的水化作用,进而提高蛋白质凝胶的保水性。HPP通过静电相互作用破坏了二价阳离子与蛋白质分子之间的作用力,并在卸压期间降低了蛋白复合体中盐桥重新形成的概率,从而影响了凝胶的保水性[23]。曹莹莹等[24]研究发现,HPP能改变蛋白质的二级结构,当蛋白质分子折叠或者无规卷曲时,分子有更多的空隙,能够容纳更多的水分。同时,蛋白凝胶的持水性还与凝胶的微观结构、水分分布及流动性等密切相关。Ma Xingsheng等[21]报道,适当的压力水平(100~400 MPa)可以促进鱼糜蛋白的伸展和交联,有利于高保水性网状凝胶结构(致密均匀、多层次化)的形成。本研究中,HPP也可能通过改变MP混合体系凝胶中水分的流动性,进而改善凝胶的保水性。
2.2 HPP对MP-MgCl2溶胶流变特性的影响
储能模量(G’)代表流体中的弹性部分,反映凝胶形成过程中储存的能量及凝胶强度[25]。如图3A所示,未受压的MP-MgCl2体系在45~60 ℃温度范围内出现一个明显的热变性峰。45~50 ℃为“凝胶形成”阶段,G’线性增大,与蛋白凝胶网络结构的初步形成有关;而50~58 ℃为“凝胶减弱”阶段,G’急剧降低,这是由于加热诱导部分氢键断裂,进而促使蛋白凝胶网络结构的形成[26-27]。温度大于60 ℃时为“凝胶增强”阶段,G’持续增加,表明更多的蛋白质通过交联形成良好的三维网络结构[27]。与未加压组相比,HPP后的样品G’在未加热(20 ℃)时都有所增加,表明HPP可促进MP凝胶化,并提高了混合体系的强度;且在20~45 ℃范围内G’呈现出下降趋势,类似的结果也出现在Cando等[11]的报道中。在加热终点(80 ℃),随着压力的增加(100~300 MPa),G’也逐渐增加,但压力为400 MPa时,G’降低,这与图1中MP-MgCl2混合体系凝胶硬度的变化结果一致。100~200 MPa并未改变MP-MgCl2的变性温度峰;而300~400 MPa时,较高的压力促使蛋白质充分展开且伴随着聚集现象,从而导致MP-MgCl2在随后加热过程中G’曲线特征峰的消失。400 MPa导致G’的明显下降,可能是因为HPP抑制了蛋白质在随后加热过程中的变性和聚集,且不利于密实凝胶网络结构的形成,最终引起凝胶强度的下降。由图3B可知,受压MP-MgCl2体系G’的变化趋势与未受压组相同,均随温度的降低而增加,表明在冷却过程中凝胶弹性增加,形成稳定的蛋白凝胶结构。
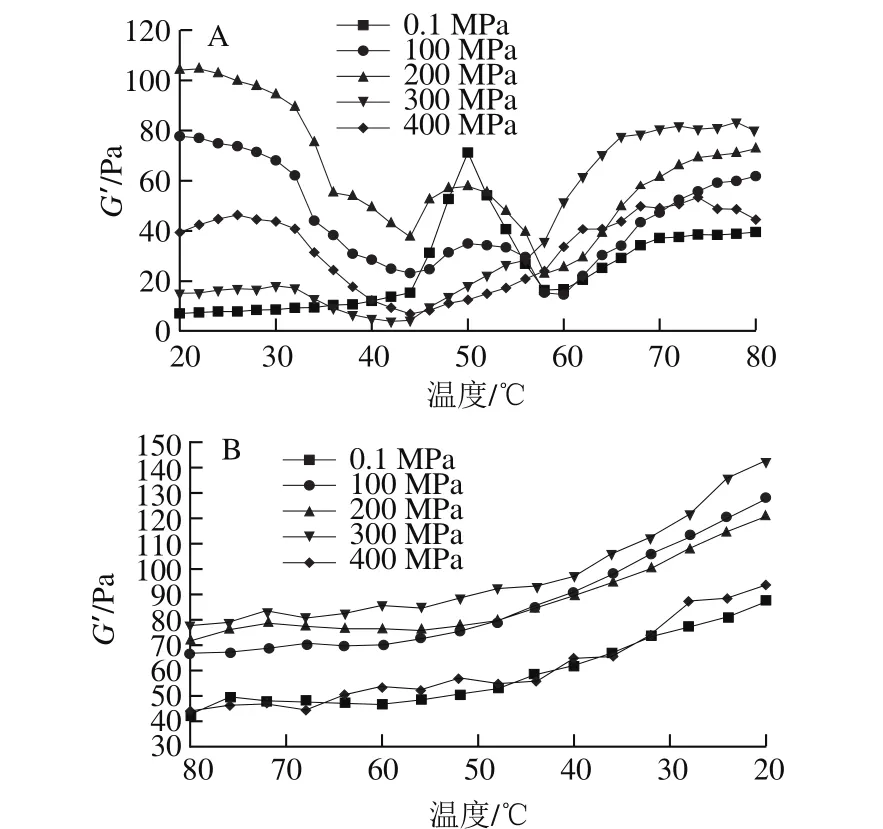
图3 HPP对MP-MgCl2混合体系升温(A)和降温(B)过程中储能模量(G’)的影响Fig. 3 Effect of HPP on storage modulus (G’) of MP-MgCl2 gels during heating (A) and cooling (B)
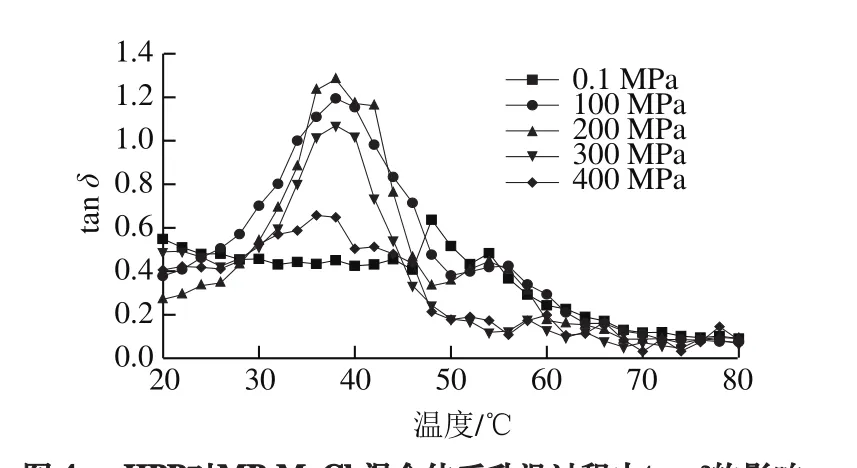
图4 HPP对MP-MgCl2混合体系升温过程中tan δ的影响Fig. 4 Effect of HPP on tan δ of MP-MgCl2 gels during heating
如图4所示,HPP显著改变了升温过程中MP-MgCl2体系的tan δ。在加热初期,与未受压组(0.1 MPa)相比,各水平HPP均能不同程度地降低样品的黏性特征;且受压组的曲线特征基本一致。在38~48 ℃范围内tan δ值急剧下降,表明蛋白体系的弹性增强,这也说明,蛋白质的构象发生了变化以及蛋白之间产生了相互作用[28]。较小的tan δ值表明MP-MgCl2形成了具有弹性的凝胶结构。
2.3 横向弛豫时间的结果与分析
LF-NMR技术是一种快速、无损、非侵入式的检测手段,多用于测定样品中水质子的移动性和水分分布状态[29]。而自旋-自旋弛豫时间(T2)常用来预测肉及肉制品的保水性;T2值越小表明这部分水分的流动性越差,产品的保水性越好。
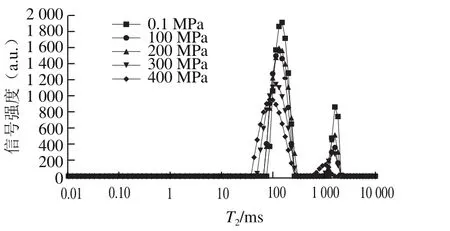
图5 HPP对MP-MgCl2凝胶自旋-自旋弛豫时间(T2)分布的影响Fig. 5 Effect of HPP on T2 relaxation time distribution of MP-MgCl2 gels

表1 HPP对MP-MgCl2凝胶自旋-自旋弛豫时间(T22和T23)的影响Table 1 Effect of HPP on spin-spin relaxation time (T22 and T23) of MP-MgCl2 gels
由图5可见,MP-MgCl2凝胶的T2在0~10 000 ms的弛豫时间分布上出现3 个峰,分别对应于结合水T21(0~20 ms)、不易流动水T22(30~400 ms)和自由水T23(400~3 000 ms)。从不同状态的水对应的峰面积来看,凝胶中不易流动水和自由水相比于结合水含量较高,因此可以选择弛豫时间T22、T23来分析MP-MgCl2凝胶中水分的流动特性。随着压力(100~400 MPa)的升高,T22和T23对应的峰值位置均向低弛豫时间偏移。T22和T23的数据分析(表1)发现,压力升高,T22显著减小(P<0.05);虽然在0.1~200 MPa范围内,T23无显著变化(P>0.05),但压力为300 MPa时,T23也显著降低(P<0.05)。可见,HPP可缩短MP-MgCl2凝胶的横向弛豫时间。
Grossi等[30]发现,较低的压力水平(≤400 MPa)利于提高MP的水合作用,从而影响蛋白质与水之间的相互作用。Zhang Ziye等[31]指出,HPP改变了T2弛豫时间,且随着压力的上升(0.1~500 MPa),更多的自由水附着在蛋白质周围或被束缚在凝胶结构中,转变为结合水或不易流动水。Chen Xing等[32]研究发现,HPP可显著降低T22,减弱了凝胶内部水分的移动性,从而提高了肌球蛋白体系的WHC。HPP同样也可以显著缩短MP-MgCl2凝胶的横向弛豫时间T22和T23,表明凝胶体系中水分子的流动性减弱,从而提高了凝胶WHC(图2)。
2.4 HPP对MP-MgCl2凝胶微观结构的影响

图6 HPP对MP-MgCl2凝胶微观结构影响的SEM图Fig. 6 SEM images showing the effect of HPP on microstructure of MP-MgCl2 gels
如图6A所示,未受压(0.1 MPa)的MP-MgCl2凝胶微观结构,呈现内部孔隙小而多、质地相对均匀的特点;而HPP(100~400 MPa)可以促进蛋白质间的聚集,形成局部更为致密、相互交联的多孔结构(图6B~E),尤其以300 MPa处理组最为明显(图6D)。
蛋白凝胶微观结构的变化与其质构和持水性密切相关。凝胶呈多孔状的微观结构有利于提高其WHC,这一现象也与自旋弛豫时间T2的降低有关[18]。而蛋白质变性和聚集的相对速率决定着蛋白质凝胶微结构的变化[33]。从上述流变特性的结果中发现,HPP(100~300 MPa)可以提高MP-MgCl2的热凝胶能力,利于MP-MgCl2混合溶胶在热凝胶化过程中的变性和聚集,从而形成致密、相互交联的多孔微结构,最终导致体系凝胶硬度的增强和WHC的提高(图1~2)。
3 结 论
HPP(100~400 MPa)能够通过改变MP-MgCl2混合体系的储能模量(G’),缩短凝胶内部水分的自旋-自旋弛豫时间T22和T23,促进交联、密实凝胶多孔网络结构的形成,进而显著提高MP-MgCl2混合体系的凝胶硬度和WHC(P<0.05),且300 MPa是改善其凝胶硬度的合适压力。研究结果可为肉制品的低盐化加工提供理论支持。
[1] 夏秀芳, 孔保华, 张宏伟. 肌原纤维蛋白凝胶形成机理及影响因素的研究进展[J]. 食品科学, 2009, 30(9): 264-268. DOI:10.7506/spkx1002-6630-200909062.
[2] COLMENERO F J. Muscle protein gelation by combined use of high pressure/temperature[J]. Trends in Food Science & Technology, 2002,13(1): 22-30. DOI:10.1016/S0924-2244(02)00024-9.
[3] World Health Organization. Diet, nutrition and the prevention of chronic diseases: report of a Joint WHO/FAO Expert Consultation[R].Geneva: WHO, 2003.
[4] 谢婷婷, 姚静, 李月双, 等. MgCl2对低钠盐κ-卡拉胶-肌球蛋白凝胶特性的影响[J]. 食品科学, 2017, 38(1): 35-40. DOI:10.7506/spkx1002-6630-201701006.
[5] TAMM A, BOLUMAR T, BAJOVIC B, et al. Salt (NaCl) reduction in cooked ham by a combined approach of high pressure treatment and the salt replacer KCl[J]. Innovative Food Science and Emerging Technologies, 2016, 36: 294-302. DOI:10.1016/j.ifset.2016.07.010.
[6] XIONG Youling L., BREKKE C J. Gelation properties of chicken myofibrils treated with calcium and magnesium chlorides[J]. Journal of Muscle Foods,1991, 2(1): 21-36. DOI:10.1111/j.1745-4573.1991.tb00438.x.
[7] 魏朝贵, 吴菊清, 邵俊花, 等. KCl和MgCl2部分替代NaCl对猪肉肌原纤维蛋白乳化凝胶特性的影响[J]. 食品科学, 2014, 35(5): 89-95.DOI:10.7506/spkx1002-6630-201405018.
[8] FONBERGBROCZEK M, WINDYGA B, SZCZAWIŃSKI J, et al.High pressure processing for food safety[J]. Acta Biochimica Polonica,2005, 52(3): 721-724.
[9] SUN X D, HOLLEY R A. Factors influencing gel formation by myofibrillar proteins in muscle foods[J]. Comprehensive Reviews in Food Science and Food Safety, 2011, 10(1): 33-51. DOI:10.1111/j.1541-4337.2010.00137.x.
[10] IKEUCHI Y, TANJI H, KIM K, et al. Mechanism of heat-induced gelation of pressurized actomyosin: pressure-induced changes in actin and myosin in actomyosin[J]. Journal of Agricultural and Food Chemistry, 1992, 40(10): 1756-1761. DOI:10.1021/jf00022a006.
[11] CANDO D, HERRANZ B, BORDERÍAS A J, et al. Effect of high pressure on reduced sodium chloride surimi gels[J].Food Hydrocolloids, 2015, 51: 176-187. DOI:10.1016/j.foodhyd.2015.05.016.
[12] VILLAMONTE G, SIMONIN H, DURANTON F, et al. Functionality of pork meat proteins: impact of sodium chloride and phosphates under high-pressure processing[J]. Innovative Food Science and Emerging Technologies, 2013, 18(2): 15-23. DOI:10.1016/j.ifset.2012.12.001.
[13] PARK D, XIONG Y L. Oxidative modification of amino acids in porcine myofibrillar protein isolates exposed to three oxidizing systems[J]. Food Chemistry, 2007, 103(2): 607-616. DOI:10.1016/j.foodchem.2006.09.004.
[14] WESTPHALEN A, BRIGGS J, LONERGAN S. Influence of pH on rheological properties of porcine myofibrillar protein during heat induced gelation[J]. Meat Science, 2005, 70(2): 293-299.DOI:10.1016/j.meatsci.2005.01.015.
[15] MA Fei, CHEN Conggui, SUN Gaojun, et al. Effects of high pressure and CaCl2on properties of salt-soluble meat protein gels containing locust bean gum[J]. Innovative Food Science and Emerging Technologies, 2012, 14(2): 31-37. DOI:10.1016/j.ifset.2011.12.001.
[16] ZHOU Yanzi, CHEN Conggui, CHEN Xing, et al. Contribution of three ionic types of polysaccharides to the thermal gelling properties of chicken breast myosin[J]. Journal of Agricultural and Food Chemistry,2014, 62(12): 2655-2662. DOI:10.1021/jf405381z.
[17] VERBEKEN D, NEIRINCK N, VAN DER MEEREN P, et al.Influence of κ-carrageenan on the thermal gelation of salt-soluble meat proteins[J]. Meat Science, 2005, 70(1): 161-166. DOI:10.1016/j.meatsci.2004.12.007.
[18] HAN Minyi, ZHANG Yingjun, FEI Ying, et al. Effect of microbial transglutaminase on NMR relaxometry and microstructure of pork myofibrillar protein gel[J]. European Food Research and Technology,2009, 228(4): 665-670. DOI:10.1007/s00217-008-0976-x.
[19] SIKES A L, TOBIN A B, TUME R K. Use of high pressure to reduce cook loss and improve texture of low-salt beef sausage batters[J].Innovative Food Science and Emerging Technologies, 2009, 10(4):405-412. DOI:10.1016/j.ifset.2009.02.007.
[20] ZHENG Haibo, XIONG Guoyuan, HAN Minyi, et al. High pressure/thermal combinations on texture and water holding capacity of chicken batters[J]. Innovative Food Science and Emerging Technologies, 2015,30: 8-14. DOI:10.1016/j.ifset.2015.06.002.
[21] MA Xingsheng, YI Shumin, YU Yongming, et al. Changes in gel properties and water properties of Nemipterus virgatus surimi gel induced by high-pressure processing[J]. LWT-Food Science and Technology, 2015, 61(2): 377-384. DOI:10.1016/j.lwt.2014.12.041.
[22] TABILO M G, BARBOSA C G V. Pressurized and heat-treated surimi gels as affected by potato starch and egg white: microstructure and water-holding capacity[J]. LWT - Food Science and Technology, 2005,38(1): 47-57. DOI:10.1016/j.lwt.2004.04.013.
[23] MA Fei, CHEN Conggui, ZHENG Lei, et al. Eあect of high pressure processing on the gel properties of salt-soluble meat protein containing CaCl2and κ-carrageenan[J]. Meat Science, 2013, 95(1): 22-26.DOI:10.1016/j.meatsci.2013.04.025.
[24] 曹莹莹, 张亮, 王鹏, 等. 超高压结合热处理对肌球蛋白凝胶特性及蛋白二级结构的影响[J]. 肉类研究, 2013, 27(1): 1-7.
[25] CAO Yingying, XIA Tianlan, ZHOU Guanghong, et al. The mechanism of high pressure-induced gels of rabbit myosin[J].Innovative Food Science and Emerging Technologies, 2012, 16(39):41-46. DOI:10.1016/j.ifset.2012.04.005.
[26] LIU R, ZHAO S M, XIONG S B, et al. Studies on fish and pork paste gelation by dynamic rheology and circular dichroism[J]. Journal of Food Science, 2007, 72(7): E399-E403. DOI:10.1111/j.1750-3841.2007.00470.x.
[27] QIU Chunjiang, XIA Wenshui, JIANG Qixing, et al. Effect of high hydrostatic pressure (HHP) on myofibril-bound serine proteinases and myofibrillar protein in silver carp (Hypophthalmichthys molitrix)[J].Food Research International, 2013, 52(1): 199-205. DOI:10.1016/j.foodres.2013.03.014.
[28] SANO T, NOGUCHI S F, TSUCHIYA T, et al. Dynamic viscoelastic behavior of natural actomyosin and myosin during thermal gelation[J].Journal of Food Science, 1988, 53(3): 924-928. DOI:10.1111/j.1365-2621.1988.tb08987.x.
[29] BERTRAM H C, ERSEN H J. Applications of NMR in meat science[J]. Annual Reports on NMR Spectroscopy, 2004, 53: 157-202.DOI:10.1016/S0066-4103(04)53003-X.
[30] GROSSI A, OLSEN K, BOLUMAR T, et al. The effect of high pressure on the functional properties of pork myofibrillar proteins[J]. Food Chemistry, 2016, 196: 1005-1015. DOI:10.1016/j.foodchem.2015.10.062.
[31] ZHANG Ziye, YANG Yuling, TANG Xiaozhi, et al. Chemical forces and water holding capacity study of heat-induced myofibrillar protein gel as aあected by high pressure[J]. Food Chemistry, 2015, 188: 111-118. DOI:10.1016/j.foodchem.2015.04.129.
[32] CHEN Xing, CHEN Conggui, ZHOU Yanzi, et al. Effects of high pressure processing on the thermal gelling properties of chicken breast myosin containing κ-carrageenan[J]. Food Hydrocolloids, 2014, 40:262-272. DOI:10.1016/j.foodhyd.2014.03.018.
[33] LIU R, ZHAO S M, XIONG S B, et al. Role of secondary structures in the gelation of porcine myosin at diあerent pH values[J]. Meat Science,2008, 80(3): 632-639. DOI:10.1016/j.meatsci.2008.02.014.

