水产品中甲基睾酮残留物检测方法对比研究
黄鸾玉,韦信贤,童桂香,杨姝丽,吴祥庆,蒙源,吴明媛
(广西水产科学研究院,广西 南宁530021)
甲基睾酮(methyltestosterone,MET)是一种人工合成的类固醇类雄性激素,又称甲基睾丸素和甲睾酮。由于MET药效显著且稳定,容易获得,在渔业生产中已有50年使用史,育苗期间的使用尤为普遍。MET具有增强雄性体征和蛋白质同化的双重作用,能提高饲料转化率并促进动物生长[1],育苗期间常通过药饵投喂、浸浴幼鱼等给药方式来促进苗种性别转变,提高个体增长速率,最终大幅度提高水产养殖经济效益。MET在动物体内代谢缓慢,蓄积性强,通过食物链进入人体会产生严重的副作用,比如扰乱激素平衡、影响生育能力,致胎体中毒、致肝中毒和致癌等[2-4],导致国人对水产品质量安全的信心下降,出口贸易频遭绿色壁垒。因此,检测水产品中MET残留量尤为迫切。
目前水产品中MET的检测方法有高效液相色谱法[5-8]、高效液相色谱-串联质谱法[9-10]、气相色谱-质谱法[11]、酶联免疫法[12]、化学发光法[13]、毛细管电泳法[14]等。酶联免疫法的缺点是易出现假阳性,只能用作初步筛查。液相色谱-质谱法仪器昂贵,不利于在各级检测机构全面开展检测工作。气相色谱-质谱法需要对分析物进行衍生化,结果不稳定。相对而言,高效液相色谱法更能满足日常检测需求。中国水产行业标准正是采用液液萃取-高效液相色谱法测定水产品MET残留物[8]。在日常检测工作中,发现该方法净化效果不好,仪器分析时间长,加标回收率偏低,不适合批量检测,很有必要进行优化。本研究以中国水产行业标准SC/T3029-2006《水产品中甲基睾酮残留量的测定》为基础,对液相色谱法测定水产品中MET含量的两种前处理方法及色谱条件的线性、精密度、回收率、稳定性、适用性等方面进行对比试验,目的是寻找最合适检测水产品中MET残留量的方法。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器
超高压液相色谱仪(ACQUITY UPLC):美国Waters公司;高效液相色谱仪(Agilent1200)、固相萃取装置:德国 Agilent公司;平行蒸发仪(Syncore Polyvap):瑞士buchi公司;循环水冷却器(H35):莱伯泰科有限公司;多管架自动平衡离心(TDZ5-WS):湖南湘仪实验室仪器开发有限公司;往复式振荡器(ZWF-334):上海智城分析仪器制造有限公司;离心机(TD6M):长沙平凡仪器仪表有限公司;固相萃取柱(poly-sery HLB,60 mg,3 mL):上海安谱实验科技股份有限公司。
1.1.2 试剂
MET标准物质(纯度98%):德国Dr.Ehrenstorfer公司;甲醇、乙腈(色谱纯):美国Tedia公司;无水乙醚(分析纯):西陇化工有限公司;石油醚(色谱纯):国药集团化学有限公司;甲酸、异丙醇(色谱纯):天津市光复精细化工研究所;酸化乙腈:乙腈-甲酸(199/1,体积比)。
检测样品按照《水产品抽样方法》[15]的规定处理。
1.2 MET检测方法
1.2.1 标准溶液配制
准确称取MET标准物质10.2 mg,用甲醇溶解并定容至100 mL,配成100 μg/mL的标准溶液,-18℃存放。使用前用甲醇稀释成5 μg/mL工作液,再分别移取适量工作液,用80%甲醇水溶液配成浓度分别为0.025、0.050、0.100、0.250、0.500、1.000、2.500 μg/mL 的标准工作曲线。
1.2.2 样品制备
将供试样品置于常温条件自然解冻,取适量样品制成细小、均匀的鱼糜样。
1.2.3 样品提取与净化
方法1:参照中国水产行业标准SC/T3029-2006《水产品中甲基睾酮残留量的测定》,稍有改进。具体方法:称取(5.00±0.05)g样品置于 50 mL离心管中,加入15 mL无水乙醚,振荡提取10 min,4 000 r/min离心5 min,将上清液转移至平行蒸发管中,再向离心管中加入10 mL无水乙醚,重复提取1次,上清液合并至蒸发管中,经40℃平行蒸发至干。用3 mL 80%的甲醇水溶液溶解残渣,加入3 mL石油醚,旋涡混匀去脂,转入10 mL离心管中,6 000 r/min离心10 min。弃去石油醚层,取下层溶液过0.22 μm微孔滤膜,供高效液相色谱仪测定。
方法 2:称取(5.00±0.05)g样品置于 50 mL离心管中,加入15mL酸化乙腈,匀浆30s,振荡提取10min,4 000 r/min离心5 min,将上清液转移至平行蒸发管中,再向离心管中加入8 mL酸化乙腈,重复提取1次,上清液合并至蒸发管中。向蒸发管中加入10 mL异丙醇,经55℃平行蒸发至干。用3 mL甲醇溶解残渣,加入7 mL纯净水,混匀,转入15 mL离心管中,放置冰箱冷冻30 min,6 000 r/min离心10 min。取甲醇溶液层通过预先用3 mL甲醇、3 mL水活化的HLB柱上样,以小于2 mL/min的流速过柱,弃去滤液,用6 mL水淋洗,待淋洗液全部流出后抽HLB柱近干,弃去流出液,用4 mL 80%的甲醇水溶液洗脱,收集洗脱液,定容至4 mL,混匀,过0.22 μm微孔滤膜,供超高压液相色谱仪测定。
1.2.4 色谱条件
1.2.4.1 高效液相色谱法
色谱柱:Luna 5u C18 柱(250 mm×4.6 mm,5 μm);流动相:甲醇-水(78/22,体积比);流速:1 mL/min;柱温:30 ℃;进样量:20 μL;检测波长:254 nm。
1.2.4.2 超高压液相色谱法
色谱柱:BEH C18 柱(50 mm×2.1 mm,1.7 μm);流动相:甲醇-水(70/30,体积比);流速:0.2 mL/min;柱温:30 ℃;进样量:5 μL;检测波长:254 nm。
1.2.5 计算公式
以保留时间定性,峰面积定量,根据下式计算水产品MET的残留量。

式中:C 为样品中 MET 的含量,(μg/kg);c为由标准曲线查得提取液中MET的含量,(μg/mL);v为提取液定容体积,mL;n为稀释倍数;m为称样量,kg。
2 结果与讨论
2.1 数据的采集
2.1.1 高效液相色谱法
在高效液相色谱法的仪器条件下,用进样器进20 μL浓度为1 μg/mL的标准溶液,再分别进20 μL经过方法1前处理后的空白样品和加标浓度为100 μg/kg的加标样品,根据其出峰时间定性,考察MET信号响应强度、溶剂杂质响应强度和样品分离效果。结果见图1。
由图1可知,MET出峰时间为7.1 min~7.5 min。用无水乙醚作为提取剂,溶剂峰明显高于目标峰。样品图谱复杂,目标峰附近杂峰多,容易干扰目标峰定性与定量分析。有研究表明,用石油醚、正己烷除脂时,两种试剂均会对目标峰组分造成一定干扰[16]。因此,需要对方法1的提取剂及除脂方式进行优化。
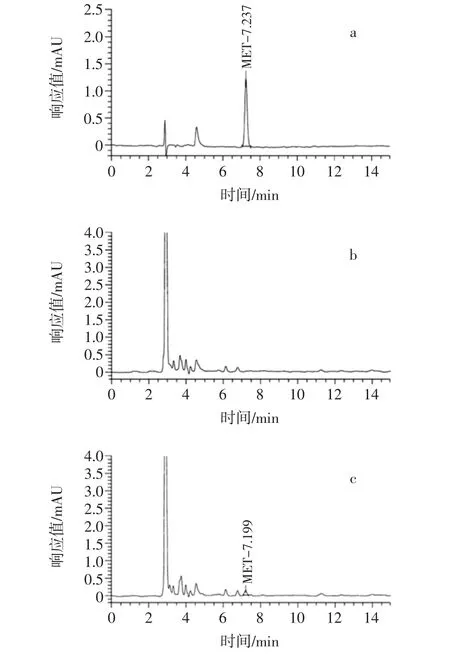
图1 高效液相色谱法图谱Fig.1 Chromatograms of high performance liquid chromatography
2.1.2 超高压液相色谱法
MET结构式中有极性的羟基、羧基和非极性的碳环[17],易溶于乙腈,同时因为存在羟基,采用酸性条件更利于提取,因此,方法2选择酸化乙腈来沉淀部分样品蛋白质,提取MET。在超高压液相色谱法的仪器条件下,用进样器分别进5 μL浓度为0.1 μg/mL的MET标准溶液、经方法2前处理的空白样品和100 μg/kg加标样品提取液,色谱图见图2。
图2显示,MET出峰时间为3.8 min~4.2 min。用酸化乙腈作为提取剂,溶剂峰明显降低。样品经冷冻离心脱脂,再经HLB柱净化,目标峰附近没有杂峰,定性和定量分析均不受杂峰干扰。
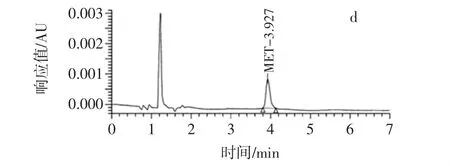
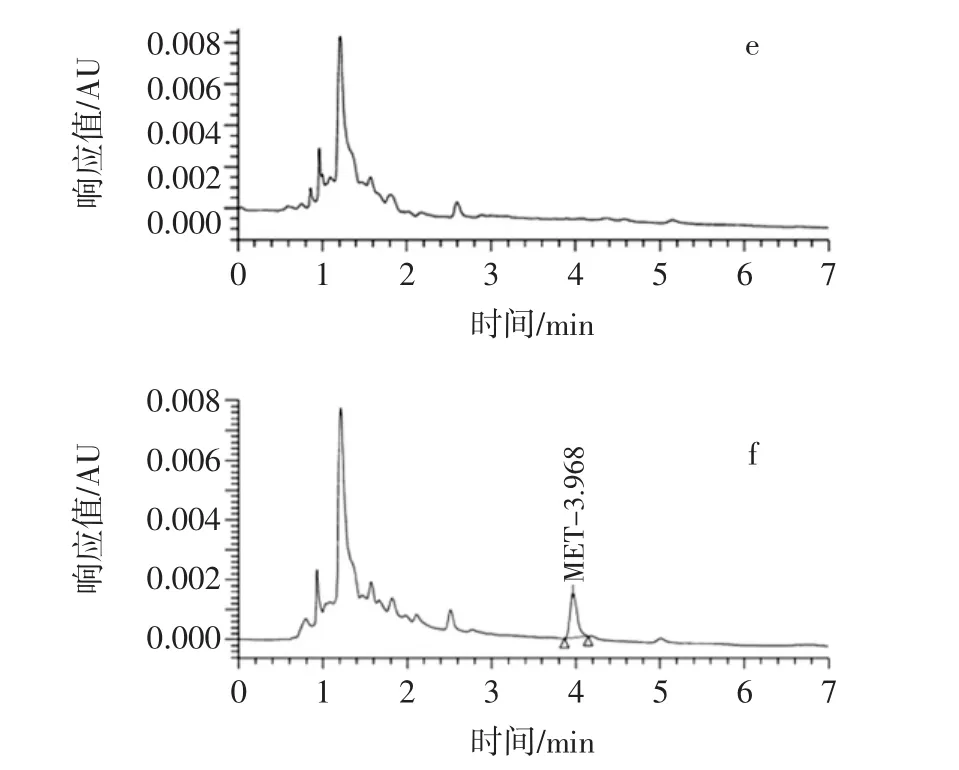
图2 超高压液相色谱法图谱Fig.2 Chromatograms of ultra-high pressure liquid chromatography
2.2 线性关系
将1.2.1所配的标准溶液分别用1.2.4的两种色谱条件进行检测,以峰面积对浓度做标准曲线,进行线性回归分析。高效液相色谱法的标准曲线为Y=11.5723X-0.132 3,r=0.999 1,在 0.050 μg/mL~1.000 μg/mL 范围内线性关系良好;超高压液相色谱法的标准曲线为Y=70163.9X-117.2,r=0.9996,在 0.025 μg/mL~2.500 μg/mL范围内线性关系良好。相关系数表明,超高压液相色谱法有相对较宽的线性范围。
2.3 检出限
本试验以3倍信噪比(S/N)对应的浓度计算方法检出限,得到方法1的检出限为10 μg/kg,方法2的检出限为5 μg/kg。方法2降低了溶剂峰和基质干扰,检出限明显降低。
2.4 精密度试验
取同一浓度的MET标准品,分别用两种色谱条件平行测定5次,分别计算MET含量,考察精密度,结果列于表1。

表1 精密度试验结果(n=5)Table 1 The precision experimental results(n=5)
两种检测方法的RSD均小于10%,均能满足检测需求。
2.5 加标回收率试验
为考察两种方法的准确度,以未检出MET的罗非鱼肌肉作为空白样品,设计10、50、100 μg/kg的加标浓度,测定MET的回收率,每种方法每个加标浓度平行测定5次,结果见表2。

表2 不同方法MET回收率(n=5)Table 2 Rate of recovery in different methods(n=5)
由表2可知,方法1的回收率在70.0%~80.4%之间,测定值的相对标准偏差在4.2%~9.1%之间;方法2的回收率在81.2%~91.1%之间,测定值的相对标准偏差在2.3%~5.5%之间。在相同加标浓度下,方法2的平均回收率和精密度高于方法1。方法2的3个加标浓度的平均回收率均大于80%;方法1在其10倍检出限浓度水平(100 μg/kg)下,才获得80.4%的平均回收率,回收率偏低。
2.6 样品检测对比
取50个不同的水产品样品,按照1.2.3的处理过程,同时采取两种方法检测,方法2前处理因要使用HLB柱净化,需要0.7 h,冷冻脱脂需要0.5 h,比方法1前处理的时间长。方法2检测出峰时间为4 min左右,仪器测试一个样品需要7 min,而方法1仪器测试一个样品需要15 min。仪器测试50个样品方法2比方法1节约了约6.7 h。从整体检测时间来分析,方法2更快捷。从检测准确性来比较,方法2结果更稳定准确。
3 结论
通过对比研究,两种方法线性相关系数均大于0.999 0,线性关系均良好,方法2检测信号干扰较少,检出限达到5 μg/kg,比方法1低1倍。方法2的回收率和精密度比方法1高,结果相对准确。方法2仪器分析流速为0.2 mL/min,比方法1节约流动相0.8 mL/min;方法2仪器分析时间较短,每进一个样可以节约8 min。大批量进样的时候,方法2可以节约数量可观的流动相和分析时间,实用性强,更适合快速测定水产品中MET残留物的含量。
参考文献:
[1]彭家杰,李绪鹏,胡浩光,等.高效液相色谱法测定水产品中甲基睾酮残留量前处理方法的改进[J].中国渔业质量与标准,2014,4(2):56-60
[2]VICK A M,HAYTON W L.Methyltestosterone pharmacolinetics and oral bioavailability in rainbow trout(Oncorhynchus mykiss)[J].Aquatic Toxicology,2011,52(3/4):177-188
[3]李佩佩,郭远明,陈雪昌,等.凝胶渗透色谱-固相萃取/高效液相色谱法同时测定水产品中甲基睾酮与己烯雌酚[J].分析测试学报,2013,32(2):267-270
[4]李俊锁,邱月明,王超.兽药残留分析[M].上海:上海科学技术出版社,2002:256-299
[5]陈培基,李刘冬,邹琴,等.高效液相色谱法测定水产品中甲基睾丸酮残留量的优化研究[J].食品科学,2010,31(6):223-226
[6]MARWAH A,MARWAH P,LARDY H.Development and validation of a high performance liquid chroma tograph assay for 17α-methyltestosterone in fish feed[J].J Chromatogr B,2005,824(1):107-115
[7]JIANG Jie,LIN Hong,FU Xiaoting,et al.Preliminary validation of high performance liquid chroma tography method for detection of methyltestosterone residue in carp muscle[J].Journal of OceanUniversity of China,2005,4(3):248-251
[8]全国水产标准化技术委员会.水产品中甲基睾酮残留量的测定:液相色谱法:SC/T 3029-2006[S].青岛:中国海洋大学,2006:2-3
[9]聂建荣,朱孟丽,朱铭立,等.HPLC-MS/MS快速检测水产品中甲基睾丸酮的研究[J].广东农业科学,2008(6):107-109
[10]CHU P S,LOPEZ M,SERFLING S,et al.Determination of 17αmethyltestosterone in muscle tissues of tilapia,rainbow trout,and salmon using liquid chromatography-tandem mass spectrometry[J].Agric Food Chem,2006,54(9):3193-3198
[11]Samuels T P,Nedderman A,Seymour M A,et al.Study of the metabolism of testosterone,nandrolone and estradiol in cattle[J].Analyst,1998,123(12):2401-2914
[12]LU H H,CONNEELY G,CROWE M A,et a1.Screening for testosterone,methyltestosterone,19-nortestoterone residues and their metabolites in bovinewith enzyme-linked immunosorbent assay(ELISA)[J].Anal Chim Acta,2006,570(1):116-123
[13]曾丹云,吉邢虎,何治柯.甲基睾酮-KMnO4-Ru(bipy)32+-Ce(Ⅳ)化学发光检测甲基睾酮的研究[J].分析科学学报,2005,21(5):504-506
[14]黄晓东,林子俺,谢增鸿.甲基睾酮的毛细管电泳法测定[J].闽江学院学报(自然科学版),2006,27(2):91-94
[15]中华人民共和国农业部.水产品抽样方法:SC/T 3016-2004[S].青岛:国家水产品质量监督检验中心,2004:6-7
[16]罗玲,刘伶俐,洪波,等.HLB柱净化-高效液相色谱法分析水产品中甲基睾酮残留物[J].分析试验室,2014,33(7):844-846
[17]李佩佩,梅光明,张小军,等.固相萃取-高效液相色谱法测定水产品中的甲基睾酮残留量[J].食品科学,2012,33(22):282-285

