远红外辐照对大米黄曲霉孢子及其产毒能力的影响
蒋 婧张玉明全俊成范柳萍
(1. 江南大学食品学院,江苏 无锡 214122;2. 上海热丽科技集团有限公司,上海 200125)
稻谷作为中国最重要的粮食作物之一,极易被微生物和真菌毒素污染,其中黄曲霉和黄曲霉毒素污染最为严重。真菌毒素中AFB1毒性最大,被联合国粮农组织和世界卫生组织认定为Ⅰ类致癌物质。目前粮食的杀菌方法有紫外辐照[1-2]、脉冲强光[3]、远红外[4]等物理法;化学法中二氧化氯[5]及臭氧[6]主要应用在糙米的杀菌中;生物防治包括抑制菌株生长[7-8]、抑制菌株产毒和降解黄曲霉毒素等[9]。红外辐照依靠其热效应及特征吸收导致菌体蛋白质变性和酶失活,微生物代谢受到严重的干扰从而影响增殖[10],此外红外加热具有加热效率高、无残留、加热惯性小易控制、设备投资小等优点[11],在食品安全与加工等方面具有广泛的应用前景。
目前,远红外辐照技术在食品领域的应用主要侧重于以加热脱水为目的的烘焙、干燥等方面,在杀菌方面的报道较少。Tubasa等[12]研究了远红外辐照与热传导联合作用对柑橘白色念珠菌和黑曲霉孢子的杀菌效果;Hamanaka[13]、Athanassiou[14]、Erdogdu[15]等研究了远红外对霉菌的致死作用;Wang等[16]采用远红外结合60 ℃保温120 min处理对黄曲霉菌具有良好的杀菌效果,但其保温时间长,且研究对象为黄曲霉菌,未涉及对黄曲霉孢子和产毒能力的影响。
本试验以接种黄曲霉孢子的大米为原料,采用远红外辐照杀菌技术,研究红外辐照对黄曲霉的杀菌效果、生长曲线和产AFB1能力的影响,并考察红外辐照对大米色泽、游离氨基酸、可溶性蛋白等理化指标的影响,旨在为远红外杀菌工艺的广泛应用提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
黄曲霉菌(AspergillusflavusCGMCC 3.4408):中国微生物菌种保藏管理中心;
粳米:二级,含水率14.31%,上海祥森米业有限公司;
孟加拉红培养基:生化试剂,国药集团化学试剂有限公司;
乙腈:色谱纯,国药集团化学试剂有限公司;
其他试剂:分析纯,国药集团化学试剂有限公司;
AFB1标准品:纯度≥99%,以色列Fementek公司。
1.1.2 主要仪器设备
高效液相色谱仪:Agilent 1100型,德国安捷伦公司;
高效液相色谱仪(配有荧光检测器):Waters e2695型,美国Waters公司;
远红外层式烘箱:额定电压220 V,额定功率1 200 W,利用远红外光波片作为热源,烘箱内有4块光波片,每块光波片可单独控温,上海热丽科技集团有限公司;
高精度分光测色仪:UltraScan Pro1166型,美国Hunterlab公司;
紫外分光光度计:UV-2600型,日本岛津公司。
1.2 方法
1.2.1 样品制备 将已接种黄曲霉菌孢子的PDA培养基斜面试管置于28 ℃、湿度70%的恒温恒湿箱中培养7 d,用无菌生理盐水冲洗斜面并收集孢子,过滤菌丝得到孢子悬液,调整孢子悬液浓度为106CFU/mL。
称取适量大米,加入一定体积的孢子菌悬液,分别配制成初始含水率为(30.05±0.33)%和(20.11±0.16)%的样品,充分摇晃混匀,4 ℃放置24 h,使水分平衡。
1.2.2 红外和热风处理 参考相关研究[16-17]和预试验结果确定红外和热风处理条件:
(1) 大米含水率(30.05±0.33)%,载样量40 g,单层铺设,红外温度70 ℃分别处理20,40,60 min;红外90 ℃处理40 min;红外100 ℃分别处理10,20,30 min;红外110 ℃处理10 min,红外115 ℃分别处理5,10 min,测定大米含水率和黄曲霉菌落数。
(2) 大米含水率(30.05±0.33)%,载样量40 g,单层铺设,105 ℃热风干燥5 min,测定大米黄曲霉菌落数。
(3) 大米含水率(20.11±0.16)%,载样量40 g,单层铺设,红外温度115 ℃,保温5 min,降低辐照温度至70 ℃,分别保温0,5,15,30 min。测定大米含水率、黄曲霉菌落数、Lab值、游离氨基酸和可溶性蛋白。
1.2.3 微生物测定 按GB 4789.15—2016的平板计数法执行。
1.2.4 杀菌效率计算 采用微生物残活率对数值来表示,按式(1)计算:
(1)
式中:
N——杀菌处理后大米中孢子存活量,CFU/mL;
N0——杀菌处理前大米中孢子总数,CFU/mL;
lgS——杀菌处理前后孢子总数降低的对数即微生物残存率。
1.2.5 生长曲线测定 将含水率为30%的大米经115 ℃红外辐照5 min,对照组未经红外辐照处理,分别称取25 g于无菌均质袋中,加入225 mL无菌生理盐水,拍打式均质器拍打频率5次/s,均质2 min,收集均质液,根据文献[16]测定生长曲线。
1.2.6 产毒培养及AFB1提取 收集红外辐照处理后的大米样品,混合均匀,将大米表面的黄曲霉孢子洗脱于均质液中,吸取5 mL均质液于150 mL产毒培养基(参照NY/T 2311—2013)中。28 ℃、160 r/min条件下培养6 d。处理组:含水率为30%和20%的大米经115 ℃红外辐照5 min;对照组:含水率为30%的大米未经红外辐照处理。产毒培养结束后,参照GB 5009.22—2016测定AFB1。
1.2.7 大米水分测定 按GB 5009.3—2016直接干燥法执行。
1.2.8 Lab值的测定 以未处理的大米作为对照,利用高精度分光测色仪测量不同红外条件处理后的大米的L、a、b值,按式(2)计算△E[18]。
(2)
式中:
△E——色差;
L——亮度;
a——红绿偏向;
b——黄蓝偏向。
1.2.9 可溶性蛋白的测定 采用考马斯亮蓝法[19],牛血清蛋白标准曲线为y=0.947x+0.050 6,R2=0.999。
1.2.10 游离氨基酸测定 称取1.000 g样品,5%三氯乙酸定容至10 mL,振荡1 min,超声20 min,静置2 h,定性滤纸过滤,采用邻苯二甲醛一氯甲酸芴甲酯(OPA-FMOC) 柱前衍生法[20]测定游离氨基酸含量。
1.3 数据处理与统计分析
各试验至少重复3次,采用SPSS 19.0和 Origin 9.0对数据进行统计分析和制图。
2 结果与分析
2.1 红外辐照对黄曲霉的影响
2.1.1 红外辐照和热风干燥对大米黄曲霉孢子杀灭效果的影响 由表1可知,大米含水率为30%,辐照温度为70 ℃,处理20 min和60 min时,杀菌效果没有显著增加。辐照温度高于90 ℃时,红外辐照杀灭效果随着设定温度的升高和处理时间的延长而增强。当辐照温度为115 ℃处理5 min和10 min时, lgS分别为2.96±0.28,3.85±0.15。高温短时(115 ℃)处理灭杀效果优于低温长时(70 ℃)处理,与任梦影等[21]采用热处理大米粉中的霉菌研究结果一致。由表1、2可知,辐照温度相同时,含水率越高,孢子更容易失活死亡,这是因为高水分下,孢子对温度更敏感。红外115 ℃处理10 min 时,样品表面温度较高,大米出现明显裂纹,感官品质及营养品质降低,因此高温处理时间不宜过长。
经测定,样品经105 ℃热风干燥5 min后,其表面温度为(59.0±3.0) ℃,与经115 ℃远红外辐照5 min后的表面温度一致,在此条件下红外辐照lgS为2.96±0.28,热风处理lgS为1.41±0.21。红外杀菌效果显著优于热风杀菌。这可能是加热和DNA损伤重叠效应导致了微生物的失活[22],也可能是远红外的特征吸收效应所致。
由表2可知,采用红外115 ℃辐照5 min后结合70 ℃保温,杀菌效果随着保温时间的延长而增强,且显著高于直接采用70 ℃辐照的杀菌效果。Wang等[16]采用催化式红外加热对初始水分高于21.1%的稻谷辐射至60 ℃后保温120 min,黄曲霉菌数降低8.3 lgS。研究[23]表明采用红外辐照结合保温处理,能增强杀菌效果。红外高温短时处理对黄曲霉孢子造成一定程度的损伤,结合保温处理能有效杀灭受损孢子。
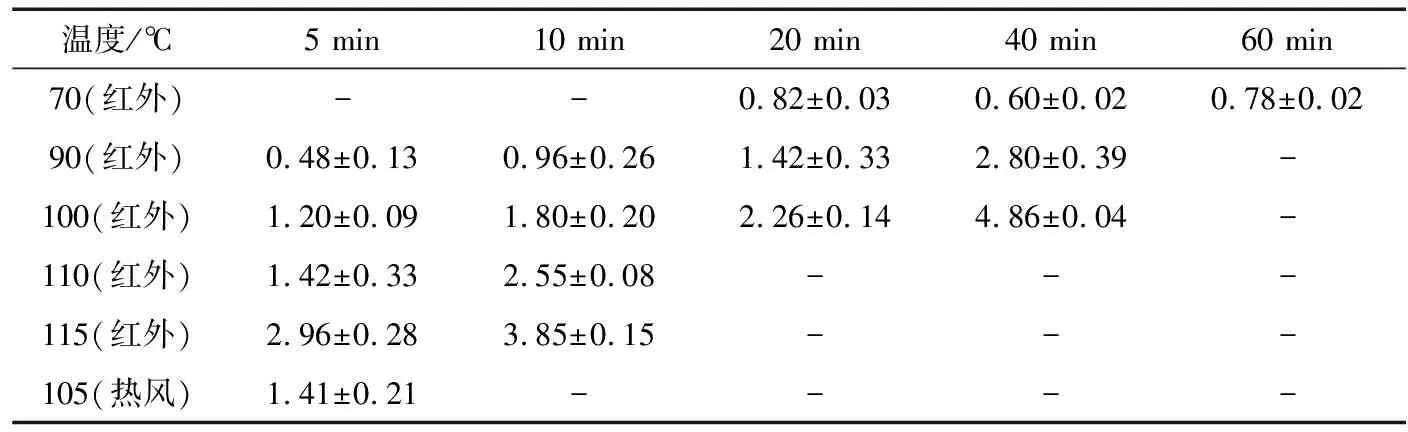
表1 红外辐照与热风对初始含水率30%大米杀菌效果的影响(lgS)†
† “-”表示未检测。
表2红外辐照结合保温对含水率20%大米杀菌效果的影响(lgS)
Table 2 Disinfection effect of FIR irradiation and heating on rice with moisture content of 20% (n=3)
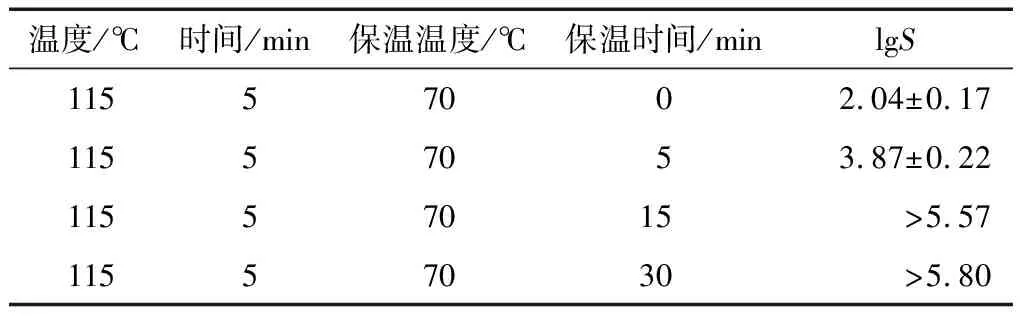
温度/℃时间/min保温温度/℃保温时间/minlgS11557002.04±0.1711557053.87±0.2211557015>5.5711557030>5.80
2.1.2 红外辐照对黄曲霉生长曲线的影响 图1表示未红外处理的黄曲霉孢子和红外处理后黄曲霉孢子在液体培养基中生长量的变化。由图1可知,FIR处理后,黄曲霉菌迟滞期延长,对照组和处理组分别培养12 h和60 h后进入对数生长期,对数生长期分别为72 h和36 h。进入平稳期后,未处理组菌体量显著高于处理组。这可能是红外辐照使得一部分黄曲霉孢子死亡而无法继续生长,且存活的部分黄曲霉孢子由于红外辐照的作用受到一定程度的损伤,菌体活力受到影响,导致生长周期和生长量发生变化。

图1 红外辐照对黄曲霉生长曲线的影响
2.1.3 红外辐照对黄曲霉产AFB1能力的影响 由图2可知,红外辐照后,发酵液中总AFB1含量和单位菌体产毒含量显著降低。30%含水率大米红外115 ℃处理5 min后,与对照组相比,AFB1总量下降63.09%,单位菌体产毒量下降38.44%;而20%含水率大米AFB1总量下降55.04%,单位菌体产毒量下降约22.54%。大米含水率越高,黄曲霉产毒含量越低,可能是大米表面的黄曲霉孢子在高水分环境下处于相对活跃状态,抗热性更差,远红外对黄曲霉孢子损伤越大,产毒能力下降越显著。丁丁等[24]发现紫外辐照后黄曲霉菌产AFB1减少,但没考虑紫外线对霉菌的致死作用也会导致产AFB1总量的减少。AFB1热分解温度为237~299 ℃,采用115 ℃辐照温度处理5 min,不能直接降解AFB1,但能有效抑制黄曲霉菌产毒能力,降低后期粮食污染和霉变风险。

同系列中不同字母表示组间差异显著,P<0.05
2.2 红外辐照对大米品质的影响
2.2.1 红外辐照对大米含水率的影响 图3为30%含水率大米在不同温度不同处理时间后含水率的变化。由图3可知,红外辐照温度越高,干燥速率越大,大米达到安全水分所需时间越短。大米含水率为30%时,红外辐照70,80,90,100,105 ℃,分别处理70,60,40,30,30 min,大米可以达到安全水分14.5%。在干燥后期,不同辐照温度的干燥速率明显降低,这是由于后期大米含水率低,水分梯度减小,水分子向表面迁移的速率降低,干燥时间变长[25]。对含水率20%的大米,宜红外115 ℃辐照5 min后于70 ℃保温30 min。高温辐照时,大米水分显著降低,保温过程大米水分损失较慢,这是因为在密闭环境中,受热蒸发的水汽难以挥发,环境湿度与样品水分梯度小,样品中水分子迁移速率降低。采用高温结合保温工艺,既能作为大米高温处理后的缓苏工艺,又能延长处理时间,增强杀菌效果,避免大米水分过低引起大米品质的降低。

图3 红外辐照对大米含水率的影响
2.2.2 红外辐照对大米色泽的影响 由表3可知,与对照组相比,红外处理后的大米L值、b值无显著性差异,含水率30%和20%的大米经115 ℃处理5 min后,色度a值和对照组差异显著,可能是大米初始含水率差异造成的。含水率20%的大米先115 ℃处理5 min后于70 ℃保温30 min,色度a值升高,说明保温时间不宜过长。红外辐照后,大米总色差△E均小于3.0,杨丹等[18]对稻米的研究表明,当△E<1.5时,说明样品与对照组无差异;1.5<△E<3.0时稍有差异;3.0<△E<6.0时有差异;△E>6.0时有显著差异。说明红外处理后大米表面色泽变化较小,在可接受范围内。
2.2.3 红外辐照对大米可溶性蛋白的影响 由表3可知,在一定辐照温度下,随着处理时间的延长,大米可溶性蛋白含量逐渐降低。Lv等[26]研究发现热处理导致米糠可溶性蛋白溶解度降低。这是因为高温使蛋白质发生变性,疏水基团暴露,水溶性降低[27]。辐照条件相同时,含水率30%的大米可溶性蛋白含量为(677.03±35.48) μg/g,含水率20%的大米的可溶性蛋白含量为(781.33±18.07) μg/g。这可能是样品含水率越高,水分子对红外辐照能量的吸收越多,水分子与蛋白之间的反应更剧烈,可溶性蛋白含量减少。可溶性蛋白质含量高有利于大米的吸水膨胀和糊化,增加米饭的黏稠度[19]。结果表明,红外辐照更有利于对低含水率大米进行干燥杀菌处理。
2.2.4 红外辐照对大米游离氨基酸含量的影响 由表4可知,含水率20%的大米在红外辐照后结合保温,游离氨基酸含量无明显差异,说明远红外70 ℃保温对大米游离氨基酸影响不大。当红外辐照条件为115 ℃ 处理5 min时,含水率30%的大米游离氨基酸含量增加,而含水率20%大米的无明显变化,可能是大米蛋白质在高水分环境下更容易受热分解生成游离氨基酸,使得游离氨基酸含量增多[28]。

表3 红外辐照对大米色泽及可溶性蛋白的影响†
† 同列字母不同表示组间差异显著,P<0.05;样品1:初始含水率30%大米115 ℃处理5 min;样品2:初始含水率20%大米115 ℃处理5 min;样品3:初始含水率20%大米115 ℃处理5 min,70 ℃保温5 min;样品4:初始含水率20%大米115 ℃处理5 min,70 ℃保温15 min;样品5:初始含水率20%大米115 ℃处理5 min,70 ℃保温30 min。
续表4
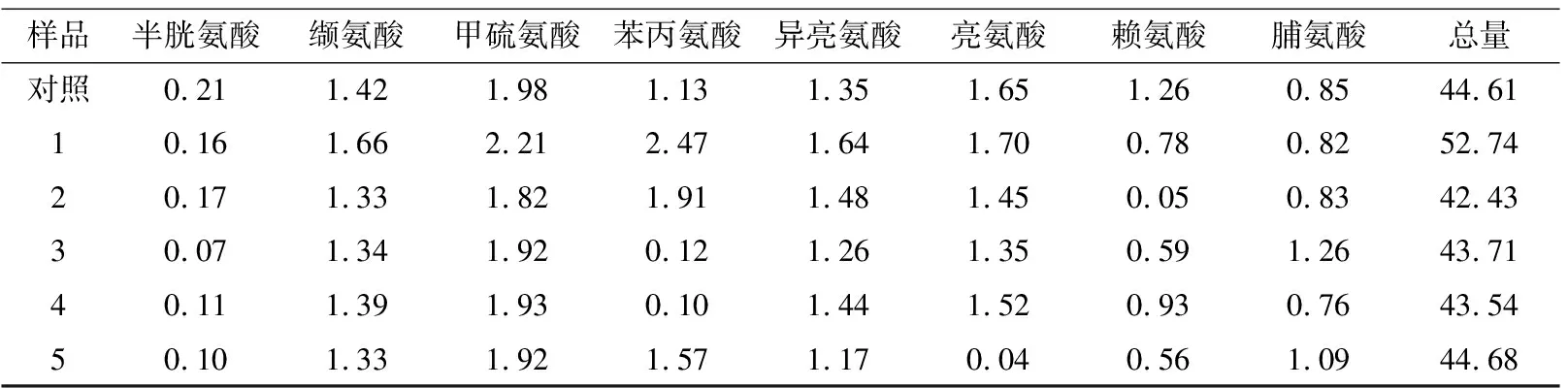
样品半胱氨酸缬氨酸甲硫氨酸苯丙氨酸异亮氨酸亮氨酸赖氨酸脯氨酸总量对照0.211.421.981.131.351.651.260.8544.6110.161.662.212.471.641.700.780.8252.7420.171.331.821.911.481.450.050.8342.4330.071.341.920.121.261.350.591.2643.7140.111.391.930.101.441.520.930.7643.5450.101.331.921.571.170.040.561.0944.68
† 1.对照组;2. 初始含水率30%大米115 ℃处理5 min;3. 初始含水率20%大米115 ℃处理5 min;4. 初始含水率20%大米115 ℃处理5 min,70 ℃保温5 min;5. 初始含水率20%大米115 ℃处理5 min,70 ℃保温15 min;6. 初始含水率20%大米115 ℃处理5 min,70 ℃保温30 min。
3 结论
采用远红外辐照115 ℃处理5 min能有效降低黄曲霉孢子数量和黄曲霉菌产毒能力,显著影响黄曲霉生长曲线。采用115 ℃辐照后结合70 ℃保温,黄曲霉对数降低值明显增加,色差值L、b及△E变化不显著,游离氨基酸无显著变化,可溶性蛋白降低。
红外辐照具有较高的杀菌效率,虽辐照条件不足以直接降解黄曲霉毒素,但能有效降低黄曲霉产AFB1能力,降低黄曲霉和黄曲霉毒素对粮食污染的风险。通过改进现有工艺,同时实现干燥和杀菌的目的,具有技术和经济可行性。
[1] GARCIA-CELA M E, MARIN S, REYES M, et al. Conidia survival of Aspergillus section Nigri, Flavi and Circumdati under UV-A and UV-B radiation with cycling temperature/light regime[J]. Journal of the Science of Food and Agriculture, 2016, 96(6): 2 249-2 256.
[2] HUSSEIN H Z, TUAMA R H, ALI A M. Study the Effect of ozone gas and ultraviolet radiation and microwave on the degradation of aflatoxin B1produce by Aspergillus flavus on stored maize grains[J]. IOSR Journal of Agriculture and Veterinary Science, 2015, 8(5): 5-12.
[3] ZENKLUSEN M H, CORONEL M B, CASTRO M A, et al. Inactivation of Aspergillus carbonarius and Aspergillus flavus in malting barley by pulsed light and impact on germination capacity and microstructure[J]. Innovative Food Science & Emerging Technologies, 2018, 45: 161-168.
[4] NAKATA T, OKAMOTO A, SAWAI J, et al. Effects of far-infrared irradiative heating pasteurization on fungi[J]. Journal of Biosciences and Medicines, 2015, 3(7): 60.
[5] YANG Sha, BAI Xiao-long, JIN Ri-ya, et al. Study on the sterilization of chlorine dioxide gas on Aspergillus flavus[J]. Science & Technology of Food Industry, 2013, 34(15): 212-213.
[6] SAVI G D, PIACENTINI K C, SCUSSEL V M. Ozone treatment efficiency in aspergillus and penicillium growth inhibition and mycotoxin degradation of stored wheat grains (TriticumaestivumL.)[J]. Journal of Food Processing & Preservation, 2015, 39(6): 940-948.
[7] 钱洋. 乳酸菌对食品中常见霉菌的抑制和黄曲霉素的去除[D]. 济南: 山东大学, 2012: 25-33.
[8] 章挺. 枯草芽孢杆菌 B-FS06 对黄曲霉的抑制及活性物质的研究[D]. 南京: 南京师范大学, 2007: 14-20.
[9] GOMAA E Z, ABDELALL M F, ELMAHDY O M. Detoxification of aflatoxin B1by antifungal compounds from lactobacillus brevis and lactobacillus paracasei, isolated from dairy products[J]. Probiotics & Antimicrobial Proteins, 2017(1): 1-9.
[10] 夏朝勇, 朱文学, 张仲欣. 红外辐射技术在农副产品加工中的应用与进展[J]. 农机化研究, 2006(1): 196-198.
[11] 王相友, 操瑞兵, 孙传祝. 红外加热技术在农业物料加工中的应用[J]. 农业机械学报, 2007, 38(7): 177-182.
[12] NAKATA T, OKAMOTO A, SAWAI J, et al. Effects of far-infrared irradiative heating pasteurization on fungi[J]. Journal of Biosciences & Medicines, 2015, 3(7): 60-65.
[13] HAMANAKA D, ATUNGULU G G, TANAKA F, et al. Effect of combining infrared heating with ultraviolet irradiation on inactivation of mold spores[J]. Food Science and Technology Research, 2010, 16(4): 279-284.
[14] ATHANASSIOU C G, CHIOU A, RUMBOS C I, et al. Effects of electric infrared heating with light source penetration on microbial and entomological loads of dried currants and their organoleptic characteristics[J]. Journal of Pest Science, 2016, 89(4): 931-943.
[15] ERDOGDU S B, EKIZ H I. Far infrared and ultraviolet radiation as a combined method for surface pasteurization of black pepper seeds[J]. Journal of Food Engineering, 2013, 116(2): 310-314.
[16] WANG B, KHIR R, PAN Z, et al. Effective disinfection of rough rice using infrared radiation heating[J]. Journal of Food Protection, 2014, 77(9): 1 538.
[17] 易志. 稻谷催化式红外辐照防霉杀虫研究[D]. 镇江: 江苏大学, 2014: 11-13.
[18] 杨丹, 罗小虎, 齐丽君, 等. 电子束辐照对稻米储藏特性及品质的影响[J]. 食品与机械, 2017, 33(2): 106-110.
[19] 杨慧萍, 蔡雪梅, 陈琴. 两种温度两种干燥方式对稻谷品质的影响[J]. 粮食储藏, 2013(1): 34-38.
[20] 张庄英, 范文来, 徐岩. 不同香型白酒中游离氨基酸比较分析[J]. 食品工业科技, 2014, 35(17): 280-284.
[21] 任梦影, 周素梅, 佟立涛, 等. 不同热处理对籼米及其半干粉品质的影响[J]. 食品与机械, 2017, 33(7): 170-174.
[22] RAMASWAMY R, KRISHNAMURTHY K, JUN S. Microbial decontamination of food by infrared (IR) heating[J]. Microbial Decontamination in the Food Industry, 2012: 450-471.
[23] BINGOL G, YANG Jing, BRANDL M T, et al. Infrared pasteurization of raw almonds[J]. Journal of Food Engineering, 2011, 104(3): 387-393.
[24] 丁丁, 胡梁斌, 丁武, 等. 紫外线照射对黄曲霉菌产毒影响的研究[J]. 江西农业学报, 2012, 24(10): 140-141.
[25] 罗剑毅. 稻谷的远红外干燥特性和工艺的实验研究[D]. 杭州: 浙江大学, 2006: 7-8.
[26] LV Shi-wen, SUN Li-hui, ZHAO Shu-yan, et al. Effect of dry heat stabilisation on the functional properties of rice bran proteins[J]. International Journal of Food Science & Technology, 2017, 52(8): 1 836-1 843.
[27] RUNYON J R, SUNILKUMAR B A, NILSSON L, et al. The effect of heat treatment on the soluble protein content of oats[J]. J Cereal Sci, 2015(65): 119-124.
[28] ZILIC S, BOZOVIC I, SAVIC S, et al. Heat processing of soybean kernel and its effect on lysine availability and protein solubility[J]. Open Life Sciences, 2006, 1(4): 572-583.

