盐胁迫对菘蓝幼苗生长和抗性生理的影响
米永伟,王国祥,龚成文,蔡子平,武伟国
(甘肃省农业科学院中药材研究所,甘肃省中药材种质改良与质量控制工程实验室,甘肃省名贵中药材驯化与种苗繁育工程中心,甘肃 兰州730070)
土壤盐渍化是当前最为严重的生态问题之一,也是制约农林业生产及可持续发展的主要因素[1]。近年来,由于灌溉和化肥使用不当、工业污染等原因,次生盐渍化土壤面积也在逐年扩大。我国盐渍化土壤主要分布在西北、华北、东北和滨海地区,而这些地区多为平原,土层深厚,如能改造开发,对发展农业有着巨大的潜力。因此,针对这些地区资源分布和自然环境的特点,充分挖掘和筛选既能适应盐渍化环境又能获得一定经济价值的药用植物,不但可以提速当地农业经济的发展,而且对盐碱荒地的综合开发利用具有非常重要的作用。
菘蓝(Isatisindigotica)为十字花科(Cruciferae)菘蓝属(Isatis)两年生草本药用植物,以干燥叶和根入药,根称板蓝根,叶称大青叶,加工品称青黛,它既可以作为药用又是一种天然健康的还原染料。其味苦,性寒,具有凉血消肿,清热解毒之功效,用于瘟疫时毒,发热咽痛,温毒发斑,大头瘟疫,丹毒,痈肿等症,现广泛用于治疗感冒、抗流感和抗病毒等方面[2-5]。大青叶和板蓝根(Isatistinctoria)是我国传统常用大宗中药材,常年需求量较大,常与其他中药组成复合配方,用于治疗多种疾病,是公认的有较好抗病毒效果的少数中药材之一。而靛玉红作为药材大青叶和板蓝根的主要有效活性成分,有研究表明适当逆境胁迫能有效提高菘蓝幼苗体内靛玉红的累积量,在盐、干旱、低温等逆境处理12 h后菘蓝幼苗中靛玉红含量能提高59.05%~161.67%,且以250 mmol·L-1NaCl 胁迫处理含量提高最显著[6]。王竹承等[7]指出菘蓝具有较强的抗旱能力,在土壤干旱逆境下其生长受到明显抑制,但其保护酶系统和渗透调节物质能够快速变化保持植株的正常生理代谢功能并维持其生长。目前,对菘蓝的研究主要集中在栽培农艺、干旱逆境、化学成分及药理等方面[8-11],而关于盐胁迫对菘蓝生长和抗性生理变化研究较少。通常来说,在植物的生活史中,种子萌发后的幼苗期是最脆弱的时期,在幼苗期的耐盐程度是评价其是否适应一定的盐逆境胁迫环境的重要指标[12]。因此,研究盐胁迫对菘蓝幼苗生长和抗性生理的影响,旨在揭示菘蓝对盐的耐性及生理调节机制,以创新和扩大菘蓝种植区域,为建立和完善盐碱地菘蓝种植技术提供一定的理论指导。
1 材料与方法
1.1 试验材料与幼苗培养
供试材料为菘蓝,品种为“定蓝1号”,种子由定西市农科院提供。试验于2016年10月在甘肃省农业科学院中药材研究所温室进行。试验采用盆栽砂培法,将充分洗净晒干的河砂等量装入盆钵规格为35 cm×20 cm×24 cm的盆中,盆地垫纱布防止基质流失。选取大小、饱满度基本一致的菘蓝种子进行播种,每盆30粒,共播种18盆,隔天用蒸馏水定量浇灌。出苗后3 d,用Hoagland营养液进行培养,每盆定苗长势一致的幼苗20株。
1.2 盐胁迫处理
处理前进行菘蓝种子发芽预试验,确实菘蓝种子的耐盐性,试验结果表明菘蓝种子在浓度为120 mmol·L-1NaCl胁迫下种子发芽率仅为17.67%。出苗10 d后分别用0,30,60,90,120,150 mmol·L-1的NaCl溶液每隔1 d定时、定量浇灌1次,浇灌量为持水量的2倍,多余溶液流出,其中以不加NaCl的完全Hoagland营养液处理为对照,每个处理重复3盆。为避免盐冲击效应,胁迫初次用1/3浓度胁迫,第2次胁迫浓度为1/2浓度,第3次开始按预定浓度胁迫。盐处理14 d后进行采样及有关指标测定。
1.3 测定指标和方法
1.3.1生长指标测定 每盆采样5株,先用直尺量取菘蓝株高和根长,再用蒸馏水冲洗全株,洗净后用吸水纸吸干表面水分,称得5株总鲜重。然后将菘蓝整株分成根和叶两部分,分别称量5株根和叶总鲜重后放入105 ℃烘箱中杀青15 min,70 ℃烘干至恒量后称取干重。
1.3.2根系活力测定 按照 TTC(2, 3, 5-氯化三苯四氮唑)还原法测定[13]。
1.3.3叶片相对含水量测定 按饱和称重法测定[14]。
1.3.4脯氨酸含量测定 采用磺基水杨酸法测定[14]。
1.3.5根质膜透性测定 采用电导率法(DDS-11A型)测定电解质渗透率[15]。
1.3.6丙二醛(MDA)含量、自动氧化速率(RAD)、保护酶SOD和POD活性测定 MDA含量采用硫代巴比妥酸法测定,SOD活性采用氮蓝四唑还原法测定,POD活性采用愈创木酚显色法测定,其具体操作均参照Guo等[13]的方法[16]。自动氧化速率按李柏林等[17]的方法测定5 h后的MDA含量,以每小时MDA含量的平均增加来表示组织自动氧化速率。
1.4 统计分析
采用SPSS 11.5软件进行方差分析,用Excel 2003制图。
2 结果与分析
2.1 盐胁迫对菘蓝幼苗生长的影响
在整个胁迫过程中,与对照相比,30~90 mmol·L-1NaCl胁迫下菘蓝幼苗植株外观长势受抑制不明显,而NaCl浓度大于90 mmol·L-1时,幼苗老叶开始黄化,对其生长抑制作用明显。由表1可知,随着NaCl浓度增加,菘蓝幼苗株高和根长均呈下降趋势,当NaCl浓度为120 mmol·L-1时,盐胁迫对菘蓝株高有显著抑制作用(P<0.05),较对照相比株高降低了15.32%;NaCl浓度达到150 mmol·L-1时,盐胁迫对菘蓝根长的抑制达到显著水平(P<0.05),较对照降低了17.20%,说明菘蓝地上部较地下部易受到伤害。
菘蓝幼苗在不同NaCl浓度胁迫14 d后,其生物量的积累随NaCl浓度增加总体呈下降趋势。NaCl浓度在30~60 mmol·L-1时,其生物量较对照有所下降,但未达到显著水平(P>0.05);当NaCl浓度达到90 mmol·L-1时,菘蓝的叶鲜重较对照极显著降低(P<0.01),根干重较对照显著下降了18.75%(P<0.05);当NaCl浓度达到120 mmol·L-1时,菘蓝幼苗叶片和根的生物量均较对照显著下降(P<0.05),NaCl浓度为150 mmol·L-1时,叶鲜重、叶干重、根干重与对照相比分别下降了58.32%、46.70%和25%(P<0.01),根鲜重下降了38.79%(P<0.05)。
2.2 盐胁迫对菘蓝幼苗叶片相对含水量和根质膜透性的影响
菘蓝幼苗叶片相对含水量随着盐胁迫浓度的增加,整体呈下降的趋势。与对照相比,NaCl浓度为30 mmol·L-1时叶片相对含水量下降幅度较小,差异不显著(P>0.05)。当NaCl浓度达到60 mmol·L-1时,菘蓝幼苗叶片的相对含水量显著降低(P<0.05),随着盐浓度的继续增加,菘蓝叶片的相对含水量呈极显著下降趋势(P<0.01)。当NaCl浓度达到150 mmol·L-1时,菘蓝幼苗叶片相对含水量与对照相比下降了9.34%(表2)。
由表2可知,菘蓝幼苗根中电解质渗透率的变化趋势与叶片相对含水量的变化趋势相反,随着胁迫盐浓度的增加呈逐渐升高趋势。NaCl浓度为30 mmol·L-1时根相对电导率不受胁迫的影响,当NaCl浓度大于60 mmol·L-1时菘蓝幼苗根的相对电导率极显著升高(P<0.01),与对照相比分别增加了15.43%、16.81%和17.21%。由此说明在盐胁迫条件下菘蓝幼苗根质膜受到伤害,细胞膜通透性的增大,造成电解质渗漏加剧。
2.3 盐胁迫对菘蓝幼苗根系活力的影响
由图1可知,随着NaCl胁迫浓度的递增,菘蓝幼苗根系活力呈下降趋势,其变化与根系生长基本一致,未进行胁迫处理下,菘蓝幼苗根系TTC还原活力最强。在低浓度NaCl胁迫下,即NaCl浓度低于90 mmol·L-1时,菘蓝幼苗根系活力较对照下降未达到显著水平,随着浓度的递增在120 mmol·L-1处理下其根系活力较对照显著下降(P<0.05),浓度达到150 mmol·L-1时菘蓝幼苗根系活力较对照下降了61.21%,达到极显著水平(P<0.01)。
2.4 盐胁迫对菘蓝幼苗叶片脯氨酸含量的影响
由图1可知,盐胁迫处理可大幅度提高菘蓝幼苗叶片脯氨酸的含量,随着盐浓度的递增脯氨酸含量整体呈增加趋势。NaCl浓度为30 mmol·L-1时脯氨酸含量较对照增加50.67%,差异未达到显著(P>0.05)。当NaCl浓度达到90 mmol·L-1时,菘蓝幼苗叶片的脯氨酸含量较对照极显著增加(P<0.01),较对照增加了195.34%。随着盐浓度的增加,其含量继续呈极显著增加趋势(P<0.01),当NaCl浓度达到150 mmol·L-1时,菘蓝幼苗叶片脯氨酸的含量达229.834 μg·g-1,与对照相比增加了337.71%。


图1 不同盐浓度对菘蓝幼苗根系活力和叶片脯氨酸含量的影响Fig.1 Effect of different salt concentration on the root activity and leaf proline content of I. indigotica seedling 图中不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),下同。Different small letters mean significant differences at P<0.05; different capital letters mean significant differences at P<0.01. The same below.
2.5 盐胁迫对菘蓝叶片MDA含量和自动氧化速率RAD的影响
由图2可知,随着NaCl浓度的递增,菘蓝叶片中过氧化产物MDA含量呈先下降后上升再下降的趋势,组织自动氧化速率RAD的变化与MDA变化基本一致。NaCl浓度为30 mmol·L-1时幼苗叶片中MDA含量和RAD较对照下降了0.09 μmol·g-1和0.026 μmol·g-1·h-1,差异均不显著(P>0.05)。在60~90 mmol·L-1NaCl胁迫下,MDA含量和RAD都略高于对照,无显著性差异(P>0.05)。当NaCl浓度达到120和150 mmol·L-1时,菘蓝叶片的MDA含量极显著增加(P<0.01),分别较对照增加了47.68%和24.52%;RAD在120 mmol·L-1时最大,较对照增加了107.14%,差异极显著(P<0.01)。
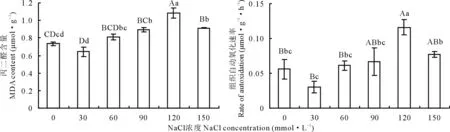
图2 不同盐浓度对菘蓝幼苗叶片MDA含量和自动氧化速率(RAD)的影响Fig.2 Effect of different salt concentration on the leaf MDA content and rates of tissue autoxidation of I. indigotica seedling
2.6 盐胁迫对菘蓝叶片抗氧化酶SOD、POD活性的影响
SOD和POD作为植物体内主要的抗氧化酶,其活性的强弱可以反映植物体抗逆能力的强弱。由图3可知,SOD活性随着NaCl浓度的递增呈升高后降低的趋势,但在NaCl胁迫各处理下菘蓝叶片SOD活性均高于对照。NaCl浓度小于90 mmol·L-1时菘蓝幼苗叶片内SOD活性与对照相比增加幅度较小,差异不显著(P>0.05)。NaCl浓度在90 mmol·L-1时SOD活性达到最大值,较对照增加了128.88%,差异极显著(P<0.01),而后随NaCl浓度升高呈减少趋势,当NaCl浓度增加到150 mmol·L-1时显著高于对照89.08%(P<0.05)。POD活性的变化基本与SOD一致,NaCl浓度小于90 mmol·L-1时菘蓝幼苗叶片内POD活性较对照增加较少,差异不显著(P>0.05)。NaCl浓度在90 mmol·L-1时POD活性达到最大值,极显著高于对照49.32%(P<0.01),其余各盐胁迫处理也均较对照有所增加,但未达到显著水平(P>0.05)。说明90 mmol·L-1NaCl可能是菘蓝幼苗的最大耐受盐度。
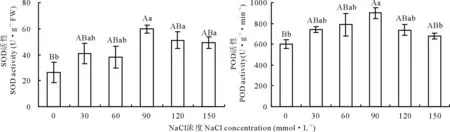
图3 不同盐浓度对菘蓝幼苗叶片SOD、POD活性的影响Fig.3 Effect of different salt concentration on the activities of SOD and POD of I. indigotica seedling
3 讨论与结论
3.1 盐胁迫对菘蓝幼苗生长的影响
盐胁迫对植物个体形态发育具有显著的影响,其最普遍和最明显的影响就是抑制植株组织和器官的生长[18-19]。不同盐浓度、不同植物和同一植物的不同器官和不同生育时期以及不同胁迫时间对植物体都会产生不同的结果[20]。本试验中,NaCl胁迫对菘蓝幼苗株高和根长都有抑制作用,对根和叶的物质积累及叶片相对含水量也有显著影响,并随浓度的递增呈降低的趋势。低浓度NaCl胁迫时菘蓝长势基本正常,NaCl浓度大于60 mmol·L-1时菘蓝叶片首先受到影响,其叶片相对含水量显著降低,说明菘蓝幼苗地上部较地下部易受到伤害。NaCl浓度到达120 mmol·L-1时菘蓝幼苗老叶开始黄化,株高明显变矮,叶片和根的生物量积累也都显著下降,随着盐浓度的继续增加,对菘蓝幼苗株高、根长、叶片相对含水量及物质积累都产生了显著的抑制。研究表明,彩叶草(Coleusblumei)在NaCl浓度低于50 mmol·L-1胁迫下,其植株外观长势正常,随着胁迫浓度的增加,叶片开始出现萎蔫症状逐渐加重,生物量也显著下降[21]。海滨雀稗(Paspalumvaginatum)在低浓度盐胁迫下生长基本不受影响,NaCl浓度达到300 mmol·L-1时,株高、叶长、叶宽和生物量均显著下降,其生长明显受到抑制[22]。菘蓝幼苗在盐胁迫下生长变化与彩叶草和海滨雀稗基本一致。可见,菘蓝幼苗在低浓度NaCl盐环境下能维持其正常生长,浓度大于60 mmol·L-1时菘蓝幼苗生长受到明显抑制,且地上部较根系对盐胁迫更加敏感。
3.2 盐胁迫对菘蓝幼苗根系的影响
根系作为植物体重要的吸收和代谢器官,具有吸收和输导水分和无机盐、合成有机化合物、固定和支持植物体等作用,其生长发育直接影响到地上部茎叶的生长和作物产量的高低[23]。植物根系也是最早、最直接感受到逆境胁迫信号的部位,逆境不仅影响根系的形态和物质积累,还对根系活力、质膜透性等生理指标都有影响。盐生植物黄花补血草(Limoniumaureum)在低浓度NaCl处理下不影响其种子萌发和幼苗生长,甚至促进了根生长;在高浓度NaCl胁迫下其幼苗根尖伸长区细胞的伸长生长受到抑制,细胞膜通透性增加,根细胞受到明显伤害[15]。黄瓜(Cucumissativus)幼苗在盐胁迫下,其根系质膜透性随盐浓度的增加持续升高,根系活力、根系长度和根系体积也逐渐减小,根系生长受到抑制[24]。本试验结果表明,菘蓝幼苗根长、地下部物质积累和根系活力均随NaCl浓度递增呈下降趋势,而根中电解质渗透率的变化趋势与根系生长和根活力的变化趋势相反,呈逐渐升高趋势。低浓度盐胁迫对菘蓝幼苗根系生长的抑制作用不明显,根系活力和根质膜透性变化不显著,说明菘蓝幼苗根系在适宜盐浓度范围内具有一定抵抗盐害的能力。NaCl浓度大于60 mmol·L-1时菘蓝幼苗根物质积累、根系活力显著下降,根细胞质膜透性极显著增加,根系生长受到明显抑制。
3.3 盐胁迫对菘蓝幼苗渗透调节和膜脂过氧化作用的影响
渗透调节是植物耐盐的最基本特征之一,其能力的提高也是植物抗性增强的重要机制。脯氨酸作为最重要和有效的渗透调节物质,植物可通过含量积累来应对逆境的伤害[25]。在本实验中,脯氨酸含量随着盐浓度的递增呈持续增加趋势。低浓度NaCl处理对菘蓝幼苗叶片脯氨酸影响都不显著,说明低浓度盐胁迫对菘蓝伤害较小,自身防御体系能有效保护细胞不受损伤;NaCl浓度大于60 mmol·L-1时,脯氨酸含量显著增加;NaCl浓度达到150 mmol·L-1时,菘蓝幼苗叶片脯氨酸的含量较对照增加了337.71%。韩晓玲[26]证明脯氨酸过量累积可以提高植物的耐盐性,说明菘蓝在盐逆境中可通过积累脯氨酸来减轻对其造成的伤害。
丙二醛是膜脂过氧化作用的主要产物,其含量在一定程度上反映了逆境胁迫对植物的伤害程度。而MDA积累速率即自动氧化速率可表示机体总的清除自由基的能力,一般认为自动氧化速率越大,MDA积累越多,组织的保护能力越弱,反之越强[17]。本试验结果表明,MDA含量和自动氧化速率随NaCl浓度增加呈先下降后上升再下降的趋势。NaCl浓度小于90 mmol·L-1时,对菘蓝幼苗叶片MDA含量和组织自动氧化速率影响都不显著,说明低浓度盐胁迫对菘蓝伤害较小,自身防御体系能有效保护细胞不受损伤,这与海滨雀稗、金盏菊(Calendulaofficinalis)等研究结果相吻合[22,27];随着盐浓度的递增,组织自动氧化速率随着MDA含量迅速增加而持续升高,NaCl浓度在120 mmol·L-1时均达到最大值,之后随浓度增加又开始降低,证明菘蓝细胞潜在保护能力在持续降低,膜脂过氧化程度加剧,细胞膜结构遭到严重损坏。MDA含量出现降低的现象,这可能与脯氨酸超常积累和抗氧化酶系统的调节有关[26,28]。
3.4 盐胁迫对菘蓝幼苗保护酶活性的影响
植物在逆境胁迫下,体内不可避免地产生大量活性氧,为了有效地缓解活性氧带来的伤害,植物体内的抗氧化酶活性迅速升高,以及时清除活性氧。SOD是植物体抗氧化的首要物质,能清除细胞中多余的超氧阴离子,而POD又可清除SOD催化反应的产物过氧化氢,从而免受过氧化氢的毒害。有研究指出植物细胞在盐胁迫下所能忍受的活性氧水平存在一个阈值,在阈值内植物能够通过提高抗氧化酶活性来清除活性氧自由基,当超过这个阈值时抗氧化酶活性便会受到抑制,活性氧过多积累,对植物组织造成伤害[29]。在本研究中,菘蓝幼苗叶片内SOD和POD活性随盐浓度增强先升高后降低。NaCl浓度小于90 mmol·L-1时,SOD和POD活性升高不明显;在120 mmol·L-1时,SOD和POD活性显著升高并达到峰值;随着盐浓度的增加,菘蓝植物体内活性氧平衡系统遭到破坏,活性氧自由基的产生量超过了SOD的清除量,细胞内SOD歧化产生的过氧化氢也超过了POD 的清除阈值,使得SOD和POD活性受到抑制,导致菘蓝对盐害的防御能力下降。这与海滨雀稗、中国柽柳(Tamarixchinensis)等研究结果相一致[22,28]。说明90 mmol·L-1NaCl可能是菘蓝幼苗的最大耐受盐度。
综上所述,盐胁迫能引起菘蓝幼苗根系活力和叶片相对含水量降低,细胞膜通透性和丙二醛含量增加,对幼苗生长具有抑制作用。为了减轻伤害,菘蓝幼苗通过自身积累大量脯氨酸和提高保护酶SOD和POD活性来快速调节生理代谢功能和适应盐胁迫环境条件。但NaCl浓度低于90 mmol·L-1时,盐胁迫对菘蓝幼苗的生长抑制作用不明显,说明菘蓝对低浓度盐环境具有一定的耐受性。
参考文献References:
[1] Zhang Y F, Liang Z W, Sui L,etal. Effect on physiological characteristic ofMedicagosativaunder saline-alkali stress at seeding stage. Acta Prataculturae Sinica, 2009, 18(4): 230-235.
张永锋, 梁正伟, 隋丽, 等. 盐碱胁迫对苗期紫花苜蓿生理特性的影响. 草业学报, 2009, 18(4): 230-235.
[2] State Pharmacopoeia Commission. People’s Republic of China pharmacopoeia (one). Beijing: Chinese Medical Science and Technology Press, 2015: 21,199,205.
国家药典委员会. 中华人民共和国药典(一部). 北京: 中国医药科技出版社,2015: 21,199,205.
[3] Hu S P, Ding T, Zhang D W,etal. The antimicrobial effect of the compound tablet and its effect on immune function. Pharmacology and Clinics of Chinese Materia Medica, 2007, 23(5): 188.
胡淑平, 丁涛, 张殿文, 等. 复方板蓝根含片的抗菌作用及对免疫功能的影响. 中药药理与临床, 2007, 23(5): 188.
[4] Chen Y, Li X, Chen J W,etal. Study on antiviral effects of the active parts fromRadixIsatidis. Journal of Nanjing University of Chinese Medicine, 2011, 27(2): 155-157.
程妍, 李祥, 陈建伟, 等. 板蓝根有效部位的抗病毒药效研究. 南京中医药大学学报, 2011, 27(2): 155-157.
[5] Ma Y M, Li N, Liu C W,etal. Comparative studies on anti-inflammatory and analgesic activities of different fractions fromRadixIsatidis. Chinese Traditional and Herbal Drugs, 2014, 45(17): 2517-2521.
马毅敏, 李娜, 刘承伟, 等. 板蓝根不同提取部位抗炎镇痛活性比较研究. 中草药, 2014, 45(17): 2517-2521.
[6] Duan F, Yang J X, Zhou X K,etal. Effects of stress on the indirubin content ofIsatisindigoticaseedlings. Agricultural Research in the Arid Areas, 2006, 24(3): 111-114.
段飞, 杨建雄, 周西坤, 等. 逆境胁迫对菘蓝幼苗靛玉红含量的影响. 干旱地区农业研究, 2006, 24(3): 111-114.
[7] Wang Z C, Liang Z S, Ding Y H. Effect of water stress on growth and physiological characteristics ofIsatisindigoticaroot. Acta Agriculturae Boreali-occidentalis Sinica, 2010, 19(12): 98-103.
王竹承, 梁宗锁, 丁永华. 水分胁迫对菘蓝幼苗生长和生理特性的影响. 西北农业学报, 2010, 19(12): 98-103.
[8] Chen Y H, Tian H Q, Guo Q S,etal. Effects of various planting densities on dynamic growth rhythm and root yield ofIsatisindigotica. China Journal of Chinese Materia Medica, 2008, 33(22): 2599-2602.
陈宇航, 田汉卿, 郭巧生, 等. 种植密度对菘蓝生长动态及产量的影响. 中国中药杂志, 2008, 33(22): 2599-2602.
[9] Xiao Y H, Lü T T, Tang X Q,etal. Effects of topdressing nitrogen on apparent quality, dry matter accumulation and contents of active components in the root ofIsatisindigotica. Journal of Plant Nutrition and Fertilizer, 2014, 20(2): 437-444.
肖云华, 吕婷婷, 唐晓清, 等. 追施氮肥量对菘蓝根的外形品质、干物质积累及活性成分含量的影响. 植物营养与肥料学报, 2014, 20(2): 437-444.
[10] Wang X L, Chen M H, Wang F,etal. Chemical consitituents from root ofIsatisindigotica. China Journal of Chinese Materia Medica, 2013, 38(8): 1172-1182.
王晓良, 陈明华, 王芳, 等. 板蓝根水提取物的化学成分研究. 中国中药杂志, 2013, 38(8): 1172-1182.
[11] Huang F, Xiong Y T, Xu L H,etal. Pharmacokinetics of epigoitrin, an anti-virus component ofIsatisindigotica, in different extraction in rats. Journal of China Pharmaceutical University, 2006, 37(6): 519-522.
黄芳, 熊雅婷, 徐丽华, 等. 板蓝根不同提取物中抗病毒成分表告依春在大鼠体内的药代动力学. 中国药科大学学报, 2006, 37(6): 519-522.
[12] Liu P, Tian C Y, Feng G,etal. Germination and seedling survival after desiccation of threeSalsolaL. from the solonchak salinities. Arid Land Geography, 2008, 31(2): 271-277.
刘鹏, 田长彦, 冯固, 等. 三种猪毛菜种子耐盐性与幼苗干燥存活能力. 干旱区地理, 2008, 31(2): 271-277.
[13] Guo F X, Chen Y, Li X R,etal. Enhancement of low-temperature tolerance in watermelon (Citrulluslanatus) seedlings by cool-hardening germination. Australian Journal of Experimental Agriculture, 2007, 47(6): 749-754.
[14] Zou Q. Instructional on plant physiology. Beijing: China Agriculture Press, 2007.
邹琦. 植物生理学实验指导. 北京:中国农业出版社, 2007.
[15] You J, Wang W R, Lu J,etal. Effects of salinity on seed germination and seedling growth in halophyteLimoniumaureum(L.) Hill. Acta Ecologica Sinica, 2012, 32(12): 3825-3833.
尤佳, 王文瑞, 卢金, 等. 盐胁迫对盐生植物黄花补血草种子萌发和幼苗生长的影响. 生态学报, 2012, 32(12): 3825-3833.
[16] Guo F X, Zhang M X, Chen Y,etal. Relation of several antioxidant enzymes to rapid freezing resistance in suspension cultured cells from alpineChorisporabungeana. Cryobiology, 2006, 52: 241-250.
[17] Li B L, Mei H S. Relationship between oat leaf senescence and activated oxygen metabolism. Acta Phytophysiologica Sinica, 1989, 15(1): 6-12.
李柏林, 梅慧生. 燕麦叶片衰老与活性氧代谢的关系. 植物生理学报, 1989, 15(1): 6-12.
[18] Cui J J, Zhang X H, Li Y T,etal. Effect of silicon addition on seedling morphological and physiological indicators ofGlycyrrhizauralensisunder salt stress. Acta Prataculturae Sinica, 2015, 24(10): 214-220.
崔佳佳, 张新慧, 李月彤, 等. 外源Si对盐胁迫下甘草幼苗形态及生理指标的影响. 草业学报, 2015, 24(10): 214-220.
[19] Zhang T, Liu X B, Li Z H,etal. Effects of salt stress on the growth and photosynthetic physiology characteristics ofZoysiajaponica. Acta Agrestia Sinica, 2015, 23(3): 539-548.
张涛, 刘信宝, 李志华, 等. NaCl胁迫对结缕草生长及光合生理的影响. 草地学报, 2015, 23(3): 539-548.
[20] Zhao K F. Plant resistance to salt. Beijing: China Science and Technology Press, 1993.
赵可夫. 植物抗盐特性. 北京: 中国科学技术出版社, 1993.
[21] Liu A R, Zhang Y B, Zhong Z H,etal. Effects of salt stress on the growth and osmotic accumulation ofColeusblumei. Acta Prataculturae Sinica, 2013, 22(2): 211-218.
刘爱荣, 张远兵, 钟泽华, 等. 盐胁迫对彩叶草生长和渗透调节物质积累的影响. 草业学报, 2013, 22(2): 211-218.
[22] Jia X P, Deng Y M, Sun X B,etal. Impacts of salt stress on the growth and physiological characteristics ofPaspalumvaginatum. Acta Prataculturae Sinica, 2015, 24(12): 204-212.
贾新平, 邓衍明, 孙晓波, 等. 盐胁迫对海滨雀稗生长和生理特性的影响. 草业学报, 2015, 24(12): 204-212.
[23] Xiong M B, Luo M S, Tian Y B,etal. Dynamics of soil nutrition and wheat root activities and their relationships during wheat growth. Soils and Fertilizers, 2005, (3): 8-11.
熊明彪, 罗茂盛, 田应兵, 等. 小麦生长期土壤养分与根系活力变化及其相关性研究. 土壤肥料, 2005, (3): 8-11.
[24] Wang S P, Guo S R, Li J,etal. Effects of salt stress on the root growth and leaf water use efficiency of cucumber seedlings. Chinese Journal of Applied Ecology, 2006, 17(10): 1883-1888.
王素平, 郭世荣, 李璟, 等. 盐胁迫对黄瓜幼苗根系生长和水分利用的影响. 应用生态学报, 2006, 17(10): 1883-1888.
[25] Chaleff R S. Further characterization of picloram-tolerant mutants ofNicotianatabacum. Theoretical and Applied Genetics, 1980, 57(4): 91-95.
[26] Han X L. In vitro selection of L-Hydroxyproline resistant variants ofCoronillavariaL. and studies on their salt tolerance. Xi’an: Northwest University, 2006.
韩晓玲. 小冠花抗L-羟基脯氨酸(Hyp)变异系离体筛选及其耐盐性研究. 西安: 西北大学, 2006.
[27] Liu A R, Zhang Y B, Fang Y Y,etal. Effects of salt stress on the growth, antioxidant ability and salt stess protein ofCalendulaof ficinalis. Acta Prataculturae Sinica, 2011, 20(6): 52-59.
刘爱荣, 张远兵, 方园园, 等. 盐胁迫对金盏菊生长、抗氧化能力和盐胁迫蛋白的影响. 草业学报, 2011, 20(6): 52-59.
[28] Zhu J F, Liu J T, Lu Z H,etal. Effects of salt stress on physiological characteristics ofTamarixchinensisLour. Seedlings. Acta Ecologica Sinica, 2015, 35(15): 5140-5146.
朱金方, 刘京涛, 陆兆华, 等. 盐胁迫对中国柽柳幼苗生理特性的影响. 生态学报, 2015, 35(15): 5140-5146.
[29] Peng L X, Zhou L J, Feng T,etal. Effects of salt stress on activities of antioxidant enzymes and membrane lipid peroxidation ofElaeagnusangustifoliaL. Seedlings. Journal of Tianjin Agricultural University, 2009, 16(4): 1-4.
彭立新, 周黎君, 冯涛, 等. 盐胁迫对沙枣幼苗抗氧化酶活性和膜脂过氧化的影响. 天津农学院学报, 2009, 16(4): 1-4.

