局灶性房性心动过速导致心肌病的风险因素研究*
张燕,刘筱,田晓芬,陶卉,于杨,吴群英
(华中科技大学同济医学院附属武汉中心医院 心功能科,湖北 武汉430014)
心动过速性心肌病(tachycardia-induced cardiomyopathy, TCM)系长期慢性心动过速导致不规则或过高的心室率,引起心脏扩大并发心力衰竭的临床综合征,最大特点是具有可逆性,即及时经过射频消融术或药物控制可终止和消除其相关的心律失常,心功能甚至可以完全恢复[1-2]。TCM可继发于室上性心动过速[3],但局灶性房性心动过速(atrial tachycardia, ATs)是否可引起TCM一直存有争议。本研究对华中科技大学同济医学院附属武汉中心医院196例心内电生理学检查提示局灶性ATs患者的临床资料进行研究,分析局灶性ATs导致TCM的发病率及危险因素。
1 资料与方法
1.1 一般资料
选取2007年3月-2015年3月在本院行心内电生理学检查并确诊为局灶性ATs的196例患者。其中,男性84例,女性112例;年龄23~86岁,中位年龄(42.78±18.34)岁;平均左心室射血分数(left ventricle ejection fraction, LVEF)(61.85±6.47)%,其中17例患者临床检查及超声心动图提示无器质性心脏病但存在左室功能障碍(LVEF<50%),确诊为TCM,其发生率为8.67%。纳入标准:①局灶性ATs是患者本身就有,而非由心内电生理学检查诱导产生;②临床检查和超声心动图提示无器质性或结构性心脏病;③符合TCM:患者本身无器质性心脏疾病且LVEF<50%,经有效控制心率后能改善LVEF≥15%[4]。排除标准:①患有严重的冠状动脉疾病﹑心脏瓣膜病﹑先天性心脏病或遗传性心肌病等;②既往有心肌病史。
1.2 方法
1.2.1 电生理检查及射频消融术 所有患者签署检查或手术同意书,检查前或术前停用抗心律失常药物>5个半衰期。检查或术前连接体表心电图的滤波频率30~500 Hz。根据不同的靶心律失常采取相应的手术方式。采用经皮股静脉或动脉(左侧起源)应用常规消融方法(仪器型号美国IBI-1500)或Carto XP系统(美国强生公司FG-4700-00)进行消融。消融结束后,行程序刺激或者静脉滴注异丙肾上腺素来验证手术是否成功。
1.2.2 超声心动图 采用美国GE公司生产的Vivid7型彩色多普勒超声显像仪,探头发射频率2.0~3.5 MHz,受检者取左侧卧位,平静呼吸,同步记录心电图以确定时相。所有指标连续测量3个心动周期,取平均值。在二维超声引导下取胸骨旁左室长轴切面于舒张末期测量左室舒张末最大前后径(left ventricular end diastolic dimension, LVDD)。正常参考值37~55 mm。在心尖四腔切面采用单平面Simpson法测量LVEF[5]。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以率(%)表示,比较用χ2检验;影响因素的分析采用多因素Cox回归模型,P<0.05为差异有统计学意义。
2 结果
2.1 TCM组与非TCM组患者一般情况比较
两组患者年龄比较,经t检验,差异有统计学意义(P<0.05);两组患者性别﹑心动过速的性质比较,经χ2检验,差异有统计学意义(P<0.05),TCM多见于年轻男性患者,且心动过速的性质多为持续性。但两组患者的主要临床症状﹑心动过速周期长度﹑频数﹑心率及合并症比较,差异无统计学意义(P>0.05)。见表1。
2.2 TCM的危险因素
多因素Cox生存分析局灶性ATs导致TCM的危险因素,因变量为生存月数(导致心肌病时间);自变量包括年龄(≤45岁或>45岁)﹑性别﹑心动过速的性质(阵发性或持续性)﹑心动过速周期长度(≤300 ms或>300 ms)﹑发作频数(≤40次/年或>40次/年)及心率(≤140次/min或140次/min)。每个自变量分别赋值0和1,结果发现只有年龄(≤45岁)和持续性心动过速2个因素与TCM患者的独立性相关(P<0.05)见表2。
2.3 两组持续性心动过速患者一般情况比较
两组患者中持续性心动过速患者的年龄比较,经t检验,差异有统计学意义(P<0.05)。而两组持续性心动过速患者的主要临床症状﹑周期长度﹑心率比较,差异无统计学意义(P>0.05)。见表3。
2.4 TCM组患者的治疗效果
17例TCM患者接受射频消融术治疗,在(51±19)个月的随访中,1例患者在服用胺碘酮1年后未经同意擅自停服胺碘酮,最终死于心力衰竭,其他16例患者LVEF提高,左室射血功能改善。16例TCM患者治疗前LVEF(43.9±5.8)%,治疗后LVEF(61.1±3.5)%,经配对t检验,差异有统计学意义(t=-10.156,P=0.000)(见附图)。其中14例手术成功且在随后的随访中未复发;2例患者经射频消融术治疗后未消除心动过速,这2例患者在服用胺碘酮后控制了心率且症状消失。
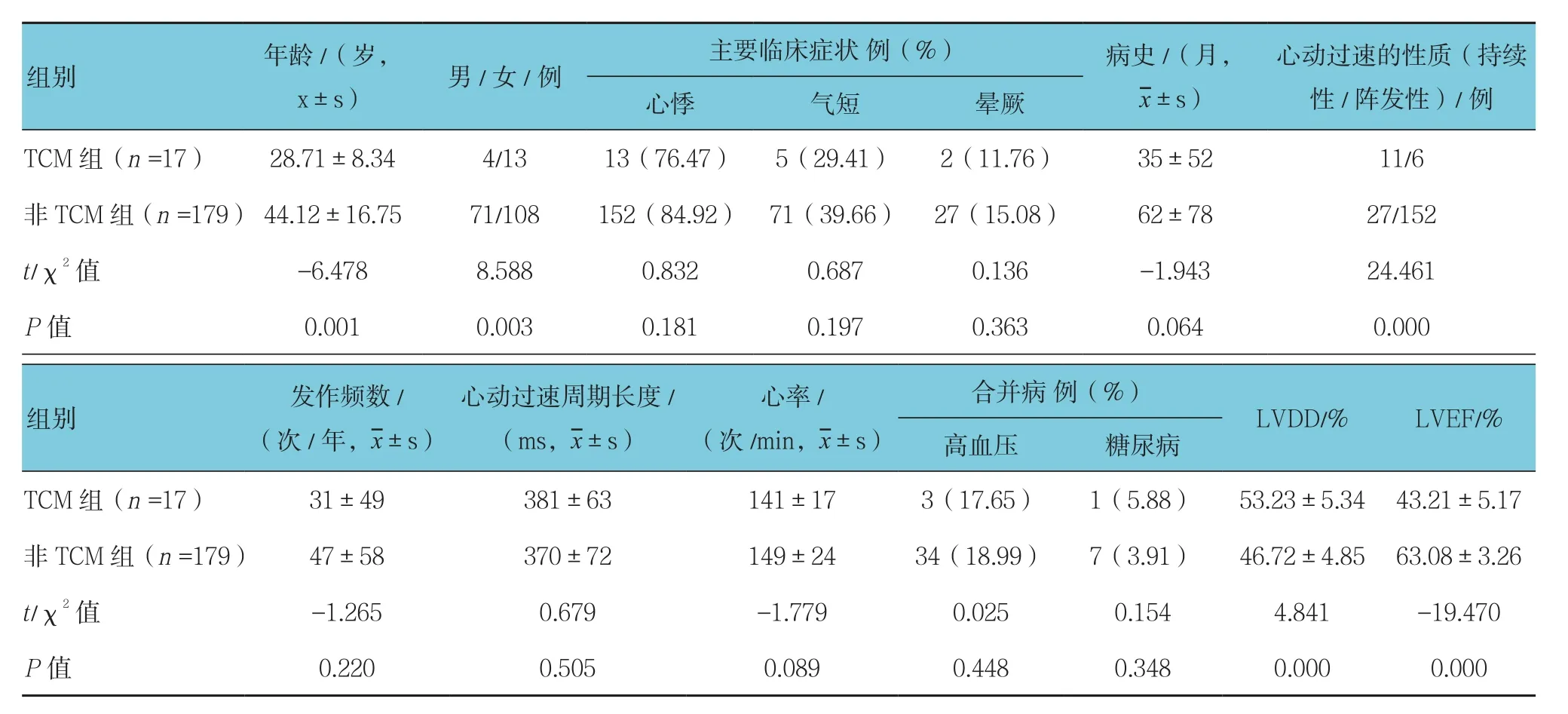
表1 两组患者一般情况比较

表2 TCM危险因素的多因素Cox生存分析相关参数
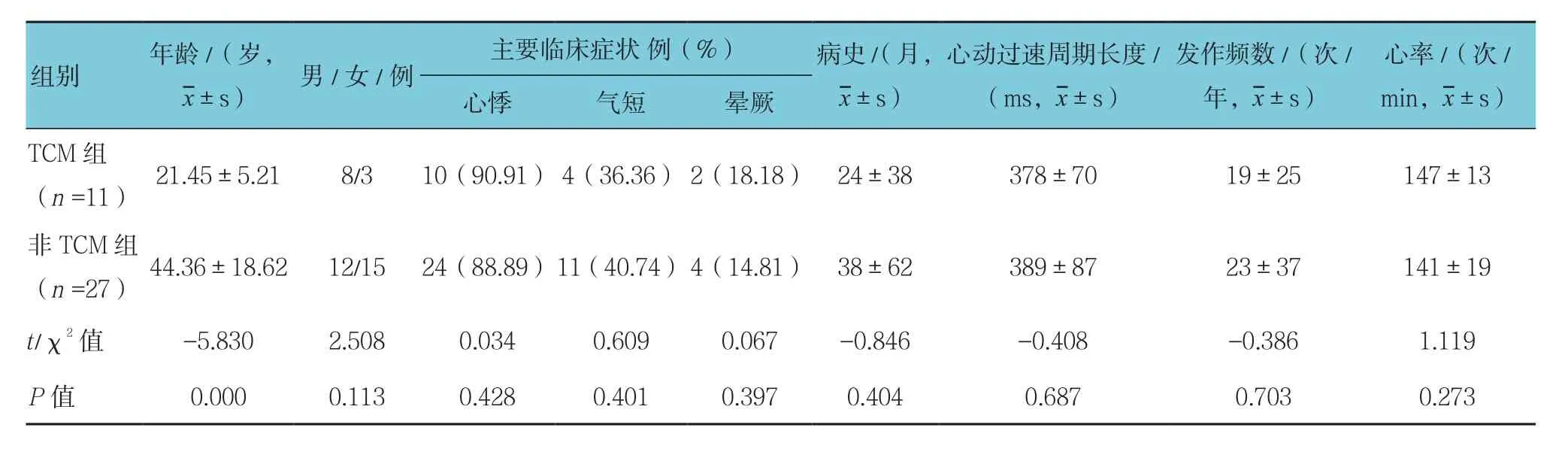
表3 两组持续性心动过速患者一般情况比较
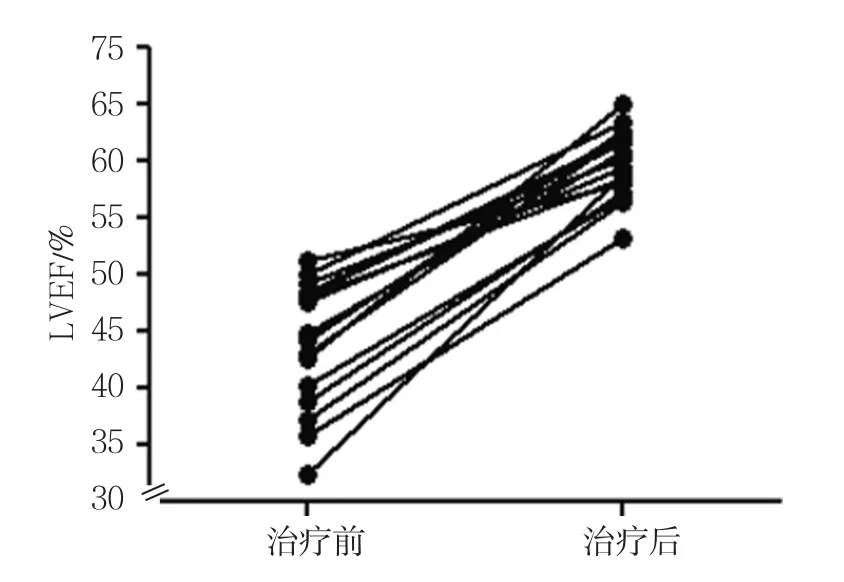
附图 TCM患者经射频消融术或药物治疗前后的LVEF比较
3 讨论
动物实验发现,TCM是由于长期慢性室性或室上性心律失常所致的心脏结构和功能改变的疾病[6-7]。众所周知,TCM可继发于房性心动过速,但是局灶性ATs导致TCM的相关结果未见报道。实际上,因为对左室功能障碍的界定不清,临床医师在诊断一些无法解释的心肌病时,约50%都将其归类为特发性心肌病,而这其中就有因心动过速引起的TCM[8]。当左室功能减退或收缩功能障碍不能由其他原因解释,且存在持续性心动过速时,应考虑本病的存在。本研究中,心内电生理学提示,局灶性ATs最终导致TCM的发生率为8.67%,与国外报道的发生率10%相似[9]。
大部分研究表明,由慢性室上性心动过速引起的充血性心力衰竭多见于儿童和新生儿[10]。本研究中,年龄是局灶性ATs继发为TCM的一个显著独立危险因素。目前原因尚不明确,可能与以下因素有关:①某些脏器结构在成年与幼年动物的致病过程有所不同[11];②从系统层面而言,年轻局灶性ATs患者可能更容易受到激发,导致TCM[12]。然而,年龄对疾病进展及心室功能受损程度可逆性的影响目前尚不清楚。有研究发现,TCM与心动过速的持续性相关[13],本研究结果还发现,持续性也是TCM的独立危险因素。MONAHAN等[14]经动物实验研究发现,心动过速的持续时间﹑频率与心肌功能障碍密切相关,因此持续性的心动过速更易导致TCM的发生。
大多数TCM患者最显著的特点是可逆,在经过射频消融术或药物治疗后能控制心率及消除临床症状,因此在(51±18)个月的随访中,大部分患者的左室射血功能都能得到改善,心腔结构和心功能可完全恢复正常或接近正常,预后良好。然而,本研究中有1例患者由于未能有效地控制心率,导致左室功能障碍,最终死于心力衰竭,国外也报道过相似的病例[15-16]。这一现象可解释为尽管左室功能结构是可逆的,但是因为长期心率控制不佳可导致持续的超微结构的变化,最终影响心室收缩-舒张功能不全﹑心脏肥大等一系列改变[17]。另外,据报道,心衰时心肌细胞重构,T管和L型钙通道密度下降[18],引起兴奋-收缩耦联障碍,这可能也是心动过速性心肌病心肌收缩力下降的原因之一[19-20]。因此,TCM患者经过射频消融术或药物治疗后仍需严格控制心率,这对患者的预后具有重大的意义。
由于心律失常的发作时间不定,且发作时症状不明显,因此患者的实际最早发作时间无法确定,为克服这一缺点,本实验收集患者的症状,如心悸﹑气短﹑晕厥,进行比较,反映疾病的不同阶段。此外,研究发现,年龄是局灶性ATs导致TCM的危险因素,但是年龄与TCM的后续发展是否相关,目前尚不确定。治疗上,射频消融术是近年来快速发展的一项治疗心律失常的重要方法,是治疗TCM的一种较为安全且有效的方法。
参 考 文 献:
[1]BOHORA S, LOKHANDWALA Y, PAREKH P, et al. Reversal of tachycardiomyopathy due to left atrial tachycardia by ivabradine[J].Cardiovasc Electrophysiol, 2011, 22(3): 340-342.
[2]HUIZAR J F, KASZALA K, POTFAY J, et al. Left ventricular systolicdys function induced by ventricular ectopy a novel model for premature ventricular contraction induced cardiomyopathy[J].Circ Arrhythm Electrophysiol, 2011, 4(4): 543-549.
[3]SALEMI V M, ARTEAGA E, MADY C. Recovery of systolic and diastolic function after ablation of incessant supraventricular tachycardia[J]. Eur J Heart Fail, 2005, 7(7): 1177-1179.
[4]ROMEO E, GRIMALDI N, SARUBBI B, et al. A pediatric case of cardiomyopathy induced by inappropriate sinus tachycardia:efficacy of ivabradine[J]. Pediatr Cardiol, 2011, 32(6): 842-845.
[5]LISHMANOV A, CHOCKALINGAM P, SENTHILKUMAR A, et al. Tachycardia induced cardiomyopathy:evaluation and therapeutic options[J]. Congetive Heart Failure, 2010, 16(3): 122-126.
[6]AKOUM N W, DACCARETT M, WASMUND S L, et al. An animal model for ectopy-induced cardiomyopathy[J]. Pacing Clin Electrophysiol, 2011, 34(3): 291-295.
[7]HASDEMIR C, YUKSEL A, CAMLI D, et al. Late-gadoliniumen hancement CMR inpatients with tachycardia induced cardiomyopathy caused by idiopathic ventricular arrhythmias[J].Pacing Clin Electrophysiol, 2012, 35(4): 465-470.
[8]CALKINS H, KUCK K H, CAPPATO R, et al. ECAS expert consensus statement on catheter and surgical ablation of atrial fi brillation[J]. Heart Rhythm, 2012, 9(2): 632-696.
[9]MEDI C, KALMAN J M, HAQQANI H, et al. Tachycardia-mediated cardiomyopathy secondary to focal atrial tachycardia:Long-term outcome after catheter ablation[J]. J Am Coll Cardiol,2009, 53(19): 1791-1797.
[10]BREMBILLA-PERROT B, BÉNICHOU M, BREMBILLA A, et al. AV nodal reentrant tachycardia or AV reentrant tachycardia using a concealed bypass tract-related adverse events[J]. Int J Cardiol, 2015, 11(15): 84-89.
[11]DANDAMUDI G, RAMPURWALA A Y, MAHENTHIRAN J,et al. Persistent left ventricular dilation in tachycardia induced cardiomyopathy patients after appropriate treatment and normalization of ejection fraction[J]. Heart Rhythm, 2008, 5(8):1111-1114.
[12]FREIXA X, BERRUEZO A, MONT L, et al. Characterization of focal right atrial appendage tachycardia[J]. Europace, 2008,10(1): 105-109.
[13]CHEN M, YANG B, WRIGHT M, et al. Successful catheter ablation of a focal atrial tachycardia from the ascending aorta: a novel location and approach[J]. Circ Arrhythm Electrophysiol,2009, 2(11): e34.
[14]MONAHAN K D. Effect of aging on baroref l ex function in humans[J]. Am J Physiol Regul Integr Comp Physiol, 2007, 293:R3-R12.
[15]WANG H J, ROZANSKI G J, ZUCKER I H. Cardiac sympathetic afferent ref l ex control of cardiac function in normal and chronic heart failure states[J]. Physiol, 2017, 10(24): 1113.
[16]YIP A M, ZHAI A B, HADDAD H. Heart rate and heart failure[J].Curr Opin Cardiol, 2016, 31(2): 204-208.
[17]DEYELL M W, PARK K, HAN Y, et al. Predictors of recovery of left ventricular dysfunction after ablation of frequent ventricular premature depolarizations[J]. Heart Rhyhm, 2012, 9(9): 1465-1472.
[18]NIA A M, GASSANOV N, DAHLEM K M, et al. Diagnostic accuiacy of NT-proBNP ratio for early diagnosis of tachycardia mediated cardiomyopathy:a pilot study[J]. Clinl Res Cardiol,2011, 100(10): 887-896.
[19]HES M, KONDO C S, CLARK R B, et a1. Dilated cardiomyopathy in aeasciated with reduced espression of the cardiac modium channel scrl5a[J]. Clinl Res Cardiol, 2007, 75(3):498-509.
[20]THOMAS D E, WHEELER R, YOUSEF Z R, et al. Therole of echocardiography in guiding management in dilated cardiomyopathy[J]. Euro J Echocardiogr, 2009, 10(8): 115-121.

