MASP-2在大肠癌患者血清及组织中的表达及其意义*
刘雪晴,石永威,李志江,刘坤,贾天军
(河北北方学院医学检验学院 临床检验教研室,河北 张家口 075000)
有研究发现人甘露糖结合凝集素相关丝氨酸蛋白酶2(mannan-binding lectin associated serine protease, MASP-2)在患者血清中的浓度的变化与某些疾病,如慢性感染﹑恶性肿瘤及自身免疫性疾病等存在一定的相关性[1]。近几年来,随着饮食结构的改变和人民生活水平的提高,大肠癌的发病率逐年增高,成为临床上常见的恶性肿瘤,严重危害了人类的健康。由于在总体治疗效果和预后等方面不尽人意,人们迫切寻求一种新的﹑综合性的及有效的治疗方法来改变这一现象。
1 资料与方法
1.1 一般资料
选取2016年1月-2016年7月于河北北方学院附属第一医院胃肠外科诊断为大肠癌的患者52例作为癌症组。患者均未进行过放化疗,每位患者取癌旁正常组织1例。另选取本院体检中心年龄﹑性别结构相类似的80例健康人群外周血标本作为对照组。
1.2 方法
1.2.1 MASP-2浓度测定 将所有血清标本和试剂盒提前取出,平衡至室温,1∶10倍稀释,严格按照试剂盒的操作说明书进行操作。
1.2.2 免疫组织化学法 标本固定﹑脱水﹑透明﹑浸蜡﹑包埋及切片,二甲苯脱蜡,酒精水化,室温孵育,抗原微波修复。滴加一抗,4℃冰箱过夜。滴加二抗。滴加链亲合素标记的辣根过氧化物酶,37℃,30min。显色液显色,显微镜下观察显色情况,及时终止。自来水下充分冲洗,苏木素复染。中性树胶封片。在显微镜下观察结果。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以率表示,比较用χ2检验;P<0.05为差异有统计学意义。
2 结果
2.1 两组患者MASP-2比较
癌症组患者血清MASP-2浓度为(303.22±125.76)ng/ml,对照组患者为(482.24±201.24)ng/ml,两组比较,差异有统计学意义(t=5.766,P=0.001),癌症组低于对照组。
2.2 癌症组患者不同临床病理因素与MASP-2表达的关系
癌症组不同年龄﹑性别﹑TNM分期﹑淋巴结转移及癌症类型患者的MASP-2比较,差异无统计学意义(P>0.05);癌症组低分化患者与高-中分化患者的MASP-2浓度比较,差异有统计学意义(P<0.05)。见附表。
2.3 两组患者MASP-2阳性率比较
癌症组患者MASP-2阳性率为57.69%(30/52),对照组患者为28.85%(15/52),经χ2检验,差异有统计学意义(χ2=8.814,P=0.003)。
2.4 大肠癌组织和癌旁正常组织中MASP-2的表达
表达部位在细胞核,呈棕黄色,在癌旁组织中阳性表达少,偶见细胞核呈淡黄色。见附图。
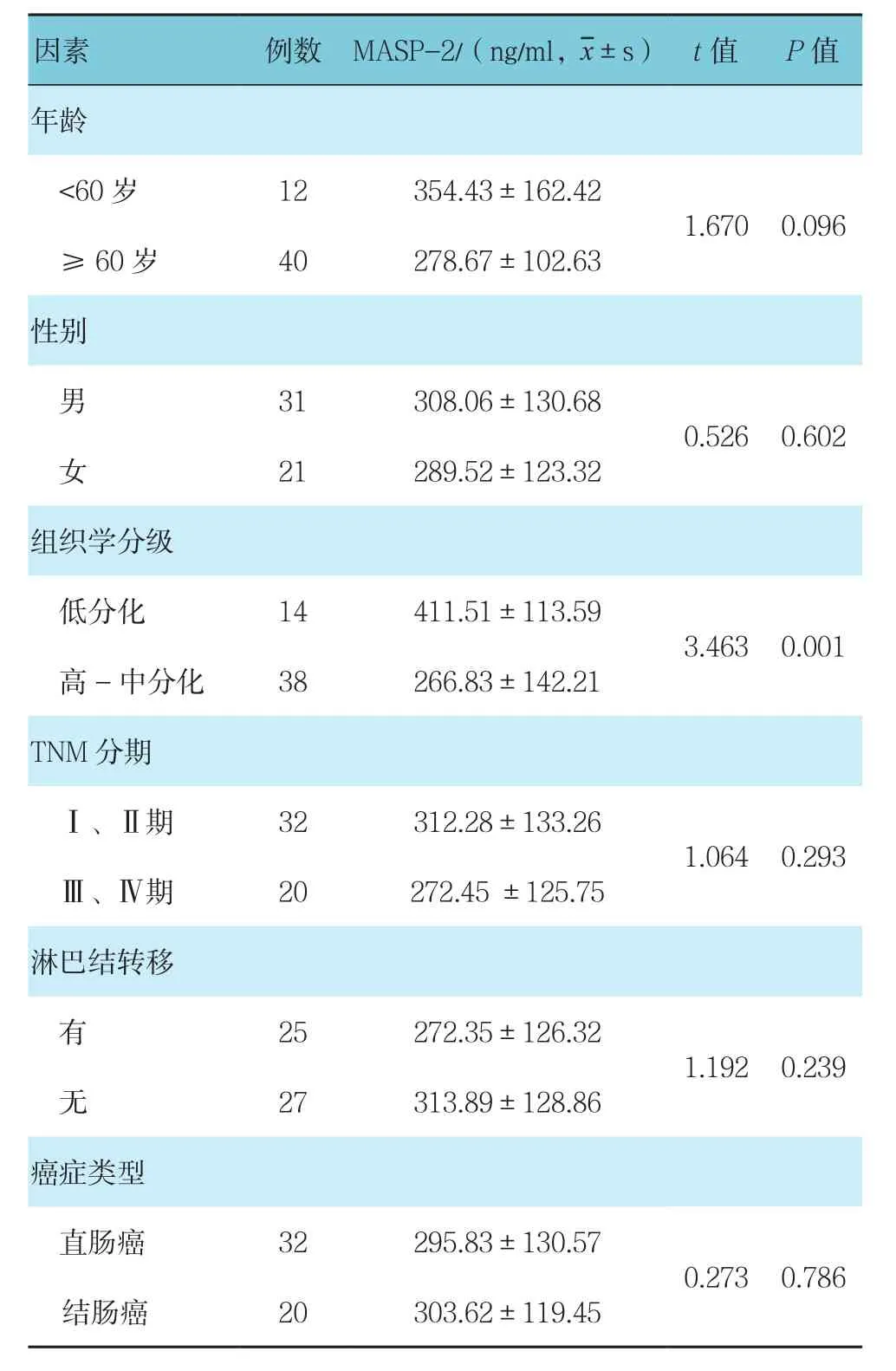
附表 癌症组患者不同临床病理因素与MASP-2的关系
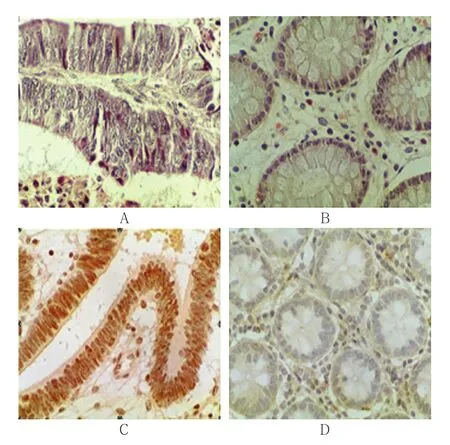
附图 大肠癌组织和癌旁正常组织中MASP-2的表达(×200)
3 讨论
国外有文献报道显示大肠癌患者术前血清MASP-2蛋白的浓度和活性高于对照组[2]。甲状腺乳头状癌患者血清中MASP-2的浓度高于甲状腺瘤和正常人群[3]。MASP-2可能通过恶化炎症和促进增殖而引起肿瘤的侵袭和转移,提示血清中MASP-2浓度可作为预测大肠癌复发和存在时间的独立指标[4-5]。然而关于两者的相关性,不同研究小组得出的结论存在差异[6]。石燕萍等[7]报道甲状腺肿瘤患者与健康对照者相比MASP-2浓度增高,但未进一步分析MASP-2浓度与疾病转归的影响,也未对其升高具体机制进行阐明。
肿瘤细胞的分化程度是指肿瘤细胞与其相应的正常细胞的相似程度。高分化癌与正常的组织类似,成熟度较高,恶性程度低。低分化癌成熟度较差,恶性程度高。MASP-2在恶性程度高的低分化肿瘤中的浓度高于恶性程度低的高-中分化肿瘤,提示恶性程度越高,表达量越低。大肠癌患者血清中MASP-2浓度较健康人群偏低的结果与国外报道有所出入,这种差异有可能与不同地区﹑不同种族有关,也有可能与实验人群年龄分布有关,还有可能与样本量较少有关。
国内最新报道,在胃癌组织中,MASP-2为低表达,而在癌旁组织中高表达[8]。石燕萍等[9]报道MASP-2在甲状腺乳头状癌组织中升高,但在癌旁正常甲状腺组织中无表达,且与其他临床资料无明显相关性。SWIERZKO等[10]报道MASP2在卵巢癌中的表达量高于正常卵巢和良性卵巢肿瘤。VERMA等[11]运用免疫组织化学法检测了食管鳞状细胞癌患者在不同阶段MASP-2的表达,结果显示MASP-2主要是在癌症晚期和转移的过程中表达,其表达与疾病的进展和肿瘤侵袭性密切相关。有文章报道在卵巢癌中MASP-2的基因表达高于健康对照组,表明MASP-2可能通过补体激活的凝集素途径参与了卵巢癌的疾病过程[12]。本研究证实MASP-2阳性率在癌症组中的表达量高于对照组,这与血清中MASP-2浓度检测结果有所出入,还需进一步研究。总之MASP-2参与了肿瘤的发生和发展。
本研究为深入研究大肠癌的发生﹑发展奠定了实验基础。但关于MASP-2在大肠癌侵袭及转移之间的机制还有待于更进一步的研究。
参 考 文 献:
[1]VARGA L, SZEPLAKI G, LAKI J, et al. Depressed activation of the lectin pathway of complement in hereditary angioedema[J].Clin Exp Immunol, 2008, 153(1): 68-74.
[2]YTTING H, CHRISTENAEN I J, THIEL S, et al. Pre-and postoperative levels in serum of mannose-binding lectin associated serine protease-2-aprognostic marker in colorectal cancer[J]. Hum Immunol, 2008, 69(7): 414-420.
[3]SHI Y, LIU G, ZHANG H, et al. Expressions and clinical signifiances of mannose-binding lectin (MBL) and MBL-associated serine protease 2 (MASP -2) in patients with thyroid neoplasm[J].Chin Ger J Clin Oncol, 2013, 12(13): 106-108.
[4]KOCSIS J, MESZAROS I, MADARAS B, et al. High levels of acute phase proteins and soluble 70 KDa heat shock proteins are independent and additine risk factors for mortality in colorectal cancer[J]. Cell Stress Chaperones, 2011, 16(1): 49-55.
[5]张海燕. MASP2与肿瘤相关性的研究进展[J]. 免疫学杂志,2015, 31(9): 812-815.
[6]YTTING H, CHRISTENAEN I J, STEFFENSEN R, et al.Mannose-binding lectin (MBL) and MBL-Associated serine protease-2 (MASP-2) genotypes in colorectal cancer[J]. Seand J Immunol, 2011, 73(2): 122-127.
[7]石燕萍, 刘阁玲, 张慧芹, 等. MASP-2 甲状腺肿瘤患者血清MBL和MASP-2的表达及意义[J]. 广东医学, 2012, 33(2):229-230.
[8]段廷旺, 周永宁. MBL/MASP-2/P53在胃癌组织及癌旁组织中的表达情况[J]. 中国社区医师, 2015, 31(4): 112-113.
[9]石燕萍, 刘阁玲, 张慧芹, 等. MASP-2在甲状腺肿瘤中的表达及其临床意义[J]. 中国现代医药杂志, 2010, 12(10): 4-6.
[10]SWIERZKO A S, SZALA A, SAWICKI S, et al. Mannose -binding lectin (MBL) and MBL -associated serine protease -2 (MASP-2)in women with malignant and benign ovarian tumours[J]. Cancer Immunol Immunother, 2014, 63(11): 1129-1140.
[11]VERMA A, MATTA A, SHUKLA N K, et al. Clinical significance of mannose-binding lectin-associated serine protease-2 expression in esophageal squamous cell carcinoma[J]. Int J Cancer, 2006,118(12): 2930-2935.
[12]SWIERZKO A S, SZALA A, SAWICKI S, et al. Mannose-binding lectin (MBL) and MBL-associated serine protease-2 (MASP-2)in women with malignant and benign ovarian tumours[J]. Cancer Immunology, Immunotherapy, 2014, 63(11): 1129-1140.

